Для определения направления и полноты протекания окислительно-восстановительных реакций между окислительно-восстановительными системами в водных растворах используются значения электродных потенциалов этих систем.
Экспериментально определить абсолютное значение электродного потенциала невозможно. Поэтому на практике измеряется разность потенциалов между электродным потенциалом исследуемой системы и потенциалом электрода сравнения. В качестве стандартного электрода сравнения обычно используют водородный электрод. Он изготавливается из губчатой платины, погруженной в раствор H2SO4 c активностью ионов водорода, равной единице (что соответствует примерно их концентрации, равной 1 моль/л). Через раствор при 298 К (25 оС) под давлением в 101,325 кПа пропускается газообразный водород, который поглощается губчатой платиновой пластиной.
Таким образом, поверхность платинового электрода фактически насыщена водородом, в результате чего в системе устанавливается равновесие:
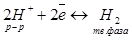
которое характеризуется определенным значением скачка потенциала на межфазной границе. Электродный потенциал, отвечающий данным условиям, получил название стандартного водородного потенциала, а его численное значение условно принято равным нулю.
Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях всех участвующих в нем веществ, равных единице.
Стандартные электродные потенциалы окислительно-восстановительных систем приводятся в справочной литературе. Эти системы записаны в форме уравнений полуреакций восстановления, в левой части которых находятся атомы, ионы или молекулы, принимающие электроны (окисленная форма):
Ox + n× 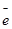 = Red.
= Red.
Эти системы в таблицах расположены в порядке возрастания величин их потенциалов, что соответствует падению восстановительной и росту окислительной активности. Система с большим электродным потенциалом всегда является окислителем по отношению к системе с меньшим потенциалом.
Для поддержания электрического тока в проводнике необходим какой-то внешний источник энергии, который все время поддерживал бы разность потенциалов на концах этого проводника.
Такими источниками энергии служат так называемые источники электрического тока, обладающие определенной электродвижущей силой, которая создает и длительное время поддерживает разность потенциалов на концах проводника. Электродвижущая сила (эдс) - физическая величина, характеризующая действие сторонних (непотенциальных) сил в источниках постоянного или переменного тока.
Электролиз.
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Дата: 2019-02-25, просмотров: 294.