КОНТРОЛЬНАЯ РАБОТА
по дисциплине
«Химия »
вопросы 1,5,11,18,24,29,31,34,37,42
Выполнил: студент Кропотов С.Н.
ЭНИ, ЗЭ-181, 1 курс, 19
Проверил:
Омск 2019
Содержание
Основные химические понятия и законы.
2.Природа сил химического взаимодействия.
Основные классы неорганических соединений; кислоты, основание
и соли.
4.Термохимические законы.
Факторы, влияющие на скорость химической реакции.
Водные растворы. Способы выражения состава растворов.
Электролитическая диссоциация и причины ее возникновения.
Характеристика жидкого состояния вещества.
Электродные потенциалы. Электродвижущие силы.
Электролиз.
Природа сил химического взаимодействия.
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, кристаллы.
В разнообразных химических соединениях химическая связь бывает различного типа; наиболее важные типы химической связи – это ковалентная (неполярная, полярная), ионная, металлическая. Разновидностями этих типов связи являются донорно-акцепторная, водородная и др. Между атомами металлов возникает металлическая связь.
Химическая связь, осуществляемая за счет образования общей, или поделенной, пары или нескольких пар электронов, называется ковалентной. В образование одной общей пары электронов каждый атом вносит по одному электрону, т.е. участвует «в равной доле».
По своей природе химическая связь представляет собой электростатическую силу притяжения между отрицательно заряженными электронами и положительно заряженными ядрами. Величина этой силы притяжения зависит от электронной конфигурации внешней оболочки атомов. Например, благородные газы с трудом образуют химические связи, потому что они имеют устойчивую внешнюю электронную оболочку. В отличие от этого элементы, атомы которых имеют во внешней оболочке только один электрон, легко образуют связи. Примером таких элементов является водород.
Термохимические законы.
А). Первый закон термохимии (Лавуазье и Лаплас):
тепловой эффект образования данного соединения в точности равен, но обратен по знаку тепловому эффекту его разложения.
Из закона Лавуазье—Лапласа следует невозможность построить вечный двигатель I рода, использующий энергию химических реакций.
Б). Второй закон термохимии (Г. И. Гесс):
Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствия из закона Гесса:
1. Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.
2. Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учётом коэффициентов в уравнении реакции (то есть помноженные на них).
Закон Гесса может быть записан в виде следующего математического выражения:
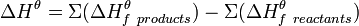 .
.
С помощью закона Гесса можно рассчитать энтальпии образования веществ и тепловые эффекты реакций, которые невозможно измерить экспериментально.
В). Закон Кирхгофа
Закон Кирхгофа устанавливает зависимость теплового эффекта химической реакции от температуры: температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Закон Кирхгофа лежит в основе расчёта тепловых эффектов при разных температурах.
Электролиз.
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
КОНТРОЛЬНАЯ РАБОТА
по дисциплине
«Химия »
вопросы 1,5,11,18,24,29,31,34,37,42
Выполнил: студент Кропотов С.Н.
ЭНИ, ЗЭ-181, 1 курс, 19
Проверил:
Омск 2019
Содержание
Основные химические понятия и законы.
2.Природа сил химического взаимодействия.
Дата: 2019-02-25, просмотров: 289.