Основания состоят из металла и одновалентных гидроксогрупп ОН, число которых равно валентности металла. Примерами оснований могут служить гидроксид натрия NaOH, гидроксид меди Сu(ОН)2.
Важнейшее химическое свойство оснований - способность образовывать с кислотами соли. Например, при взаимодействии перечисленных оснований с соляной кислотой получаются хлористые соли соответствующих металлов - хлориды натрия или меди:
NaOH + НС1 = NaCl + Н2О; Cu(OH)2 + 2НС1 = CuCl2 + 2Н2О.
Основания классифицируют по их растворимости в воде и по их силе. По растворимости основания делятся на растворимые, или щелочи, и на нерастворимые. Важнейшие щелочи - это гидроксиды натрия, калия и кальция. По силе основания делятся на сильные и слабые. К сильным относятся все щелочи, кроме гидроксида аммония. Согласно международной номенклатуре соединения, содержащие в своем составе гидроксогруппы, называют гидроксидами. В случае металлов переменной валентности в скобках указывают валентность металла в данном соединении. Так, Са(ОН)2 - гидроксид кальция, Fe(OH)2 - гидроксид железа (II), Fe(OH)3 - гидроксид железа (III).
Кислоты состоят из водорода, способного замещаться металлом, и кислотного остатка, причем число атомов водорода равно валентности кислотного остатка. Примерами кислот могут служить соляная (хлористоводородная) НСl, серная H2SO4, азотная HNO3, уксусная СН3СООН.
Важнейшее химическое свойство кислот - их способность образовывать соли с основаниями. Например, при взаимодействии кислот c гидроксидом натрия получаются натриевые соли этих кислот:
2NaOH + H2SO4 = Na2SO4 + 2H2O; NaOH + HNO3 = NaNO3 + H2O.
Кислоты классифицируются по их силе, по основности и по наличию кислорода в составе кислоты. По силе кислоты делятся на сильные и слабые. Важнейшие сильные кислоты - это азотная, серная и соляная.
Основностью кислоты называется число атомов водорода в молекуле кислоты, способных замещаться на металл с образованием соли. Такие кислоты, как соляная и уксусная, могут служить примерами одноосновных кислот, серная кислота - двухосновна, ортофосфорная кислота Н3РО4 - трехосновна.
Продукты замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотный остаток представляют собою соли. При полном замещении получаются средние (нормальные) соли, при неполном - или кислые, или основные. Кислая соль получается при неполном замещении водорода кислоты на металл. Основная соль получается при неполном замещении гидроксогрупп основания на кислотный остаток. Ясно, что кислая соль может быть образована только кислотой, основность которой равна двум или больше, а основная соль - металлом, валентность которого равна двум или больше.
Примеры образования солей:
Са(ОН)2 + H2SO4 = СаSO4 + 2Н2О,
Термохимические законы.
А). Первый закон термохимии (Лавуазье и Лаплас):
тепловой эффект образования данного соединения в точности равен, но обратен по знаку тепловому эффекту его разложения.
Из закона Лавуазье—Лапласа следует невозможность построить вечный двигатель I рода, использующий энергию химических реакций.
Б). Второй закон термохимии (Г. И. Гесс):
Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствия из закона Гесса:
1. Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.
2. Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учётом коэффициентов в уравнении реакции (то есть помноженные на них).
Закон Гесса может быть записан в виде следующего математического выражения:
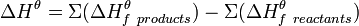 .
.
С помощью закона Гесса можно рассчитать энтальпии образования веществ и тепловые эффекты реакций, которые невозможно измерить экспериментально.
В). Закон Кирхгофа
Закон Кирхгофа устанавливает зависимость теплового эффекта химической реакции от температуры: температурный коэффициент теплового эффекта химической реакции равен изменению теплоёмкости системы в ходе реакции. Закон Кирхгофа лежит в основе расчёта тепловых эффектов при разных температурах.
Дата: 2019-02-25, просмотров: 269.