Функционирование названных выше механизмов обеспечивает экстренную компенсацию сократительной функции перегруженного или повреждённого миокарда. Это сопровождается значительным и более или менее длительным увеличением интенсивности функционирования сердца — его компенсаторной гиперфункцией.
Компенсаторная гипертрофия сердца
Гиперфункция миокарда обусловливает экспрессию отдельных генов кардиомиоцитов. Она проявляется увеличением интенсивности синтеза нуклеиновых кислот и белков. Ускорение синтеза нуклеиновых кислот и белков миокарда приводит к нарастанию его массы — гипертрофии. Биологическое значение компенсаторной гипертрофии сердца заключается в том, что увеличенная функция органа выполняется его возросшей массой.
Механизмы декомпенсации гипертрофированного сердца
Потенциальные возможности гипертрофированного миокарда и увеличивать силу и скорость сокращения не беспредельны. Если на сердце продолжает действовать повышенная нагрузка или оно дополнительно повреждается, сила и скорость его сокращений падают, а их энергетическая «стоимость» возрастает: развивается декомпенсация гипертрофированного сердца.
Механизмы декомпенсации гипертрофированного сердца перечислены на рис. 22–26.
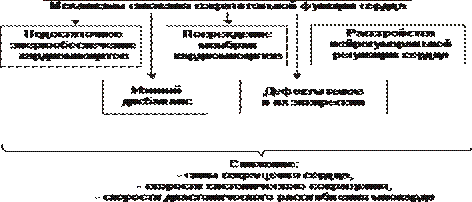
Рис. 22–26. Основные механизмы декомпенсации гипертрофированного сердца.
В основе декомпенсации длительно гипертрофированного миокарда лежит нарушение сбалансированности роста различных его структур. Эти сдвиги — наряду с другими (см. рис 22–26) — в конечном счёте обусловливает уменьшение силы сердечных сокращений и скорости контрактильного процесса, т.е. — развитие сердечной недостаточности.
Клеточно-молекулярные механизмы сердечной недостаточности
Снижение сократительной функции сердца является итогом развития сердечной недостаточности самой разной этиологии. Несмотря на различие причин и известное своеобразие начальных звеньев патогенеза сердечной недостаточности, её механизмы на клеточном и молекулярном уровне едины. Главные из этих механизмов приведены на рис. 22–27.
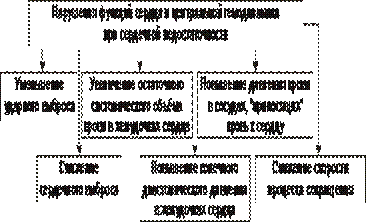
Рис. 22–27. Основные механизмы снижения сократительной функции миокарда при сердечной недостаточности.
• Недостаточность энергетического обеспечения клеток миокарда
Расстройство энергоснабжения основных процессов, происходящих в клетках миокарда (прежде всего его сокращения и расслабления), развивается вследствие нарушения: ресинтеза макроэргов, транспорта их энергии к эффекторным структурам кардиомиоцитов, утилизации ими энергии макроэргических фосфатных соединений. Эти звенья патогенеза в общем виде рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Расстройства энергетического обеспечения клетки»).
Нарушение обеспечения кардиомиоцитов энергией на этапах её продукции, транспорта и утилизации может быть как стартовым механизмом снижения сократительной функции сердца, так и существенным фактором нарастания её депрессии.
• Повреждение мембран и ферментов кардиомиоцитов
Повреждение клеточных мембран и ферментов рассмотрено в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Повреждение мембран и ферментов»).
Альтерация мембран и ферментов клеток миокарда — главное, а нередко и инициальное звено патогенеза сердечной недостаточности. Изменение физико‑химических свойств и конформации молекул белка (структурных и ферментов), липидов, фосфолипидов и ЛП сопровождается значительным обратимым, а часто — необратимым повреждением структуры и функции мембран и ферментов, в том числе — митохондрий, саркоплазматического ретикулума, миофибрилл, плазматической мембраны, обеспечивающих реализацию сократительной и ритмической функций сердца.
• Ионный дисбаланс
Нарушение содержания и соотношения между отдельными ионами внутри и вне клеток рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Дисбаланс ионов и воды в клетке»). Ниже приведены специфичные для развития сердечной недостаточности особенности ионного дисбаланса.
Ионный дисбаланс при сердечной недостаточности проявляется нарушением соотношения между отдельными ионами в разных секторах кардиомиоцитов: в органеллах (митохондриях, саркоплазматическом ретикулуме, миофибриллах), в цитозоле, по разные стороны плазматической мембраны кардиомиоцитов. В наибольшей степени это относится к ионам: K+, Na+, Ca2+. Именно эти катионы в основном определяют реализацию таких процессов, как возбуждение, электромеханическое сопряжение, сокращение и расслабление миокарда.
• Нарушения в генетической программ кардиомиоцитов
Нарушения в генетической программе клеток и/или механизмов её реализации рассмотрены в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Генетические нарушения»).
При сердечной недостаточности происходит активация генов, контролирующих процессы обновления субклеточных структур кардиомиоцитов, а также роста сосудов микроциркуляторного русла и нервных волокон. В частности, при ишемическом и стрессорном повреждении сердца подавлена экспрессия мРНК, для Ca2+‑зависимой АТФазы саркоплазматической сети. Это и потенцирует ингибирование процессов захвата и выброса Ca2+ ретикулумом миоцитов. В условиях ишемии и инфаркта миокарда, хронического эмоционально‑болевого стресса подавлен также процесс трансляции генетической информации. Это сопровождается нарушением синтеза различных белков клеток миокарда.
• Расстройства нейрогуморальной регуляции сердца
Общая характеристика нарушений регуляции клеточных функций приведена в главе 4 «Патология клетки» (раздел «Общие механизмы повреждения», подраздел «Расстройства регуляции внутриклеточных процессов»). Ниже рассмотрены важные для развития сердечной недостаточности изменения симпатической и парасимпатической регуляции сердца.
† Изменение механизмов симпатической регуляции.
‡ Уменьшение содержания нейромедиатора симпатической нервной системы — норадреналина в ткани сердца.
Причины. Снижение синтеза норадреналина в нейронах симпатической нервной системы (в норме в них образуется около 80% медиатора, содержащегося в миокарде). Является результатом подавления активности фермент тирозин гидроксилазы и торможение захвата норадреналина нервными окончаниями.
‡ Снижение адренореактивных свойств сердца, т.е. выраженности ино-, хроно-, дромо- и батмотропных эффектов норадреналина и адреналина.
† Изменение механизмов парасимпатической регуляции.
‡ Ацетилхолин через м‑холинорецепторы вызывает уменьшение частоты сердечных сокращений, ингибируя образование цАМФ и активируя образование цГМФ. цГМФ активирует цГМФ‑зависимую киназу, подавляющую активность потенциалозависимых Ca2+‑каналов.
‡ Изменение механизмов парасимпатической регуляции при сердечной недостаточности выражены значительно меньше, чем симпатической. Это является результатом более высокой резистентности парасимпатических механизмов к различным повреждающим факторам.
Последствия нарушенных симпатических и парасимпатических влияний на миокард состоят в снижении степени управляемости и надёжности регуляции сердца. Это приводит к падению темпа и величины мобилизации сократительной функции сердца, особенно в чрезвычайных условиях.
Дата: 2019-02-25, просмотров: 375.