Наиболее распространенными заболеваниями желудка являются гастрит, язва, полипоз и рак. Для диагностики этих заболеваний используются не только методы определения секреторной функции желудка, но и цитологическое исследование.
Материалом для цитологического исследования может служить содержимое желудка, полученное во время зондирования, промывные воды желудка, собранные различными способами (по А. Я. Альтгаузену, балонным методом, целенаправленным отсасыванием по Н. Н. Шиллер-Волковой), мазки-отпечатки с кусочков слизистой оболочки желудка, полученных с помощью биопсийных щипцов при гастрофиброскопии под контролем зрения.
Слущивание эпителиоцитов усиливается при применении механического раздражителя - зонда-баллона. При заболеваниях желудка его слизистая оболочка нередко покрыта толстым слоем слизи, которая препятствует процессу слущивания клеток. Путем предварительного введения в желудок муколитического фермента папаина или альфа-химотрипсина можно вызвать растворение слизистого барьера и таким образом создать благоприятные условия для максимального слущивания клеток эпителия слизистой оболочки желудка. В желудочном содержимом под влиянием кислой реакции за счет соляной и летучих (молочной, масляной и др.) кислот при застойных явлениях эпителиоциты видоизменяются и даже разрушаются. Особенно легко разрушаются нестойкие опухолевые клетки. Разбавление небольшого количества желудочного содержимого натощак промывными водами способствует сохранению структуры клеток, слущенных с поверхности опухоли.
Метод промывания желудка для диагностики рака желудка не получил широкого применения в практике, хотя дает положительные результаты в 70 % случаев.
При промывании желудка по А. Я. Альтгаузену больному вводят натощак в желудок толстый зонд с воронкой и извлекают содержимое в отдельную посуду. Не вынимая зонда, вводят через воронку 300 мл теплой воды и сразу же извлекают ее. Затем процедуру повторяют, используя другую посуду. После отстаивания в течение 1—2 ч жидкость над осадком сливают, а осадок помещают в чашку Петри. Металлическим шпателем и препаровальной иглой отбирают слизистые, кровянистые, плотноватые и другие частицы, из которых готовят препараты для микробиологического исследования.
В промывных водах отсутствуют пищевые массы, поэтому возможен наиболее полный отбор частиц для микроскопического исследования. При застойных явлениях в желудке, что нередко наблюдается при опухолях, необходимо для удаления пищи вечером накануне исследования промыть желудок. После этого до утреннего промывания больной пищу не принимает.
Хотя процесс получения промывных вод является трудоемким, он менее опасен, чем взятие для исследования микробиоптата, и имеет важное значение в диагностике злокачественных опухолей желудка.
Несколько сложнее баллонный способ получения промывных вод с помощью двойного гастродуоденального зонда. Один зонд предназначен для аспирации жидкости: в ротовой конец зонда вставляют шприц, а конец, расположенный в желудке, имеет дуоденальную оливу с более широкими отверстиями. Второй зонд имеет тонкостенный резиновый мешочек цилиндрической формы, помещенный в сеточку из шелковых нитей, ротовой конец зонда соединен с грушей для накачивания в баллон воздуха. Груша имеет клапан для выпускания воздуха.
Зонд, смоченный теплым изотоническим раствором натрия хлорида, вводят натощак. Сначала отсасывают все содержимое желудка и промывают его изотоническим раствором натрия хлорида. Затем воздухом надувают мешочек, и он перистальтическими движениями продвигается к привратнику. Далее воздух выпускают, зонд подтягивают к привратниковой пещере и вновь надувают резиновый мешочек. Такую процедуру повторяют пять раз на протяжении 30 мин, за это время несколько раз отсасывают содержимое желудка. После извлечения зонда его обмывают 200 мл изотонического раствора натрия хлорида. Смыв и жидкость центрифугируют в течение 30 мин при 1500 об/мин. Из осадка готовят препараты для цитологического исследования.
По методу Н. Н. Шиллер-Волковой, пробу из желудка получают путем целенаправленного отсасывания с места предполагаемого поражения, промывая необходимую область желудка небольшими порциями (20 мл) подогретого изотонического раствора натрия хлорида. Для этого используют дуоденальный зонд со специальной крупной оливой, имеющей параллельно расположенные продольные углубления, на дне которых находятся отверстия.
При замедленной эвакуации оставшуюся пищу удаляют накануне вечером путем тщательного промывания желудка. Утром натощак под контролем рентгеноскопии вводят зонд таким образом, чтобы его олива как можно больше приближалась к месту поражения. При этом больному в зависимости от локализации опухоли (на боку, спине, животе) придают наиболее удобное для исследования положение. После установки оливы на желаемом уровне присасывающими движениями шприца отсасывают жидкость и собирают ее в пробирку. При прекращении поступления жидкости через зонд вводят 20 мл подогретого изотонического раствора натрия хлорида, который тут же отсасывают. Промывание повторяют 3-5 раз, массируя переднюю брюшную стенку в месте расположения оливы.
В лаборатории промывную жидкость разливают тонким слоем по чашкам Петри для просмотра невооруженным глазом или через специальную лупу. Для микроскопического исследования отбирают наиболее плотные частицы, участки с прожилками крови. Отобрать и исследовать необходимо по возможности весь материал (10-12 процентов).
В нативных и окрашенных препаратах, приготовленных из промывных вод желудка, обнаруживаются различное количество лейкоцитов, эпителиоциты желудка, а при злокачественной опухоли - атипичные клетки. Данные микроскопического исследования в комплексе с результатами функциональных и клинических исследований позволяют установить характер патологического процесса.
Для диагностики заболеваний желудка используют также материал, полученный прицельно при гастрофиброскопии. Проводят в основном гистологическое исследование, цитологическую диагностику применяют при получении очень маленького кусочка слизистой оболочки желудка, непригодного для приготовления гистологического препарата, а также в тех случаях, если биоптат состоит из слизи, фибрина, детрита и разрозненных клеток эпителия. Сразу после выведения щипцов-чашечек, применяемых для биопсии, из канала гастрофиброскопа полученный материал с помощью иглы помещают на предметное стекло, готовят мазки-отпечатки, а затем опускают оставшийся кусочек ткани в формалин и направляют на гистологическое исследование.
При значительном поражении поверхности слизистой оболочки желудка рекомендуется брать материал для цитологического исследования путем соскоба с помощью нейлоновой щетки, однако недостатком этого способа является то, что основная масса клеток в полученном материале разрушена.
Цитограммы материала, полученного путем гастрофибробиопсии, отличаются от цитограмм промывных вод желудка. В мазках выявляются в основном клетки поверхностного эпителия, желез желудка и небольшое количество клеток из вышележащих отделов пищеварительного канала.
Клетки собственных желез желудка располагаются в виде трубочек или округлых структур. Главные клетки округлой формы, средней величины, с центрально расположенным круглым ядром, в цитоплазме их базофильная зернистость. Париетальные клетки обнаруживаются, как правило, среди главных, крупнее последних, содержат почти центрально расположенное небольшое круглое ядро и широкую оксифильную цитоплазму. Мукоциты небольшой величины, морфологически сходны с цилиндрическим эпителием, поэтому цитологически дифференцировать их трудно.
Клетки эпителия кардиальных и пилорических желез небольшой величины, округлой формы, с центрально расположенным небольшим гиперхромным ядром и широкой вакуолизированной (пенистой) цитоплазмой.
Лейкоциты, которые создают фон мазка, приготовленного из осадка промывных вод желудка, и эритроциты в цитограммах биоптата диагностического значения не имеют. Наличие скоплений и комплексов клеток может быть обусловлено неравномерным распределением полученного материала. Большое значение имеют клеточный полиморфизм и изменения структуры ядер:
· анизоцитоз;
· наличие полиморфных и гиперхромных ядер;
· появление больших, окрашенных в голубой цвет ядрышек;
· неравномерное глыбчатое распределение хроматина.
Цитологическое исследование гастробиоптата дает возможность провести раннюю диагностику рака желудка даже при отсутствии инвазивного роста.
При оценке цитологических препаратов, согласно классификации Папаниколау и Коопер, клетки эпителия распределяют на пять классов.
К I классу относят нормальные эпителиоциты; ко II - эпителиоциты (в увеличенном количестве) с дегенеративными изменениями; к III и IV - эпителиоциты с укрупненными ядрами, встречающиеся при язвенной болезни в случае обострения; к V классу - злокачественно измененные клетки.
В настоящее время данные по эксфолиативной цитологии могут быть разделены на две группы:
· исследования, посвященные изучению желудочного лейкопедеза - феномена миграции лейкоцитов из сосудистого русла в просвет желудка
· изучение слущенных эпителиальных клеток слизистой оболочки желудка - собственно эксфолиативная цитология.
Оценка данных желудочного лейкопедеза во многом зависит от метода получения материала. На показатели лейкопедеза влияют количество слюны, слизи, заглоченных из полости рта, а также слизь самого желудочного содержимого.
Для получения «чистого желудочного» лейкопедеза М. А. Ясиновский предложил метод «последовательного полоскания». Желудок натощак промывается 1000,0 физиологического раствора, а затем каждые 15 мин. подобные промывания повторяются, но только меньшим количеством физиологического раствора - 250 мл. В последних порциях у нормальных людей, по мнению автора, лейкоцитов не должно быть. Значительно более прост метод Новикова - лейкоциты подсчитываются в камере Горяева. Желудочное содержимое, полученное порциями каждые 15 мин без применения пробных раздражителей (банальная секреция) в течение часа, разводится в 10 раз (первая порция исключается). За норму принимается 300 лейкоцитов в 1 мм.
При наличии патологического процесса в желудке, особенно воспалительного характера, количество лейкоцитов повышается.
Цитодиагностика желудочных заболеваний - собственно эксфолиативная цитология основана на физиологическом слущивании клеток поверхностного эпителия, которое усиливается в патологических условиях. Для получения большего количества клеточного материала слущивание клеток поверхностного эпителия слизистой оболочки желудка может быть усилено с помощью специальных приборов. Однако, все эти приборы имеют общий недостаток - при их использовании слущивание клеток поверхностного эпителия слизистой оболочки проводится сравнительно грубым механическим путем и не связано с нормальной эксфолиацией. Метод Shade - простого промывания желудка не имеет этого недостатка и дает клеточный материал, происхождение которого связано только с нормальной физиологической эксфолиацией клеток поверхностного эпителия желудка. Но при использовании его количество клеточного материала крайне недостаточно, что затрудняет оценку результатов исследования. Существует также метод получения клеточного материала из желудка с помощью предварительного введения в него муколитических ферментов, в частности папаина или альфа-химотрипсина. Ферменты растворяют слизистый барьер поверхности слизистой оболочки желудка и способствуют, таким образом, слущиванию клеток.
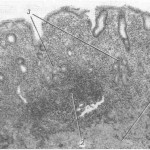
Рисунок 2 - Слизистая оболочка больного атрофическим гастритом
Для получения достаточного клеточного материала с максимальным приближением к физиологическим условиям эксфолиации наиболее целесообразно использовать абразивный зонд - баллон. С его помощью можно сочетать промывание желудка с нежной абразией слизистой оболочки раздутым баллоном. Преимущество такого прибора заключается еще и в том, что клеточный материал, получается, через зонд, минуя пищевод и полость рта.
После обработки материала (фиксация, окраска) приготовляется микроскопический препарат - гастроцитограмма - клеточная картина содержимого желудка, состоящая главным образом из клеток поверхностного эпителия.
У здоровых людей количество клеток в гастроцитограмме оказывается незначительным, клетки встречаются единичные или небольшими группами - пластами. Установлены особенности гастроцитограммы при раке желудка, где, помимо нахождения раковых клеток, встречаются еще ряд особенностей клеточного состава, при язвенной болезни, при хронических гастритах.
Диагностические возможности эксфолиативной цитологии ограничены тем, что при использовании этого метода суждение о патологических изменениях основывается только на морфологии клеток поверхностного эпителия, вне окружающих тканей.
Биопсия
Биопсия должна рассматриваться как заключительный диагностический этап; предпринимать ее как более короткий путь к диагнозу - недопустимое легкомыслие. В каждом отдельном случае ей должны предшествовать вдумчивая оценка клинических данных, тщательное физикальное исследование, изучение рентгенограмм и анализ всех относящихся к делу гематологических и химических лабораторных данных. Если сведения, полученные из данных клинического, лабораторного и рентгенологического исследований, сопоставлены и должным образом оценены, то этого часто оказывается достаточно для установления диагноза. Тем не менее, биопсия бывает необходима для того, чтобы подтвердить диагноз, полученный клинико-рентгенологическим путем. Биопсия, безусловно, показана в тех случаях, когда в связи с новообразованием намечается ампутация или другое радикальное хирургическое вмешательство; при таких условиях, естественно, хотят избежать ошибочно произведенной калечащей операции, возможной при неправильной интерпретации клинических симптомов заболевания. Биопсия должна быть сделана и в том случае, если больному предстоит радиационное лечение опухолевого процесса.
После того как вопрос о необходимости биопсии решен положительно, следует взвесить, какую из биопсий выгоднее применить - закрытую (пункционную) или открытую (хирургическую). Каждый из названных методов имеет присущие им достоинства и недостатки.
Закрытая (пункционная, аспирационная) биопсия.
Пункция кости. В зависимости от степени разрушения кости, определяемой по рентгенограмме, могут быть использованы либо обычные тонкие новые иглы, либо специальные иглы, применяемые для стернальной пункции. Кроме игл для шприца необходимо иметь проверенный шприц “Рекорд” 20 мл с хорошо притертым поршнем, предметные стекла, остроконечный пинцет или иглы. Так как прокол кости является хирургической операцией, то шприц и иглы должны быть простерилизованы (кипячением в физиологическом растворе). Во избежание гидратации, набухания и дегенерации цитологического материала под действием влаги шприц и иглы должны быть перед пункцией тщательно обезвожены путем последовательного промывания их спиртом и эфиром.
Укол делают иглой с мандреном; затем шприц насаживают на иглу. Для получения пунктата делают насасывательное движение поршнем, причем, прежде чем извлечь иглу, ее следует разъединить со шприцем. После извлечения иглы ее вновь насаживают на шприц и обратным движением поршня выталкивают содержимое иглы на предметное стекло. Малое количество пунктата не служит помехой для исследования.
При наличии крови следует готовить мазки без промедления, так как из свернувшейся крови трудно приготовить хороший мазок. Материал, нанесенный на предметное стекло, осторожно, чтобы не раздавить и не деформировать клетки, размазывают тонким слоем. Препараты из жидких пунктатов готовят подобно мазкам крови. Препарат из плотных масс (комочек) размазывается на предметном стекле или готовится путем отпечатков; отпечаток производят комочком ткани, удерживаемой тонким пинцетом или прикосновением одного предметного стекла к другому. Из значительной примеси крови для изготовления мазков следует брать отдельные “белесоватые” маленькие комочки.
При пункции кости, измененной патологическим процессом, необходимо обращать внимание на характер сопротивления, оказываемого игле, прокалывающей исследуемую ткань. Пункция гемангиосаркомы кости дает при насасывании в шприц большое количество крови; иногда после извлечения иглы появляется из места укола фонтанчик крови, уменьшающийся и исчезающий через 1-2 мин.
Следует обращать внимание на макроскопический вид пунктата, по которому при известном опыте можно распознать детрит плотный и желтоватый, получаемый из туберкулезных очагов, мягкий белесоватый пунктат, получаемый из распадающегося ракового метастаза, гной, типичный для туберкулезного поражения, и т. п.
Хотя по данным ряда авторов пункционная биопсия при злокачественных новообразованиях не ускоряет роста опухоли и не вызывает обсеменении; все же для большей безопасности рекомендуют (Абрамов, 1953) производить пункцию только в клинически неясных случаях непосредственно перед операцией. Единственное противопоказание к пункции - кровоточивость больного, связанная с геморрагическим диатезом.
Исследование пунктата должно проводиться специалистом, знакомым с морфологией периферической крови, цитоморфологией костного мозга при нормальных его состояниях и при различных патологических процессах. Ценность метода заключается в том, что он легко осуществим, исключает в ряде случаев необходимость биопсии и дает возможность проводить повторные исследования.
Открытая (хирургическая) биопсия.
Решение произвести хирургическую биопсию при подозрении на злокачественный характер опухоли кости всегда является ответственным. Хирургическая биопсия не должна применяться без предварительной критической оценки данных клинического, рентгенологического и лабораторных исследований. На враче-клиницисте лежит большая ответственность в выборе места, откуда должен быть взят кусочек для исследования. В ряде случаев неудача исследования объясняется неправильным выбором места взятия тканей. Кусочки тканей, взятые из поверхностных участков опухоли в зоне реактивных воспалительных изменений, не обнаруживают обычно опухолевых клеток. Точно так же может оказаться неудачным исследование кусочков, взятых из центра распадающейся опухоли.
Хирургическая биопсия должна производиться с минимумом травмы. Большинство авторов подчеркивает возможность метастатического распространения злокачественной опухоли при травматично проведенной хирургической биопсии. Однако несвоевременно поставленный диагноз и неправильное лечение злокачественной опухоли представляют большую опасность возможного метастазирования, чем открытая биопсия
Дата: 2019-02-19, просмотров: 450.