31. Рассчитайте Массу (г) атома меди
32. Рассчитайте Массу (г) молекулы воды
33. Рассчитайте Массу (г) молекулы водорода
34. Рассчитайте Массу (г) атома гелия
35. Рассчитайте Массу (г) молекулы углекислого газа
36. Рассчитайте Массу (г) атома железа
37. Рассчитайте Массу (г) атома азота
38. Рассчитайте Массу (г) атома хрома
39. Рассчитайте Массу (г) молекулы дигидрофосфата натрия
40. Рассчитайте Массу (г) молекулы гидроксокарбоната меди.
41. Рассчитайте Массу (г) 1 л кислорода при 750 мм рт. ст. и температуре 20оС
42. Рассчитайте Объем (см3) 2 г гелия при давлении 200,0 атм. и температуре 100оС
43. Рассчитайте Давление 5 г сероводорода при 293 К в объеме 0,1 мл
44. Рассчитайте Молекулярную массу газа, если 3,428 г его при нормальных условиях (н.у.) занимают объем 1200 мл
45. Рассчитайте Объем (см3) 150 г воды при нормальных условиях
46. Рассчитайте Массу (г) 5 л водорода при 300 К и 100,7 кПа
47.Массу г) 1 м3 азота при 10оС и 102,9 кПа
48. Рассчитайте Рассчитайте Рассчитайте Объем (см3) водорода при 17оС и 102,45 кПа, выделившегося при растворении 1,5 г цинка в соляной кислоте
49. Рассчитайте Объем 3 г кислорода при 0оС и 101,3 кПа
50. Рассчитайте Массу (г) одной молекулы гидроксосульфата бария
51. Рассчитайте Массу (г) одной молекулы гидроксида меди
52. Рассчитайте Массу (г) одной молекулы сульфата хрома
53. Рассчитайте Массу (г) одной молекулы хромовой кислоты
54. Рассчитайте Массу (г) одной молекулы нитрата серебра
55. Рассчитайте Массу (г) одной молекулы дигидроксохлорида алюминия
56. Рассчитайте Массу (г) одной молекулы нитрата железа(III)
57. Рассчитайте Массу (г) одной молекулы сульфита калия
58. Рассчитайте Массу (г) одной молекулы гидроксида кобальта(II)
59. Рассчитайте Массу (г) одного атома кальция
60. Рассчитайте Массу (г) одного атома калия
61. Определите Какие значения орбитального квантового числа возможны для атома с максимальным значением главного квантового числа, равным 5
62. Определите Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня с орбитальным квантовым числом, равным 6
63. Определите Длину волны электрона, имеющего скорость 2,2×103
64. Определите Сколько свободных d-орбиталей содержится в атомах Cl, Mn, Ti, U
65. Определите Атому какого элемента соответствует электронная формула
1s22s22p63s23p63d104s24p1
66. Определите Сколько неспаренных электронов в основном и возбужденных состояниях имеет атом хлора, и какие орбитали они занимают.
67. Определите Период, группу и подгруппу в периодической таблице элемента № 120
68. Определите Особенности электронного строения атомов хрома и меди, обусловленных провалом электронов
69. Определите Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом 4
70. Определите Электронную конфигурацию атомов элементов 8 и 87 и составьте графические схемы заполнения электронами валентных орбиталей их атомов
71. Определите По положению в периодической таблице, какой элемент 1-й группы проявляет наиболее ярко выраженные металлические свойства
72. По положению в периодической таблице, как изменяются неметаллические свойства элементов 7-й группы
73. Определите Какой гидроксид является более сильным основанием. Ответ обоснуйте: а) NaOH или СsOH; б) Ca(OH)2 или Zn(OH)2
74. Определите Как меняется сила кислот в ряду HF, HCl, HBr, HI
75. Определите Электронную конфигурацию атомов элементов 28 и 85 и составьте графические схемы заполнения электронами валентных орбиталей их атомов
76. Определите Электронную конфигурацию атомов элементов 25 и 68 и составьте графические схемы заполнения электронами валентных орбиталей их атомов
77. Определите У какого элемента Mo или Te ярче выражены металлические свойства
78. Определите Электронную конфигурацию атомов элементов 15 и 84 и составьте графические схемы заполнения электронами валентных орбиталей их атомов
79. Определите Электронные конфигурации серы в основном и возбужденных состояниях, представьте их графические схемы и определите возможные валентности
80. Определите Какой из элементов 2-й группы обладает наиболее выраженными металлическими свойствами
81. Определите Электронные конфигурации атома висмута в нормальном и возбужденном состояниях. Составьте их графические схемы. Определите возможные валентности
82. Определите Электронные конфигурации хлора в основном и возбужденных состояниях, представьте их графические схемы и определите возможные валентности
83. Определите Электронные конфигурации фосфора в основном и возбужденных состояниях, представьте их графические схемы и определите возможные валентности
84. Определите Электронные конфигурации иода в основном и возбужденных состояниях, представьте их графические схемы и определите возможные валентности
85. Определите Почему фтор не может проявлять валентность, равную номеру группы
86. Определите Какие элементы не могут проявлять валентность, равную номеру группы
87. Определите Длину волны де Бройля для атома гелия, имеющего скорость 500 м/с
28. Определите Длину волны де Бройля для молекулы азота, имеющего скорость 500 м/с
89. Определите Длину волны де Бройля для атома натрия, имеющего скорость500 м/с
90. Определите Длину волны де Бройля для атома бария, имеющего скорость 500 м/с
91. Определите методом МО возможность образования связи в молекуле He2
92. Определите методом МО возможность образования связи в молекуле Be2
93. Определите методом МО возможность образования связи в молекуле C2
94. Определите методом МО возможность образования связи в молекуле B2
95. Определите методом МО возможность образования связи в молекуле N2
96. Определите методом МО возможность образования связи в молекуле O2
97. Определите методом МО возможность образования связи в молекуле F2
98. Определите методом МО возможность образования связи в молекуле CO
99. Определите методом МО возможность образования связи в молекуле NO
100. Определите методом МО возможность образования связи в молекуле H2+
101. Определите методом МО возможность образования связи в молекуле Ne2
102. Определите методом МО возможность образования связи в молекуле H2-
103. Определите методом МО возможность образования связи в молекуле Ва2
104. Определите методом МО возможность образования связи в молекуле SiC
105. Определите методом МО возможность образования связи в молекуле GeC
106. Определите методом МО возможность образования связи в молекуле AlN
107. Определите методом МО возможность образования связи в молекуле CsF
108. Определите методом МО возможность образования связи в молекуле Cl2
109. Определите методом МО возможность образования связи в молекуле Br2
110. Определите методом МО возможность образования связи в молекуле K2
111. Определите методом МО возможность образования связи в молекуле Ca2
112. Определите методом МО возможность образования связи в молекуле S2
113. Определите методом МО возможность образования связи в молекуле P2
114. Определите методом МО возможность образования связи в молекуле Mg2
115. Определите методом МО возможность образования связи в молекуле Al2
116. Определите методом МО возможность образования связи в молекуле Ne2
117. Определите методом МО возможность образования связи в молекуле Ar2
118. Определите методом МО возможность образования связи в молекуле Xe2
119. Определите методом МО возможность образования связи в молекуле Si2
120. Определите методом МО возможность образования связи в молекуле Kr2
121. Объясните по методу валентных связей образование ковалентной связи в молекуле Хлороводорода
122. Объясните по методу валентных связей образование ковалентной связи в молекуле Фторида водорода
123. Объясните по методу валентных связей образование ковалентной связи в молекуле Фторида бериллия
124. Объясните по методу валентных связей образование ковалентной связи в молекуле Аммиака
125. Объясните по методу валентных связей образование ковалентной связи в молекуле Воды
126. Объясните по методу валентных связей образование ковалентной связи в молекуле Сероводорода
127. Объясните по методу валентных связей образование ковалентной связи в молекуле Метана
128. Объясните по методу валентных связей образование ковалентной связи в молекуле Пентахлорида фосфора
129. Объясните по методу валентных связей образование ковалентной связи в молекуле Этана
130. Объясните по методу валентных связей образование ковалентной связи в молекуле Фосфина
131. Объясните по методу валентных связей образование ковалентной связи в молекуле Фторида кальция
132. Объясните по методу валентных связей образование ковалентной связи в молекуле Фторида кремния
133. Объясните по методу валентных связей образование ковалентной связи в молекуле Пентафторида сурьмы
134. Объясните по методу валентных связей образование ковалентной связи в молекуле Гексафторида серы
135. Объясните по методу валентных связей образование ковалентной связи в молекуле Оксида углерода (IV)
136. Объясните по методу валентных связей образование ковалентной связи в молекуле Оксида углерода (II)
137. Объясните по методу валентных связей образование ковалентной связи в молекуле Ацетилена
138. Объясните по методу валентных связей образование ковалентной связи в молекуле Этилена
139. Объясните по методу валентных связей образование ковалентной связи в молекуле Оксида бериллия
140. Объясните по методу валентных связей образование ковалентной связи в молекуле Хлорида кальция
141. Объясните по методу валентных связей образование ковалентной связи в молекуле Хлорида бора
142. Объясните по методу валентных связей образование ковалентной связи в молекуле Хлорида фосфора (III)
143. Объясните по методу валентных связей образование ковалентной связи в молекуле Фторида хлора (III)
144. Объясните по методу валентных связей образование ковалентной связи в молекуле Хлорид мышьяка (III)
145. Объясните по методу валентных связей образование ковалентной связи в молекуле Гексахлорида серы
146. Объясните по методу валентных связей образование ковалентной связи в молекуле Пентафторида фосфора
147. Объясните по методу валентных связей образование ковалентной связи в молекуле Пентахлорида сурьмы
148. Объясните по методу валентных связей образование ковалентной связи в молекуле Бромида алюминия
149. Объясните по методу валентных связей образование ковалентной связи в молекуле Хлорида аммония
150. Объясните по методу валентных связей образование ковалентной связи в молекуле Фторида бора
151. Напишите уравнения реакций, позволяющих осуществить следующие превращения: Mg à MgSO 4 à Mg ( NO 3 )2 à MgO à ( CH 3 COO )2 Mg . Окислительно-восстановительные реакции уравняйте методом электронно-ионного баланса.
152. Составьте уравнения химических реакций, позволяющих осуществить следующие превращения: карбонат кальция à оксид кальция à гидроксид кальция à карбонат кальция à нитрат кальция.
153. Дана схема превращений:
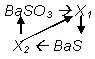 Напишите уравнения реакций, обозначенных стрелками. Назовите неизвестные вещества.
Напишите уравнения реакций, обозначенных стрелками. Назовите неизвестные вещества.
154. Какой из щелочных металлов взаимодействует с азотом при обычных условиях?
Напишите уравнения реакций, соответствующие следующей схеме
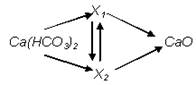 Определите неизвестные вещества.
Определите неизвестные вещества.
155. Приведите способы получения галогеноводородов. Объясните, почему HJ нельзя получить способами, применяемыми для получения HCl ?
156. Какой из металлов - ванадий, ниобий или тантал - взаимодействует с азотной кислотой? Приведите уравнения соответствующих реакций
157. Какие соединения называются гидридами металлов. Составьте уравнения реакций получения гидрида кальция и взаимодействия его с водой. Приведите уравнения соответствующих реакций
158. Осуществите следующие превращения: BaSO 4 à BaS à BaCO 3 à BaCl 2 и
Ca(NO3)2 à CaO à Ca 3 (PO4)2 . Составьте уравнения соответствующих
реакций, какие из них относятся к окислительно-восстановительным?
159. Укажите способы получения пероксида водорода, приведите уравнения соответствующих реакций.
160. Почему при добавлении раствора хромата калия к растворам CaCl2 и BaCl2, имеющим равную концентрацию, осадок выпадет только в растворе соли бария?
161. Составьте уравнения реакций последовательного превращения следующих веществ: TiCl 4 à Ti à TiO 2 à TiCl 4 à Ti ( OH )4
162. Напишите уравнения реакций, соответствующие следующей последовательности превращений:
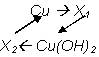 Назовите неизвестные вещества.
Назовите неизвестные вещества.
163. Составьте уравнения реакций. Назовите все вещества. Какие из приведенных реакций могут быть использованы для получения метафосфорной кислоты:
а) 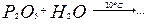 б)
б) 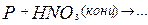 в)
в) 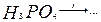 г)
г) 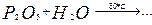
164. Дана схема превращений:
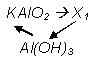 Напишите уравнения реакций, назовите вещества.
Напишите уравнения реакций, назовите вещества.
165. Напишите уравнения реакций, соответствующих последовательности превращений:
Mn à Mn(NO3)2 à K2MnO4 à X à Mn. Определите неизвестное вещество.
166. Приведите уравнения реакций взаимодействия HBr с а)Ca ( OH )2; б)PCl 3 ; в)H 2 SO 4 (конц) ; г) KJ ; д)Mg ; е) KClO 3; и укажите, какие свойства при этом проявляет HBr: кислоты; основания; окислителя; восстановителя.
167. Составьте уравнения реакций взаимодействия алюминия с: а)серой; б) углеродом; в)азотом; г) галогенами; д) фосфором; е)кремнием.
168. Рассчитайте, в каком случае получится больше хлора при одном и том же количестве соляной кислоты, если процесс идет по схемам:
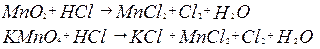
169. Напишите уравнения реакций, соответствующих следующей схеме:
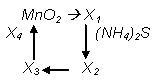 Определите неизвестные вещества.
Определите неизвестные вещества.
170. К раствору, содержащему SbCl 3 и BiCl 3 , добавили избыток раствора гидроксида калия. Составьте молекулярные и ионные уравнения реакций. Какое вещество находится в осадке?
171. Во сколько раз изменится скорость прямой и обратной реакции 2Н2 + О2 Û 2Н2О, (1); если концентрацию водорода увеличить в 6 раз.
172. Во сколько раз изменится скорость прямой и обратной реакции 3H2 + N2 Û 2NH3, (2); если концентрацию водорода увеличить в 7.
173. Во сколько раз изменится скорость прямой и обратной реакции PCl5(тв) Û PCl3+ Cl2, (3);если концентрацию хлора уменьшить в 4 раза.
174. Во сколько раз изменится скорость прямой и обратной реакции 2СО + О2 Û 2СО2, (4); если уменьшить давление в системе в 4 раза
175. Во сколько раз изменится скорость прямой и обратной реакции SO2+O2 Û SO3(газ) + Q кДж /моль, (5);при уменьшении объема в 3 раза
176. Во сколько раз изменится скорость прямой и обратной реакции 4 HCl+O2Û2H2O(газ)+2Cl2, (6); если уменьшить давление в системе в 3 раза
177. Во сколько раз изменится скорость прямой и обратной реакции 2H2S+O2Û2H2O(газ)+2SO2,(7); если увеличить объем системы в 4 раза
178. Во сколько раз изменится скорость прямой и обратной реакции 2Al(тв) + 3Cl2 Û 2AlCl3(тв), (8); если увеличить объем системы в 2 раза
179. Во сколько раз изменится скорость прямой и обратной реакции 2NO2 Û 2NO + O2, (9); если давление в системе увеличить в 5 раз
180. Во сколько раз изменится скорость прямой и обратной реакции NO + O3 Û NO2 + O2, (10); если концентрации исходных веществ увеличить в 4 раза
181. Во сколько раз изменится скорость прямой и обратной реакции 2H2+I2(газ) Û 2HI(газ), (11);если концентрацию водорода увеличить в 5 раз
182. Во сколько раз изменится скорость прямой и обратной реакции 2NO + Cl2 Û 2NOCl, (12); если давление увеличить в 10 раз
183. Во сколько раз изменится скорость прямой и обратной реакции C(тв) + O2 Û СО2, (13); если давление увеличить в 5 раз
184. Во сколько раз изменится скорость прямой и обратной реакции СО + Н2О(газ) Û СО2 + Н2, (14); если концентрации всех веществ увеличить в 12 раз
185. Во сколько раз изменится скорость прямой и обратной реакции 2SO2(газ) + O2 Û 2SO3(газ), (15); если концентрации исходных веществ увеличить в 8 раз
186. Во сколько раз изменится скорость прямой и обратной реакции H2 + I2(тв) Û 2HI(газ), (16); если концентрации исходных веществ увеличить в 4 раза
187. Во сколько раз изменится скорость прямой и обратной реакции H2 + Cl2 Û 2HCl, (17); если объем системы увеличить в 2 раза
188. Во сколько раз изменится скорость прямой и обратной реакции 2NO + O2 Û 2NO2, (18); если концентрации всех веществ уменьшить в 3 раза
189. Во сколько раз изменится скорость прямой и обратной реакции С(тв) + 2Н2 Û СН4, (19); если давление в системе увеличить в 3 раза
190. Во сколько раз изменится скорость прямой и обратной реакции Fe3 O4(тв) + 4СО Û 3Fe(тв) + 4CO2, (20); если увеличить давление в системе в 5 раз
191. Во сколько раз изменится скорость прямой и обратной реакции СО2 + С(тв) Û 2СО, (21) если уменьшить объем системы в 15 раз
192. Во сколько раз изменится скорость прямой и обратной реакции 4NH3 + 3O2 Û 2N2 + 6H2O, (22); если концентрации исходных веществ увеличить в 5 раз
193. Во сколько раз изменится скорость прямой и обратной реакции СН4 + 2O2 Û2H2O(газ)+СO2, (23); если концентрации исходных веществ увеличить в 12 раз
194. Во сколько раз изменится скорость прямой и обратной реакции 2СО + O2 Û 2СО2, (24); если увеличить давление в системе в 4 раза
195. Во сколько раз изменится скорость прямой и обратной реакции 2СН3ОН( газ)+3O2Û4H2O(газ)+2СO2, (25); если увеличить концентрации исходных веществ в 5 раз
196. Во сколько раз изменится скорость прямой и обратной реакции 2С6H6(газ) + 15O2 Û 6H2O(газ) + 12СO2 (26); если давление в системе уменьшить в 4 раза
197. Во сколько раз изменится скорость прямой и обратной реакции С( тв)+2Н2ÛСН4(газ), (27); если давление в системе уменьшить в 3 раза
198. Во сколько раз изменится скорость прямой и обратной реакции FeO(тв) + СO Û Fe(тв) + СO2, (28); если концентрации всех веществ увеличить в 100 раз
199. Во сколько раз изменится скорость прямой и обратной реакции S(тв) + O2 Û SO2(газ), (29); если концентрации всех веществ увеличить в 15 раз
200. Во сколько раз изменится скорость прямой и обратной реакции 2H2 + O2 Û 2H2O(газ), (30); если уменьшить объем системы в 40 раз
201. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 3; Т1 = 17; Т2 = 97.
202. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 4; Т1 = 450; Т2 = 270.
203. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 3; Т1 = 300; Т2 = 400.
204. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 50; Т2 = 0.
205. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 15; Т2 = 215.
206. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 4; Т1 = 0; Т2 = 50.
207. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 3; Т1 = 70; Т2 = 350.
208. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 50; Т2 = 150.
209. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 3; Т1 = 135; Т2 = 175.
210. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 4; Т1 = 70; Т2 = 170.
211. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 120; Т2 = 40.
212. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 3; Т1 = 30; Т2 = 90.
213. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 4; Т1 = 40; Т2 = 0.
214. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 3; Т1 = 100; Т2 = 150.
215. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 110; Т2 = 60.
216. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 4; Т1 = 240; Т2 = 140.
217. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 3; Т1 = 75; Т2= 125.
218. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 3; Т1 = 120; Т2= 80.
219. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y =2; Т1 = 175; Т2 = 225.
220. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y =2; Т1 = 30; Т2 = 80.
221. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y =4; Т1 = 35; Т2 = 95.
222. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y =3; Т1 = 50; Т2 = 90.
223. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y =2; Т1 = 130; Т2 = 70.
224. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 130; Т2 = 90 .
225. Y = 2; Т1 = 260; Т2 =170.
226. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 100; Т2 = 20.
227. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 120; Т2 = 60.
228. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 240; Т2 = 170.
229. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 2; Т1 = 150; Т2 = 90.
230. Температурный коэффициент реакции равен Y. Как изменится скорость реакции при изменении температуры от T1 до T2 Y = 3; Т1 = 125; Т2 = 55.
231. Сколько граммов пятиводного сульфата меди надо взять для приго –товления 2 л 2 М раствора соли?
232. Насыщенный раствор хлорида натрия содержит 18% соли (r = 1,16).
Определите молярную и моляльную концентрации раствора
233. Определите молярность и нормальность 10 %-ного раствора сульфата кобальта с плотностью 1,08 г/см3
234. Концентрированный раствор соляной кислоты содержит 36,5 % хло- роводорода и имеет плотность 1,18 г/см3. Определите массу хлорово- дорода в 1 л раствора
235. 10 %-ный раствор гидроксида натрия имеет плотность 1,12 г/см3.
Сколько граммов растворенного вещества содержат 5 л этого раствора?
236. Плотность 30 %-ного раствора азотной кислоты 1,18 г/см3. Определите
молярность и моляльность раствора
237. Сколько граммов карбоната калия надо взять для приготовления 5 л
0,05 М водного раствора с плотностью 1,085 г/см3 ?
238. 26 г хлорида натрия растворили в 100 г воды. Определите процентную
концентрацию и мольные доли компонентов раствора .
239. 50 г медного купороса CuSO4 растворили в 450 г воды. Определите процентную концентрацию соли
240. К 500 мл 30 %-ного раствора азотной кислоты (r = 1,2 г/см3)
прибавили 1 л воды. Определите процентную концентрацию раствора.
241. Вычислите процентную концентрацию 9н раствора гидроксида натрия с плотностью 1,31 г/см3
242. Для приготовления 5 %-ного раствора сульфида натрия взяли 400 г соли. Определите массу раствора
243. Сколько граммов Na2SO4 надо растворить в 800 граммах воды, чтобы получить 10 %-ный раствор ?
244. Необходимо приготовить 1 л 8 %-ного водного раствора сульфата меди с плотностью 1,084 г/см3. Найдите массу воды и соли в растворе
245. Какой объем воды нужно прибавить к 200 мл 30 %-го раствора NaOH с плотностью 1,33 г/см3 для получения 10 %-го раствора ?
246. В 1 кг воды растворили 200 г СН3СООNa. Определить процентную
концентрацию раствора
247. В 500 г воды растворили 100 г сульфата железа (II). Определите
процентную концентрацию раствора
248. Сколько граммов Na2CO3 надо взять для приготовления 2 л 10 %-ного водного раствора?
249. Какой объем воды нужно прибавить к 200 мл 30 %-ного раствора КОН с плотностью 1,32 г/см3 для получения 10 %-ного раствора?
250. Вычислите мольные доли компонентов расплава шлака, содержаще- го 54 % оксида кремния (IV), 20 % оксида железа (II), 26 % оксида кальция
251. В 500 г воды растворили 75 г MgCl2. Вычислите массовые доли
компонентов в растворе.
252. Сколько молей неэлектролита должен содержать 0,5 л раствора,
чтобы его осмотическое давление при 25 оС было равно 2,47 кПа ?
253. Вычислите осмотическое давление 0,25 М раствора неэлектролита
при 27 оС .
254. При какой температуре должен кристаллизоваться водный раствор,
содержащий 54 г глюкозы С6Н12О6 в 250 г воды ? КН2О = 1,86 град/моль
255. Даны 0,01 молярные растворы хлорида калия, хлорида кальция, хло- рида алюминия. Во всех растворах a =1. В каком случае осмотическое давление наибольшее ?
256. При 25 оС давление насыщенного пара воды составляет 3,166 кПа. Найдите давление насыщенного пара 5 %-ного водного раствора мочевины CO(NH2)2 при той же температуре
257. Даны 0,1 моляльные растворы нитрата свинца (II), нитрата калия и нитрата железа (III). Какой из растворов замерзнет при наиболее низкой температуре?
258. Вычислите давление насыщенного пара 30%-ного водного раствора мочевины CO(NH2)2 при 100 оС.
259. При какой температуре должен кристаллизоваться водный раствор, содержащий 15 г сахарозы С12Н22О11 в 200 г воды ?
260. В каком массовом соотношении следует смешать воду и этиловый спирт С2Н5ОН, чтобы получить смесь, замерзающую при –20 оС.
КН2О = 1,86 град/моль?
261. Вычислите жесткость воды, зная что для ее устранения пошло 265 г Na 2 CO 3 в расчете на 1 м3 воды.
262. . Вычислите жесткость воды, зная что в 250 л ее содержится 101,25 г гидрокарбоната кальция.
263. Определите массу сульфата кальция в 0,5 м3 природной воды, если жесткость ее равна 2 ммоль/л.
264. Какую массу карбоната натрия надо добавить к 1 м3 воды, чтобы устранить ее жесткость, равную 10 ммоль/л?
265. Определите формулу мицеллы, образующейся при прибавлении раствора иодида калия к избытку раствора нитрата серебра.
266. Определите формулу коллоидной частицы, образующейся при прибавлении раствора нитрата серебра к избытку раствора иодида калия.
267. Определите формулу ядра мицеллы, образующейся при прибавлении раствора серной кислоты к избытку раствора хлорида бария.
268. Определите формулу мицеллы, образующейся при прибавлении раствора нитрата бария к избытку раствора сульфата натрия.
269. Определите формулу коллоидной частицы, образующейся при прибавлении раствора хлорида кальция к избытку раствора карбоната натрия.
270. Определите формулу мицеллы, образующейся при прибавлении раствора карбоната калия к избытку раствора хлорида бария.
271. Вычислите рН 0,00001 М раствора азотной кислоты (a=1)
272. Вычислите рН 0,00001 М раствора гидроксида натрия (a=1)
273. Вычислите рН 0,001 М раствора гидроксида лития (a=1)
274. Вычислите рН 0,00001 М раствора соляной кислоты (a=1)
275. Вычислите рН рН 0,05 М раствора серной кислоты (a=1)
276. Вычислите рН 0,005 М раствора гидроксида бария (a=1)
277. Вычислите рН 0,0001 М раствора гидроксида натрия (a=1).
278. Вычислите рН 0,0001 М раствора азотной кислоты (a=1)
279. Вычислите рН 0,0005 М раствора Са(ОН)2 (a=1)
280. Вычислите рН 0,01 М раствора гидроксида рубидия (a=1)
281. Вычислите рН 0,0001 М раствора гидроксида лития (a=1)
282. Вычислите рН 0,0000001 М раствора азотной кислоты (a=1)
283. Вычислите рН 0,000001 молярного раствора гидроксида цезия (a=1)
284. Вычислите рН 0,00001 молярного раствора гидроксида натрия (a=1)
285. Вычислите рН 0,00005 молярного раствора серной кислоты (a=1)
286. Вычислите рН 0,005 молярного раствора гидроксида кальция (a=1)
287. Вычислите рН 0,005 молярного раствора гидроксида стронция (a=1)
288 Вычислите рН.0,005 молярного раствора гидроксида бария (a=1)
289. Вычислите рН 0,0005 молярного раствора серной кислоты (a=1)
290. Вычислите рН 0,0001 молярного раствора гидроксида калия (a=1)
291. Вычислите рН 0,001 молярного раствора соляной кислоты (a=1)
292. Вычислите рН 0,00001 молярного раствора гидроксида натрия (a=1)
293. Вычислите рН 0,0 5 молярного раствора серной кислоты (a=1)
294. Вычислите рН 0,0005 нормального раствора серной кислоты (a=1)
295. Вычислите рН 0,0005 нормального раствора гидроксида бария (a=1)
296. Вычислите рН 0,0005 нормального раствора гидроксида стронция (a=1)
297. Вычислите рН 0,000001 нормального раствора соляной кислоты (a=1)
298. Вычислите рН 0,0001 нормального раствора азотной кислоты (a=1)
299. Вычислите рН 0,000005 нормального раствора серной кислоты (a=1)
300. Вычислите рН 0,0005 молярного раствора гидроксида кальция (a=1)
301. Составьте уравнения гидролиза солей KCl, (NH4)2S, AlCl3
302. Составьте уравнения гидролиза солей Na2SO4, CuCl2, KCN
303. Составьте уравнения гидролиза солей NaNO3, Cr(NO3)3, Li2SO4
304. Составьте уравнения гидролиза солей NiSO4, AgNO3, Ba(NO3)2
305. Составьте уравнения гидролиза солей FeSO4, RbNO3, Zn(NO3)2
306. Составьте уравнения гидролиза солей FeCO3, SrSO4, Cs2CO3
307. Составьте уравнения гидролиза солей Al2(SO4)3, RbNO2, Sr(NO3)2
308. Составьте уравнения гидролиза солей FeSO3, Со(NO3)2, Са(NO3)2
309. Составьте уравнения гидролиза солей СаSO4, RbNO2, Al(NO3)3
310. Составьте уравнения гидролиза солей К2SO4, КСN, Zn(NO2)2
311. Составьте уравнения гидролиза солей Al(NO3)3, Na2CO3, KNO3
312. Составьте уравнения гидролиза солей Fe2(SO4)3, КNO3, Na3BO3
313. Составьте уравнения гидролиза солей СоSO4, Сu(NO3)2, Ва(NO3)2
314. Составьте уравнения гидролиза солей ВаSO4, К2СO3, Ni(NO3)2
315. Составьте уравнения гидролиза солей Fe2(SO4)3, AgNO3, Cu(NO2)2
316. СоSO4, RbCl, Zn(NO2)2
317. Составьте уравнения гидролиза солей FeSO3, КCl, Zn(NO3)2
318. Составьте уравнения гидролиза солей FeСO3, RbNO3, КNO2
319. Составьте уравнения гидролиза солей NiSO4, RbNO2, Ba(NO3)2
320. Составьте уравнения гидролиза солей Na2SO4, NaNO2, Al(NO3)3
321. Составьте уравнения гидролиза солей FeSiO3, NaVO3, Cu(NO3)2
322. Составьте уравнения гидролиза солей Zn(NO3)2, NaNO3, Ca(NO2)2
323. Составьте уравнения гидролиза солей Al2(SO4)3, Cu(NO3)2, Ba(NO3)2
324. Составьте уравнения гидролиза солей Cr2(SO4)3, со(NO2)2, LiNO3
325. Составьте уравнения гидролиза солей СаSO4, RbNO2, Zn(NO3)2
326. Составьте уравнения гидролиза солей CdSO4, Ba(NO3)2, Pb(NO2)2
327. Составьте уравнения гидролиза солей Ni(NO3)2, K2CO3, ZnSiO3
328. Составьте уравнения гидролиза солей CuSO4, NaNO3, Cd(NO2)2
329. Составьте уравнения гидролиза солей HgSO4, NaNO2, Ba(NO3)2
330. Составьте уравнения гидролиза солей ВаSO4, LiNO2, ZnCО3
331. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений Mn(OH)2 + Cl2 + KOH Þ MnO2 + KCl + H2O
332. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KCrO2 + Cl2 + KOH Þ K2CrO4 + KCl + H2O
333. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений Cr2O3 + KMnO4 + KOH Þ K2CrO4 + MnO2 + H2O
334. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений MnO2 + O2 + KOH Þ K2MnO4 + H2O
335. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений K2Cr2O7 + K2S + H2SO4 Þ Cr2(SO4)3 + S + K2SO4 + H2O
336. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений I2 + Cl2 + H2O Þ HIO3 + HCl
337. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений Cl2 + H2S + H2O Þ H2SO4 + HCl
338. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений HClO3 + H2S Þ HCl + H2SO4
339. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KI + K2Cr2O7 + H2SO4 Þ Cr2(SO4)3 + I2 + K2SO4 + H2O
340. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений I2 + Ba(OH)2 Þ Ba(IO3)2 + BaI2 + H2O
341. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений Na2SO3 + K2S + H2SO4 Þ Na2SO4 + K2SO4 + S + H2O
342. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений NaMnO4 + K2SO3 + H2O Þ MnO2 + K2SO4 + NaOH
343. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KMnO4 + HCl Þ MnCl2 + Cl2 + KCl + H2O
344. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений FeSO4 + Br2 + H2SO4 Þ Fe2(SO4)3 + HBr + H2O
345. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KIO3 + P + KOH Þ K3PO4 + KI + H2O
346. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений NaAsO2 + Cl2 + NaOH Þ Na3AsO4 + NaCl + H2O
347. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KAsO2 + Br2 + KOH Þ K3AsO4 + NaBr + H2O
348. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений NaClO3 + H2S Þ H2SO4 + NaCl + H2O
349. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений Cr2O3 + Br2 + KOH Þ K2CrO4 + KBr + H2O
350. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KMnO4 + FeCl2 + HCl Þ FeCl3 + MnCl2 + KCl + H2O
351. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений HBr + H2SO4 Þ Br2 + SO2 + H2O
352. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений NO2 + KMnO4 + H2O Þ MnO2 + KNO3 + KOH
353. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений NaAsO2 + I2 + NaOH Þ Na3AsO4 + NaI + H2O
354. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KAsO2 + Cl2 + KOH Þ K3AsO4 + KCl + H2O
355. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений K2Cr2O7 + HCl Þ Cl2 + CrCl3 + KCl + H2O
356. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KMnO4 + K2S + H2O Þ MnO2 + S + KOH
357. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KClO3 + FeSO4 +H2SO4 Þ KCl + Fe2(SO4)3 + H2O
358. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений K2S + K2MnO4 + H2O Þ S + MnO2 + KOH + H2O
359. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений KCrO2 + Cl2 + KOH Þ K2CrO4 + KCl + H2O
360. Расставьте коэффициенты в уравнениях, пользуясь методом электронно-ионных уравнений Mn(OH)2 + Cl2 + KOH Þ MnO2 + KCl + H2O
361. Составьте уравнения реакций а)Сu + AgNO3 Þ; б) Ni + HNO3(разб) Þ; в) Ag + H2SO4 (конц)Þ.
362. Составьте уравнения реакций а)Fe + Cu(NO3)2 Þ; б)Cu + HNO3(разб) Þ; в)Cu + H2SO4 (конц)Þ.
363. Составьте уравнения реакций а)Сu + Hg(NO3)2Þ; б)Na + HNO3(разб) Þ; в)Cd + H2SO4 (конц)Þ.
364. Составьте уравнения реакций а) Al + ZnSO4 Þ; б)K + HNO3(разб) Þ; в)Cu + H2SO4 (конц)Þ.
365. Составьте уравнения реакций а)Сr + NiSO4 Þ; б)Mg + HNO3(разб) Þ; в)Na + H2SO4 (конц)Þ.
366. Составьте уравнения реакций а)Fe + AgNO3 Þ; б)Со + HNO3(разб) Þ; в)Bi + H2SO4 (конц)Þ.
367. Составьте уравнения реакций а)Al + Fe(NO3)2 Þ; б)Mn + HNO3(разб) Þ; в)Na + H2SO4 (конц)Þ.
368. Составьте уравнения реакций а) Zn + HgCl2 Þ; б)Со + HNO3(разб) Þ; в)Bi + H2SO4 (конц)Þ.
369. Составьте уравнения реакций а)Cd + CuCl2 Þ; б)Hg + HNO3(разб) Þ; в)Mn + H2SO4 (конц)Þ.
370. Составьте уравнения реакций а)Pb + CuSO4 Þ; б)Pb + HNO3(разб) Þ; в)Pt + H2SO4 (конц)Þ.
371. Составьте уравнения реакций а)Al + Zn(NO3)2 Þ; б)Pb + HNO3(разб) Þ; в)Mn + H2SO4 (конц)Þ.
372. Составьте уравнения реакций а)Sn + Cu(NO3)2 Þ; б)Ni + HNO3(конц) Þ; в)Mg + H2SO4 (конц)Þ.
373. Составьте уравнения реакций а)Mg + NiCl2 Þ; б)Ag + HNO3(конц) Þ; в)Hg + H2SO4 (конц)Þ.
374. Составьте уравнения реакций а)Mg + AgNO3 Þ; б)Mn + HNO3(конц) Þ; в)Ag + H2SO4 (конц)Þ.
375. Составьте уравнения реакций а)Сu + Hg(NO3)2 Þ; б)Ca + HNO3(разб) Þ; в)Hg + H2SO4 (конц) Þ.
376. Составьте уравнения реакций а)Сo + AgNO3 Þ; б)Na + HNO3(разб) Þ; в)Ni + H2SO4 (конц)Þ.
377. Составьте уравнения реакций а)Zn + CdCl2 Þ; б)Mg + HNO3(разб) Þ; в)Zn + H2SO4 (конц)Þ.
378. Составьте уравнения реакций а)Ni + AgNO3 Þ; б)Pt + HNO3(разб) Þ; в)Со + H2SO4 (конц)Þ.
379. Составьте уравнения реакций а)Mg + AuCl3 Þ; б)Mg + HNO3(разб) Þ; в)K + H2SO4 (конц) Þ.
380. Составьте уравнения реакций а)Cd + PtCl4 Þ; б)Pb + HNO3(конц) Þ; в)Bi + H2SO4 (конц)Þ.
381. Составьте уравнения реакций а)Mn + Bi(NO3)3 Þ; б)Ag + HNO3(разб) Þ; в)Mn + H2SO4 (конц)Þ.
382. Составьте уравнения реакций а)Fe + Cu(NO3)2 Þ; б)Mg + HNO3(разб) Þ; в)Na + H2SO4 (конц)Þ.
383. Составьте уравнения реакций а)Fe + Pb(NO3)2 Þ; б)Na + HNO3(разб) Þ; в)Li + H2SO4 (конц)Þ.
384. Составьте уравнения реакций а)Ti + Fe(NO3)2 Þ; б)Cr + HNO3(разб) Þ; в)Mg + H2SO4 (конц) Þ.
385. Составьте уравнения реакций а)Сr + AgNO3 Þ; б)Cu + HNO3(разб) Þ; в)Bi + H2SO4 (конц)Þ.
386. Составьте уравнения реакций а)Mg + AgNO3 Þ; б)Со + HNO3(разб) Þ; в)Mn + H2SO4 (конц)Þ.
387. Составьте уравнения реакций а)Al + Zn(NO3)2 Þ; б)Hg + HNO3(разб) Þ; в)Sn + H2SO4 (конц) Þ.
388. Составьте уравнения реакций а)Al + AgNO3 Þ; б)Ni + HNO3(разб) Þ; в)Na + H2SO4 (конц)Þ.
389. Составьте уравнения реакций а)Mg + AgNO3 Þ; б)Со + HNO3(разб) Þ; в)Ni + H2SO4 (конц)Þ.
390. Составьте уравнения реакций а)Al + Zn(NO3)2 Þ; б)Pb + HNO3(конц) Þ; в)Mg + H2SO4(конц)Þ
391. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Медно-никелевого элемента, [Cu2+] = 0,1 М, [Ni2+] = 0,001 М
392. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Железо-хромового элемента. Fe2+] = 0,1 М, [Cr2+] = 0,001 М
393. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Медно-магниевого элемента.[Cu2+] = 0,01 М, [Мg2+] = 0,001 М
394. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Железо-никелевого элемента, [Fe2+] = 0,0001 М, [Ni2+] = 0,001 М
395. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Магний-хромового элемента, [Mg2+] = 0,001М, [Cr3+] = 0,001 М
396. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Висмут-кадмиевого элемента, [Bi3+] = 0,1 М, [Cd2+] = 0,01 М
397. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Магний-кобальтового элемента, [Mg2+] = 0,001 М, [Co2+] = 0,01 М
398. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Алюминий-цинкового, [Al3+] = 0,01 моль/л, [Zn2+] = 0,01 моль/л
399. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Железо-серебряного элемента, [Fe2+] = 0,0001М, [Ag+] = 0,01М
400. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Медно-висмутового элемента, [Сu2+] = 0,1 М, [Bi3+] = 0,001М
401. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Медно-серебряного элемента, [Cu2+] = 0,1М, [Ag+] = 0,001 М
402. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Хром-медного элемента, [Cr3+] = 0,01 М, [Cu2+] = 0,1 М
403. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Медно-хромового элемента, [Cu2+] = 0,0001М, [Сr3+] = 0,001М
404. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Магний-никелевого элемента, [Mg2+] = 0,0001 М, [Ni2+] = 0,001М
405. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Магний-серебряного элемента, [Мg2+] = 0,1 М, [Ag+] = 0,001 М
406. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Висмут-свинцового элемента, [Bi3+] = 0,0001 М, [Pb2+] = 0,001М
407. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Висмут-марганцевого элемента, [Bi3+] = 0,00001М, [Mn2+] = 0,001 М
408. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Кобальт-платинового элемента, [Co2+] = 0,1 М, [Pt2+] = 0,001 М
409. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Магний-хромового элемента, [Mg2+] = 0,1 М, [Cr3+] = 0,0001М
410. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Алюминий-золотого элемента, [Al3+] = 0,01 М, [Au3+] = 0,0001 М
411. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Висмут-медного элемента, [Cu2+] = 0,00001 М, [Bi3+] = 0,001 М
412. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Титан-железного элемента, [Ti3+] = 0,01М, [Fe2+] = 0,1 М
413. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Золото-железного элемента, [Fe2+] = 0,1М, [Au3+] = 0,001 М
414. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Медно-цинкового элемента, [Cu2+] = 0,1 М, [Zn2+] = 0,0001 М
415. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Железо-серебряного элемента, [Fe2+] = 0,00001 М, [Ag+] = 0,001 М
416. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Хромо-никелевого элемента, [Cr2+] = 0,1 М, [Ni2+] = 0,001 М
417. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Олово-медного элемента, [Cu2+] = 0,1 М, [Sn2+] = 0,001 М
418. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Кадмий-цинкового элемента, [Cd2+] = 0,0001 М, [Zn2+] = 0,001 М
419. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Магний-сурьмяного элемента, [Mg2+] = 0,01 М, [Sb3+] = 0,01 М
420. Составьте схему работы гальванического элемента. Напишите электронные уравнения катодного и анодного процессов. Рассчитайте Э.Д.С. источника тока Алюминий-оловянного элемента, [Al3+] = 0,01 М, [Sn2+] = 0,001 М
421.Составьте схему электролиза водного раствора нитрата серебра с серебряными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на катоде, если время электролиза 15 мин., сила тока 5 А
422. Составьте схему электролиза водного раствора нитрата магния с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на аноде, если время электролиза 15 мин., сила тока 5 А
423. Составьте схему электролиза водного раствора хлорида марганца с золотыми электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на катоде, если время электролиза 40 мин., сила тока 15 А.
424.Составьте схему электролиза водного раствора карбоната нат-рия с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на аноде, если время электролиза 1,5 час., сила тока 5 А
425. Составьте схему электролиза водного раствора хлорида бария с золотыми электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если время электролиза 30 мин., сила тока 15 А
426. Составьте схему электролиза водного раствора нитрата висмута с платиновыми электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на аноде, если время электролиза 215 мин., сила тока 50 А.
427. Составьте схему электролиза водного раствора сульфата кобальта с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выде-лившегося на катоде, если время электролиза 150 мин., сила тока 50 А.
428. Составьте схему электролиза водного раствора хлорида натрия с медным анодом. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на аноде, если электролиз проводили 40 минут при силе тока 6 А.
429. Составьте схему электролиза водного раствора сульфата железа с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если электролиз проводили 100 минут при силе тока 7 А , выход по току металла составляет 73%
430. Составьте схему электролиза водного раствора сульфата меди с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на аноде, если время электролиза 15 час., сила тока 15 А.
431. Составьте схему электролиза водного раствора нитрата железа с железным анодом. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если электролиз проводили 15 часов при силе тока 1 А, выход металла по току 75%.
432. Составьте схему электролиза водного раствора нитрата никеля с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на аноде, если время электролиза 415 мин., сила тока 15 А
433. Составьте схему электролиза водного раствора сульфата хрома с платиновыми электрордами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если электролиз проводили 30 минут при силе тока 25 А, выход металла по току составляет 53%.
434. Составьте схему электролиза водного раствора ацетата свинца с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если электролиз проводили 25 минут при силе тока 2 А, выход металла по току 95%.
435. Составьте схему электролиза водного раствора нитрата каль-ция с золотыми электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на аноде, если время электролиза 115 мин., сила тока 50 А.
436. Составьте схему электролиза водного раствора нитрата висмута с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если время электролиза 115 мин., сила тока 25 А
437. Составьте схему электролиза водного раствора нитрата марганца с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если электролиз проводили 215 минут при силе тока 15 А, выход металла по току 65% .
438. Составьте схему электролиза водного раствора хлорида платины(IV) с угольными электродами. Напишите электронные урав-нения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на аноде, если время электролиза 115 мин., сила тока 35 А.
439. Составьте схему электролиза водного раствора нитрата магния с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на катоде, если время электролиза 315 мин., сила тока 5 А.
440. Составьте схему электролиза водного раствора хлорида золота (III) с золотым анодом. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если электролиз проводили 40 минут при силе тока 10 А.
441. Составьте схему электролиза водного раствора нитрата хрома с платиновыми электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на аноде, если время электролиза 215 мин., сила тока 25 А.
442. Составьте схему электролиза водного раствора сульфата калия с золотыми электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выде-лившегося на катоде, если время электролиза 615 мин., сила тока 25 А.
443. Составьте схему электролиза водного раствора сульфата алюминия с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на аноде, если время электролиза 3 час., сила тока 5 А.
444. Составьте схему электролиза водного раствора хлорида бария с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на катоде, если время электролиза 65 мин., сила тока 5 А
445. Составьте схему электролиза водного раствора сульфата стронция с золотыми электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на аноде, если время электролиза 45 мин., сила тока 15 А.
446. Составьте схему электролиза водного раствора хлорида натрия с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на катоде, если время электролиза 95 мин., сила тока 10 А
447. Составьте схему электролиза водного раствора хлорида лития с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на аноде, если время электролиза 515 мин., сила тока 5 А
448. Составьте схему электролиза водного раствора нитрата кадмия с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если электролиз проводили 45 минут при силе тока 15 А, выход металла по току 75%
449. Составьте схему электролиза водного раствора сульфата лития с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, вы-делившегося на аноде, если время электролиза 215 мин., сила тока 25 А
450. Составьте схему электролиза водного раствора нитрата олова с угольными электродами. Напишите электронные уравнения анодного и катодного процессов. Вычислите массу вещества, выделившегося на катоде, если время электролиза 35 мин., сила тока 35 А.
451. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Висмута и хрома
452. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Алюминия и платины
453. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Меди и магния
454. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Магния и кадмия
455. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Никеля и кадмия
456. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Серебра и свинца
457. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Меди и свинца
458. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Цинка и платины
459. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Хрома и алюминия
460. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Хрома и магния
461. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Марганца и магния
462. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Железа и алюминия
463. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Алюминия и меди
464. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Титана и железа
465. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Серебра и хрома
466. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Меди и железа
467. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Цинка и алюминия
468. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Никеля и цинка
469. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Золота и меди
470. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Алюминия и платины
471. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Железа и магния
472. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Марганца и титана
473. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Алюминия и ртути
474. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Меди и золота
475. Железа и меди
476. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Железа и магния
477. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Свинца и хрома
478. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Никеля и меди
479. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Магния и железа
480. Составьте схему контактной коррозии металлов в кислой среде и в атмосферных условиях Марганца и золота
Таблица 3
Стандартные энтальпии образования ∆Но298 (кДж/моль) веществ
| Вещество | Состояние | ∆Но298 | Вещество | Состояние | ∆Но298 |
| C2H2 | г | +226,75 | CO | г | -110,52 |
| CS2 | г | +115,28 | CH3OH | г | -201,17 |
| NO | г | +90,37 | C2H5OH | г | -235,31 |
| C6H6 | г | +82,93 | H2O | г | -241,83 |
| C2Н4 | г | +52,28 | H2O | ж | -285,84 |
| H2S | г | -20,15 | NH4Cl | к | -315,39 |
| NH3 | г | -46,19 | CO2 | г | -393,51 |
| CH4 | г | -74,85 | Fe2O3 | к | -822,10 |
| C2H6 | г | -84,67 | TiO2 | к | -943,90 |
| HCl | г | -92,31 | Ca(OH)2 | к | -986,50 |
| Al2O3 | к | -1669,80 |
481. Вычислите количество теплоты, которое выделится при восстановлении оксида железа (III) металлическим алюминием, если получено 33, 5 г железа.
482. Газообразный этанол можно получить реакцией этилена и водяных паров. Вычислите тепловой эффект реакции.
483. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерода. Определите тепловой эффект реакции.
484. Сколько теплоты выделится при взаимодействии оксида углерода (II) и водорода, в результате чего образуется метан и пары воды. Если получено 134,4 л метана (н.у.)
485. Сколько теплоты выделится в реакции образования кристаллического хлорида аммония из газообразных ам миака и хлороводорода, если израсходовано 20 л аммиака (н.у.)
486. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и оксида углерода (IV) равен -3135,58 кДж/моль. Определите теплоту образования бензола.
487. Сколько теплоты выделится при сгорании 330 л (н.у.) ацетилена, если продуктами сгорания являются оксид углерода (IV) и пары воды?
488. Сколько теплоты выделится при сгорании аммиака, если образовалось 22,4 л (н.у.) оксида азота (II).
489. При сгорании 23 г жидкого этанола выделяется 617,42 кДж теплоты. Вычислите теплоту образования жидкого этанола, если продуктами реакции являются пары воды и оксид углерода (IV).
490. При взаимодействии 12,6 г железа с серой выделяется 22,61 кДж теплоты. Вычислите теплоту образования сульфида железа (II).
491. Напишите уравнения реакций, согласно схеме превращений:
+Br2 +NaOH +Br2 +2KOH
Этан -----® X1 ----® X2 ----® этен ----® X3 ----® X4.
hv H2O H2O
Назовите продукты реакций Х1, Х2, Х3, Х4.
492. Напишите уравнения реакций, согласно схеме превращений:
+Cl2 +Na +CH3Cl + Cl2
пропан -----® X1 ----® X2 ----® бензол ----® X3 ----® X4.
hv AlCl3 FeCl3
Назовите продукты реакций Х1, Х2, Х3, Х4.
493. Напишите уравнения реакций, согласно схеме превращений:
+2H2 + Br2 +KOH +Na
метан ® ацетилен ----® X1 ----® X2 ----® X3 ----® X4.
Ni hv H2O
Назовите продукты реакций Х1, Х2, Х3, Х4.
494. Напишите уравнения реакций, согласно схеме превращений:
+Cl2 +Na + О2
карбид алюминия ®метан ----® X1 ----® X2 ® этилен -----------® X3.
hv PdCl2+CuCl2
Назовите продукты реакций Х1, Х2, Х3.
495. Напишите уравнения реакций, согласно схеме превращений:
+Cl2 +NaОН + 3Br2
метан ®ацетилен® бензол -----® X1 ------® X2 --------® X3.
FeCl3 H2O
Назовите продукты реакций Х1, Х2, Х3.
496. Напишите уравнения реакций, согласно схеме превращений:
+2HBr +HBr +CH3COOH
этиленгликоль ------® X1 ® этен ----® X2 ® этанол -------------® X3.
H2SO4, t0
Назовите продукты реакций Х1, Х2, Х3.
497. Напишите уравнения реакций, согласно схеме превращений:
+HBr +KOH + CuО
CH3-CH2-COONa ® пропан ® пропен -----® X1 ---------® X2 -----------® X3.
H2O t0
Назовите продукты реакций Х1, Х2, Х3.
498. Напишите уравнения реакций, согласно схеме превращений:
+Cl2 +NaОН +КОН
карбид кальция ® ацетилен ® бензол -------® X1 ---------® X2 -------® X3.
FeCl3 +H2O, t0
Назовите продукты реакций Х1, Х2, Х3.
499. Напишите уравнения реакций, согласно схеме превращений:
+HCl +H2 +Cl2
бутанол-2 -------® X1 ® бутен-2 -------® X2 ® 2-метилпропан-------® X3.
t0 Ni, t0 hv
Назовите продукты реакций Х1, Х2, Х3.
500. Напишите уравнения реакций, согласно схеме превращений:
+Br2 +KOH +H2 +Br2
бензол ® этилбензол ----® X1 ------------® X2 ------® X3 -------® X4.
hv C2H5OH Ni ,t0 FeBr3
Назовите продукты реакций Х1, Х2, Х3, Х4.
Лабораторные работы
Лабораторная работа № 1
Свойства основных классов неорганических соединений

 Опыт 1. Взаимодействие основных оксидов с водой.
Опыт 1. Взаимодействие основных оксидов с водой.
В пробирку насыпьте немного оксида кальция CaO и добавьте 1 мл воды. Содержимое пробирки хорошо перемешайте и прибавьте 2-3 капли раствора фенолфталеина. Как изменится цвет индикатора и почему?
Опыт 2. Взаимодействие основных оксидов с кислотами.
В пробирку насыпьте немного оксида кальция (около 0,1 г) и добавьте 1 мл раствора соляной кислоты HCl. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Взаимодействие амфотерных оксидов со щелочами и кислотами.
В две пробирки насыпьте небольшое количество (около 0,1 г) оксида цинка ZnO. В первую прилейте 2-3 мл раствора соляной кислоты, во вторую 2-3 мл раствора гидроксида натрия. Что происходит? Проверьте растворимость оксида цинка в воде. Составьте уравнения всех процессов.
Опыт 4. Взаимодействие оснований с кислотами (реакция нейтрализации).
В пробирку налейте 1-2 мл раствора гидроксида натрия NaOH, добавьте 1-2 капли раствора фенолфталеина и медленно, по каплям, прибавьте 1-2 мл соляной кислоты HCl до изменения окраски индикатора. Что происходит? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 5. Исследование амфотерности гидроксидов цинка и
хрома (III).
Возьмите 2 пробирки. Налейте в первую пробирку 1 мл раствора сульфата цинка ZnSO4, во вторую - 1мл раствора сульфата хрома(III) Cr2(SO4)3. В каждую пробирку прибавьте по каплям раствор гидроксида натрия до образования осадков. Какого цвета осадки? Напишите уравнения реакций в молекулярной и ионной формах. Перемешайте осадки легким встряхиванием и каждый осадок разделите на 2 пробирки. К одной части осадков добавьте раствор соляной кислоты, а к другой - раствор гидроксида натрия (в избытке). Что наблюдаете? Напишите уравнения всех реакций в молекулярной и ионной формах.
Опыт 6. Получение нерастворимых оснований.
Налейте в пробирку 1 мл раствора хлорида железа(III) FeCI3. Добавьте 1 мл раствора гидроксида натрия. Что образуется? Составьте уравнения реакций в молекулярной и ионной формах.
Опыт 7. Взаимодействие кислот с солями.
К 1-2 мл раствора нитрата свинца(II) Pb(NO3)2 прилейте 1-2 мл раствора соляной кислоты. Что происходит? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 8. Взаимодействия кислот с металлами
Налейте в две пробирки по 1-2 мл разбавленной серной кислоты. В первую пробирку добавьте гранулу металлического цинка, а во вторую - кусочек металлической меди. Что наблюдаете? Составьте уравнения реакций.
Опыт 9. Получение солей из амфотерных гидроксидов.
Даны растворы солей: FeCI2, BaCI2, CuSO4, ZnSO4, NaCI, AI (NO3)3. Какие из этих солей могут служить исходными веществами для получения амфотерных гидроксидов? Отберите подходящие для этой цели растворы солей, налейте в пробирки по 5 мл и добавьте в каждую малыми порциями раствор щелочи до выпадения осадка. Выпавшие осадки разделите в разные пробирки на две части. В первую часть добавьте избыток щелочи, во вторую - немного раствора соляной или серной кислоты до растворения осадка. Объясните происходящие процессы. Составьте уравнения реакций.
Лабораторная работа № 2
Дата: 2019-02-25, просмотров: 425.