Типовые задачи по темам 1-6
1.Докажите амфотерные свойства оксида хрома(III) и гидроксида цинка, приведите уравнения соответствующих реакций.
2.Приведите формулы всех солей, которые могут образоваться при взаимодействии гидроксида алюминия и соляной кислоты.
3.Составьте формулы сульфата алюминия, дигидрофосфата кальция, гидроксокарбоната меди(II). Приведите их графические формулы.
4.Вычислите эквиваленты и молярные массы эквивалентов Ag2O, CaHPO4, (CuOH)2CO3, H3BO3.
5.Составьте формулы оксидов и гидроксидов следующих элементов:
S+6, K+, Mn+7, Sn+2, P+5, Si+4. Определите, какие из них обладают основными, кислотными или амфотерными свойствами. Ответ аргументируйте уравнениями соответствующих реакций.
6.Составьте формулы оксидов, соответствующие следующим гидроксидам: Mn(OH)4, NaOH, H3PO4, HPO3. Составьте графические формулы всех соединений.
7.Определите плотность вещества, если 30 см3 его имеют массу 45 г.
8.Сколько сульфида железа должно получиться, если для проведения реакции взяли 8 г серы и 28 граммов железа?
9.Определите простейшую формулу поташа, если массовый состав этого вещества: калия - 56,6%, углерода - 8,7%, кислорода - 34,8%.
10.При сжигании 1,55 г фосфора получено 3,53 г фосфорного ангидрида. Определите количественный состав фосфорного ангидрида.
11.Вычислите эквивалент и молярную массу эквивалентов ортофосфорной кислоты в реакциях обмена с едким натром, в результате которых образуются нормальная и кислые соли.
12.Из 1,4 г кальция получили 2,52 г его сульфида. Определите молярную массу эквивалента металла.
13.Плотность газа по воздуху 1,52. Определите относительную молекулярную массу газа.
14.Вычислите молекулярную массу газа, если при 25оС и 800 мм рт. ст. 350 мл его имеют массу 0,78 г. Определите его относительную плотность по воздуху.
15.Какой объем при нормальных условиях занимают 1020 молекул газа.
16.Составьте полную электронную формулу элемента, расположенного в 6-ом периоде, 7-й группе, главной подгруппе.
17.Газообразный гидрид элемента "Э" имеет формулу ЭН2. Определите формулу его высшего оксида и его молекулярную массу, если плотность гидрида по воздуху равна 1,172
18. Объясните, почему сера и хлор проявляют максимальную степень окисления, равную номеру группы, а кислород и фтор таковой не проявляют.
19. Какие из перечисленных молекул будут неполярными: H2S, HF, CCl4, NH3, BCl3. Дайте мотивированный ответ.
20.Учитывая sp3-гибридизацию углерода, укажите, в какой из молекул дипольный момент наибольший: а) CH4, б) CH3Cl, в) CH2Cl2, г) CHCl3,
д) CCl4?
21. Укажите, какие молекулы, из перечисленных ниже, имеют угловую форму:
H2O, BeCl2, CO2, H2S?
Примеры решения типовых задач (темы 1-6)
1. Составьте формулы оксидов и гидроксидов следующих элементов: Cl+7, Al+3, Cr+6, Sr+2.
Решение:
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. Кислород во всех соединениях имеет валентность, равную 2. Формула оксида определяется правилом: произведение валентности кислорода на индекс в формуле, указывающий число атомов кислорода в молекуле, равно такому же произведению другого атома в молекуле. Одновременно произведение валентностей элементов равно произведению индексов этих элементов в формуле.
Учитывая вышесказанное, имеем, например, для семивалентного хлора:
формула оксида хлора (VII) Cl2O7.
Аналогично получим: Al2O3, CrO3, SrO.
Гидроксиды (гидраты оксидов) – формально можно рассматривать как продукты присоединения воды к молекуле оксида.
Основным оксидам в качестве гидратов соответствуют основания. В формуле основания на первое место записывают металл, за ним записывают гидроксогруппы. Число гидроксогрупп равно валентности металла
SrO + H2O Þ Sr(OH)2
Кислотным оксидам в качестве гидратов соответствуют кислоты (продукты присоединения молекулы воды к кислотным оксидам). В формуле кислоты на первое место записывают водород, за ним центральный атом и на последнем месте кислород.
Cl2O7 + H2O Þ H2Cl2O8 Þ 2HClO4.
CrO3 + H2O Þ H2CrO4
Амфотерным оксидам соответствуют амфотерные гидроксиды (также могут быть представлены как продукты присоединения воды к молекуле амфотерного оксида).
Al2O3 + 3H2O Þ 2Al(OH)3.
2. Докажите амфотерные свойства оксида олова(II) и гидроксида бериллия, приведите уравнения соответствующих реакций.
Решение:
Чтобы доказать амфотерность оксида или гидроксида, следует составить уравнения реакций взаимодействия данного вещества с кислотой и со щелочью.
SnO + 2HCl Þ SnCl2 + H2O
SnO + 2NaOH Þ Na2SnO2 + H2O.
Be(OH)2 + 2HCl Þ BeCl2 + 2H2O
Be(OH)2 + 2NaOH Þ Na2BeO2 + 2H2O
3. Приведите формулы всех солей, которые могут образоваться при взаимодействии гидроксида кальция и серной кислоты. Составьте уравнения соответствующих реакций. Назовите продукты реакций.
Решение:
Различают соли средние – продукт полного замещения гидроксогрупп и ионов водорода в молекулах оснований и кислот:
Сa(OH)2 + H2SO4 Þ CaSO4 + 2H2O
CaSO4 – сульфат кальция;
Кислые соли – продукт неполного замещения ионов водорода в молекуле кислоты (могут быть образованы неодноосновными кислотами):
Сa(OH)2 + 2H2SO4 Þ Ca(НSO4)2 + 2H2O
Ca(НSO4)2 – гидросульфат кальция;
Основные соли – продукт неполного замещения ионов гидроксила в молекуле основания (могут быть образованы неоднокислотными основаниями):
2Сa(OH)2 + H2SO4 Þ (CaОН)2SO4 + 2H2O
(CaОН)2SO4 – гидроксосульфат кальция.
4. Составьте графическую формулу Ca(NO3)2.
Решение:
В графической формуле указывается порядок соединения атомов в молекуле, где каждая связь обозначается черточкой. В графической формуле не учитываются валентные углы между связями. Двойные связи обозначаются двойной черточкой, а тройные – тройной. В неорганических кислородсодержащих соединениях атомы различных элементов соединяются между собой, преимущественно, через кислородные мостики.
O O
ç÷ ç÷
N-O-Ca-O-N
ç÷ ç÷
O O
5. Определите простейшую формулу вещества, содержащего 40 % мас. меди, 20% мас. серы, 40 % мас. кислорода.
Решение:
Обозначим общую формулу вещества СuxSyOz. Индексы в формуле соединения относятся как количества вещества каждого элемента. Из процентного состава вещества известно, что 100 г вещества содержат 40 г меди, 20 г серы и 40 г кислорода. Найдем количество вещества каждого элемента, возьмем их отношение и преобразуем в отношение целых чисел, для чего разделим каждое число в отношении на наименьшее:
x : y : z = n(Cu) : n(S) : n(O) = m(Cu)/ M(Cu) : m(S)/ M(S) : m(O)/ M(O) =
= (40/64) : (20/32) : (40/16) = 0,625 : 0,625 : 2,5 = 1 : 1 : 4
Cледовательно, простейшая формула соединения CuSO4.
6. Определите количественный состав марганца в оксидах марганца (IV) и марганца(VII).
Решение:
Молекулярная масса марганца равна 55 г/моль, оксида марганца (IV) MnO2 – 87 г/моль, оксида марганца (VII) Mn2O7 – 222 г/моль.
1 моль MnO2 содержит 1 моль атомов марганца Mn.
Следовательно:
87 г MnO2 содержат 55 г Mn, а
100 г MnO2 содержат х г Mn.
Решая пропорцию, имеем:
х = (100×55)/87 = 63,2 г.
Массовая доля марганца в оксиде марганца (IV) составляет 63,2%.
Аналогично для оксида марганца (VII).
1 моль Mn2O7 содержит 2 моль атомов марганца Mn.
Следовательно:
222 г Mn2O7 содержат 110 г Mn, а
100 г Mn2O7 содержат y г Mn.
Решая пропорцию, имеем:
y = (100×100)/222 = 49,5 г.
Массовая доля марганца в оксиде марганца (VII) составляет 49,5%.
7. Сколько граммов хлорида магния получится, если для реакции взяли 48 г магния и 105 г хлора?
Решение:
Составим уравнение реакции:
Mg + Cl2 Þ MgCl2.
По уравнению реакции на 1 моль магния приходится 1 моль хлора.
Определим количество вещества каждого компонента, введенных в реакцию.
n(Mg) = m(Mg)/M(Mg) = 48 /24 = 2 моль.
n(Cl2) = m(Cl2)/M(Cl2) = 105/ 70 = 1,5 моль.
Хлор находится в недостатке. Расчеты ведем по недостатку.
По уравнению реакции на 1 моль хлора приходится 1 моль хлорида магния. Следовательно, в результате реакции получено 1,5 моль хлорида магния. Тогда масса хлорида магния составляет:
m(MgCl2) = n(MgCl2) × M(MgCl2) = 1,5 × 94 = 141 г.
8. Рассчитайте эквиваленты и молекулярные массы эквивалентов соединений: MnO2, H3PO4, Ca(H2PO4)2. Назовите вещества.
Решение:
Оксид марганца (IV).
МЭ(MnO2) = М(MnO2)/n(O)×B (O) = (55+16×2)/2×2 = 21,75,г/моль
где n(O) – число атомов кислорода в молекуле;
B (O) – валентность кислорода.
Э(MnO2)=1/4 MnO2
Ортофосфорная кислота.
МЭ(H3PO4) = М(H3PO4) / n(Н) = (3+31+16×4)/3 = 32,7 г/моль
где n(Н) – число атомов водорода в молекуле кислоты.
Э(H3PO4)=1/3 H3PO4
Дигидрофосфат кальция.
МЭ(Ca(H2PO4)2) = М(Ca(H2PO4)2)/n(М)×B(М) = (40+2+31×2+16×2×4)/2×1 = 116 г/моль
Э(Ca(H2PO4)2) =1/2 Э(Ca(H2PO4)2)
где n(М) – число атомов металла в молекуле;
B (М) – валентность металла.
9. Окислением 1,4 г кадмия получили 1,6 г его оксида. Определите молярную массу эквивалента металла.
Решение:
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород. Согласно условию 1,6 г оксида кадмия содержит 1,4 г металла. Следовательно, остальное составляет кислород – 0,2 г. Молярная масса эквивалента кислорода известна и равна 8 г/моль. Из закона эквивалентов - массы реагирующих веществ относятся, как молярные массы их эквивалентов– следует:
MЭ(Cd) = m (Cd)×mЭ (O) / m (O) = 1,4×8/0,2 = 56 г/моль.
Относительная плотность газа по водороду равна 35. Определите молярную массу газа и рассчитайте массу 5 л этого газа.
Решение:
Относительная плотность одного газа по другому равна отношению их молекулярных или молярных масс. D(газа/Н2) = М( газа) / М(Н2)
М (газа) = D(газа/Н2)× М(Н2) = 35 × 2 = 70 г/моль.
Моль любого газа при нормальных условиях занимает обьем 22,4 л. Следовательно, 5 л газа при тех же условиях имеют:
m( газа)= V (газа)М(газа)/VМ(газа)=5л´70(г/моль)/22,4 л/моль =15,6 г
10. 1000 л газа при 745 мм рт. ст. и 15°С имеют массу 1,825 кг. Определите его молекулярную массу.
Решение:
Применим уравнение состояния идеального газа Менделеева - Клапейрона
pV = (m/M) RT.
Тогда:
M=mRT/(pV)=1825г× 62400мм×мл/моль×К×288К/(745мм×106мл)=44 г/моль.
11. Определите положение никеля в Периодической системе. Составьте его электронную формулу.
Решение:
Никель находится в Периодической системе в 4-ом периоде, 8-й группе, побочной подгруппе, 3-й элемент триады.
Электронная формула определяется положением в Периодической системе:
1s22s22p63s23p64s23d8
12. Обоснуйте положение в периодической системе элемента, имеющего валентные электроны в состоянии 7s26d3.
Решение:
Главное квантовое число внешнего электронного слоя указанного элемента равно 7. Следовательно, это элемент 7-го периода.
Валентные электроны его располагаются на внешнем s- и предвнешнем d- подуровнях. Следовательно, это элемент побочной подгруппы.
Общее число валентных электронов данного элемента равно 5 (2 на s- и 3 на d-подуровнях). Следовательно, это элемент 5-й группы.
13.Какой из элементов: кислород, сера или бром является наиболее типичным неметаллом и почему?
Решение:
Неметаллические свойства тем ярче проявляются, чем выше и правее в Периодической системе находится элемент.
Кислород находится во 2-ом периоде, 6-й группе Периодической системы, что характеризует его как наиболее ярко выраженный неметалл из перечисленных.
Сера находится в 3 периоде, 6 группе, а бром в 4 периоде 7 группе.
14.Составьте формулы водородных соединений кремния, фосфора и теллура.
Решение:
Все перечисленные элементы имеют электроотрицательность больше, чем у водорода. При образовании гидридов связывающие электронные пары будут смещаться к более электроотрицательному элементу. Степень окисления элементов будет определяться числом электронов, присоединяющихся к атому.
Si – элемент 4-го периода. Он присоединяет при образовании гидрида четыре электрона.
Гидрид кремния SiH4.
Р – элемент 5-го периода. Он присоединяет при образовании гидрида три электрона.
Гидрид фосфора РH3.
Те – элемент 6-го периода. Он присоединяет при образовании гидрида два электрона.
Гидрид теллура ТеH2.
15.Приведите распределение электронов по орбиталям в основном и возбужденном состояниях атома углерода. Определите состояние гибридизации атома углерода в молекуле тетрахлорметана и ее геометрическое строение.
Решение:
Углерод находится во 2-м периоде, 4-й группе Периодической системы. В основном состоянии он имеет следующую электронную формулу: 1s22s22p2.
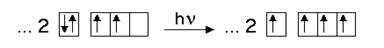 |
В возбужденном состоянии один электрон с 2s-подуровня переходит на свободную орбиталь 2p-подуровня: 1s22s12p3.
Валентные орбитали атома углерода в молекуле тетрахлорметана (СН4 - валентность углерода равна 4) находятся в состоянии sp3-гибридизации.
Геометрическое строение тетрахлорметана определяется типом гибридизации атома углерода. sp3-гибридизации центрального атома соответствует тетраэдрическое строение молекул.
16.Дипольный момент молекулы сероводорода равен 1,1 Д. Определите геометрическую конфигурацию. Объясните полярность молекулы.
Решение:
Валентные электроны серы находятся на 3p-орбиталях:
1s22s22p63s23p4. р-орбитали в пространстве взаимно перпендикулярны. Они образуют две взаимно перпендикулярные s-связи с s-орбиталями двух атомов водорода. Поэтому молекула сероводорода имеет угол Н-S-Н близкий 90°.
Электроотрицательность серы 2,6, а водорода – 2,2. Следовательно, связь Н-S полярна.
Рассчитанная по правилу параллелограмма сумма дипольных моментов связей Н-S отличается от нуля. Следовательно молекула H2S полярна.
17. Используя метод молекулярных орбиталей, объясните устойчивость молекулы азота. Определите порядок связи в этой молекуле.
Решение:
Составим энергетическую диаграмму образования молекулы азота. В молекуле азота электроны заселяют только связывающие орбитали. Энергия молекулы меньше, чем сумма энергий двух атомов азота. Это объясняет высокую устойчивость молекулы азота. Порядок связи определяется по формуле и равен:
N = [n(св) + n(разр)]/2 = (6 – 0)/2 = 3.
18. Составьте формулы оксидов и соответствующих им гидратов оксидов элементов Ва+2 и V+5.
Решение:
Оксидами называются вещества, состоящие из двух элементов, один из которых кислород. Кислород в оксидах всегда имеет валентность 2.
Гидроксиды можно рассматривать как продукт присоединения воды к молекуле оксида.
Оксид бария (II) имеет формулу BaO. Это основный оксид. Ему соответствует основание Ba(OH)2.
Оксид ванадия (V) имеет формулу V2O5. Это кислотный оксид. Ему соответствует метаванадиевая кислота HVO3.
19, Гидроксид олова (II) обладает амфотерными свойствами. Составьте уравнения реакций, подтверждающих его амфотерность.
Решение:
Амфотерными называются вещества, проявляющие, в зависимости от условий, свойства основания и кислоты. Для доказательства необходимо привести уравнения реакций взаимодействия его с кислотой и со щелочью.
Sn(OH)2 + 2HCl Þ SnCl2 + 2 H2O;
Учитывая, что гидроксид олова амфотерен, его формулу можно записать и в виде основания, и в виде кислоты:
Sn(OH)2 Û H2SnO2.
В уравнении реакции гидроксида олова со щелочью удобно исполь- зовать кислотную форму записи формулы амфотерного соединения.
H2SnO2 + 2KOH Þ K2SnO2 + 2H2O.
20. Составьте уравнения реакций:
а) SrO + H3PO4 Þ …
б) Al(OH)3 + H2SeO4 Þ …
Решение:
а) 3SrO + 2H3PO4 Þ Sr3(PO4)2¯ + 3H2O
3SrO + 6H+ + PO43- Þ Sr3(PO4)2¯ + 3H2O;
б) 2Al(OH)3¯ + 3H2SO4 Þ Al2(SO4)3 + 6H2O
2Al(OH)3¯ + 6H+ + 3SO42- Þ 2Al3+ + 3SO42- + 6H2O
2Al(OH)3¯ + 6H+ Þ 2Al3+ + 6H2O
21.Составьте формулы всех солей, которые могут получиться при взаимодействии гидроксида бария и угольной кислоты. Назовите образующиеся соли.
Решение:
В результате взаимодействия двухкислотного гидроксида бария и двухосновной угольной кислоты, в зависимости от соотношения исходных веществ, могут образоваться средняя, кислая и основная соль.
Средняя соль – продукт полного замещения гидроксогрупп и ионов водорода в молекулах основания и кислоты:
Вa(OH)2 + H2СO3 Þ ВaСO3 + 2H2O
ВaСO3 – карбонат бария.
Кислая соль – продукт неполного замещения ионов водорода в молекуле кислоты.
Вa(OH)2 + 2H2СO3 Þ Вa(НСO3)2 + 2H2O
Вa(НСO3)2 – гидрокарбонат бария.
Основная соль – продукт неполного замещения ионов гидроксида в молекуле основания.
2Вa(OH)2 + H2СO3 Þ (ВaОН)2СO3 + 2H2O
(ВaОН)2СO3 – гидроксокарбонат бария
22.Составьте молекулярные и графические формулы оксида алюминия и соответствующего ему гидроксида.
Решение:
В графической формуле указывается порядок соединения атомов в молекуле, где каждая связь обозначается черточкой. В неорганических кислородсодержащих соединениях атомы различных элементов соединяются между собой преимущественно через кислородные мостики.
O=Al-O-Al=O H¾O¾Al¾O¾H
Оксид алюминия ÷
O¾H
Гидроксид алюминия
23. Рассчитайте молярную массу эквивалента SiO2. Назовите соединение. К какому классу относится указанное вещество.
Решение:
SiO2 – оксид кремния (IV) относится к классу оксидов. Молярная масса эквивалента оксида определяется как сумма молярных масс эквивалентов элементов.
МЭ(.SiO2) = Э(Si) + Э(O) = 28/4 + 16/2 = 7 + 8 = 15 г/моль
24. Фторид некоторого элемента содержит 48 % фтора. Определите молярную массу эквивалента элемента.
Решение:
Фториды – это сложные вещества, состоящие из двух элементов, один из которых фтор.
Процентный состав вещества указывает на то, что в 100 г данного вещества содержится 48 г фтора и 52 г другого элемента (X). Молярная масса эквивалента фтора известна и равна его атомной массе (фтор в соединениях всегда одновалентен). Согласно закону эквивалентов, массы реагирующих веществ прямо пропорциональны молярным массам их эквивалентов. Следовательно:
Э(X) = m(X)×Э(F)/m(F) = 52×19/48 = 20 г/моль
25. Рассчитайте количество молекул в 64 г газообразного кислорода.
Решение:
Один моль любого вещества содержит число Авогадро молекул.
(NA =6,02×1023 моль-1). Чтобы определить число молекул в какой-либо массе вещества, необходимо определить количество вещества, соответствующее данной массе.
n(O2) = m(O2) / M(O2) = 64 г/32 (г/моль) = 2 моль
На основании этого можно получить ответ на вопрос задачи:
1 моль вещества содержит NA молекул;
2 моль вещества содержит N = 2NA молекул.
Следовательно, N = 2×6,02×1023 молекул.
26. Относительная плотность газа по водороду равна 15. Найдите молярную массу газа и массу 10 л его при нормальных условиях.
Решение:
Относительная плотность одного газа по другому равна отношению молярных масс этих газов. Следовательно,
М(газа) = D(газ/Н2)×М(Н2) = 15×2 = 30 г/моль.
Моль любого газа при нормальных условиях (Н.У.) занимает объем 22,4 л. Следовательно, 10 л газа при тех же условиях имеют массу:
m(газа) = V(газа)×M(газа) / VM(газа) = 10 л×30 (г/моль)/22,4 л/моль = 13,4 л
27. При 25 оС и 780 мм рт. ст. 10 г газа занимают объем 5,2 л. Найдите молярную массу газа.
Решение:
Воспользуемся уравнением состояния идеальных газов Менделеева - Клапейрона.
pV = nRT = mRT/M .
Отсюда, применяя R = 62400 мм×мл/моль К и переводя температуру в абсолютную шкалу, имеем:
M=mRT/(pV)=10 г×62400(мм×мл/моль×К)×298. К / (780 мм×5200 мл)=46 г/моль
28. Газообразный гидрид состава ЭН2 (где Э - некоторый элемент) имеет плотность по водороду 65. Определите формулу и молярную массу эквивалента его высшего оксида.
Решение:
Определим молекулярную массу гидрида, учитывая, что относительная плотность одного газа по другому определяется отношением молекулярных масс газов:
D(газа/Н2) = M(газа)/M(Н2)
Тогда М(газа) = D(газа/Н2)×M(Н2) = 65×2 = 130.
Следовательно, атомная масса элемента равна разности молекулярной массы гидрида элемента и двух атомных масс водорода:
М(Э) =М(ЭН2) – М(2Н) = 130 – 2 = 128.
Учитывая, что гидрид газообразный, делаем вывод, что это гидрид неметалла. Следовательно, это элемент 6-й группы - Te.
Высший оксид неметалла 6-й группы Te имеет формулу TeО3.
Молярная масса эквивалента оксида равна:
МЭ(ЭО3) = М(ЭО3)/(n(Э)×В(Э)) = 176/3×2 = 29,3 г/моль,
где n(Э) – число атомов элемента;
В(Э) –валентность элемента.
29. Элемент находится в 5-ом периоде, 4-й группе, главной подгруппе периодической системы. Составьте его электронную формулу, определите высшую степень окисления.
Решение:
Элемент 5-го периода, 4-й группы, главной подгруппы имеет 4 валентных электрона на 5-ом энергетическом уровне на 5s и 5p подуровнях. Его валентные (внешние) электроны имеют формулу 5s25p2.
Полная электронная формула 1s22s22p63s23p64s23d105s24d105p2.
30. Приведите распределение валентных электронов селена по ор-
биталям в основном и возбужденных состояниях. Определите
его возможные валентности.
Решение:
Селен находится в 4-ом периоде, 6-й группе, главной подгруппе периодической системы. Его электронная формула:
1s22s22p63s23p63d104s24p4.
Валентные электроны находятся в состоянии 4s24p4. Из них s-электроны находятся в спин - спаренном состоянии, на р - подуровне два электрона находятся в спин - спаренном состоянии, а два других в спин - свободном – распаренном.
Валентность элемента при образовании ковалентной связи определяется числом неспаренных электронов. Следовательно, в основном состоянии селен проявляет валентность, равную двум.
При переходе в возбужденное состояние по одному электрону из пар находящиеся на s- и р - подуровнях поочередно могут переходить на свободные орбитали d-подуровня, увеличивая общее число неспаренных электронов в атоме, тем самым, повышая валентность элемента. Первому возбужденному состоянию селена отвечает расположение валентных электронов в следующей конфигурации: 4s24p34d1. Число неспаренных электронов равно 4 – валентность 4.
 |
Второму возбужденному состоянию селена отвечает расположение валентных электронов в следующей конфигурации: 4s14p34d2. При этом в соответствии с правилом (Хунда) каждый электрон на 4d-подуровне занимает свободную орбиталь. Число неспаренных электронов равно 6 – валентность 6.
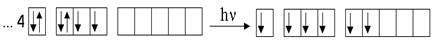 |
31. Какой из перечисленных элементов имеет наибольшее сродство
к электрону Cr, K, Br, Zn, As ?
Решение:
Все перечисленные элементы относятся к 4-му периоду. В периоде сродство к электрону увеличивается от щелочного металла (1-я группа) к галогену (7-я группа). Наибольшим сродством к электрону из перечисленных обладает Br – элемент 7-й группы.
32.Из приведенных соединений: Ni(OH)2, CaO, SO3, BaCl2, Cr2O3 выберите оксид, в составе которого находится элемент, образующий газообразный гидрид типа ЭН2. Какова
геометрическая структура такого гидрида? Какого типа химические связи реализуются в его молекуле.
Решение:
Газообразные гидриды образуют неметаллы. Неметаллы, как правило, имеют большую электроотрицательность, чем водород. Они отнимают недостающие до октета электроны у водорода. Поэтому элемент, образующий газообразный гидрид состава ЭН2, находится в 6-й группе. Такому элементу отвечает сера, образующая оксид SO3.
Между неметаллами, например, в гидриде Н2S образуются ковалентные связи. Электроотрицательность серы выше, чем у водорода, следовательно, связь полярна.
Направленность связи и геометрическая конфигурация молекул определяется ориентацией в пространстве орбиталей и направлением, в котором перекрываются в наибольшей степени орбитали при образовании химической связи.
Валентные электроны серы находятся в состоянии 3s23p4. Из них два неспаренных находятся на взаимно перпендикулярных р-орбиталях. Именно они образуют связь в молекуле H2S при перекрывании с s-орбиталями атомов водорода. Перпендикулярность р-орбиталей определяет угловое строение молекулы Н2S (ÐHSH » 90°).
33. Дипольный момент молекулы AsCl5 равен 0 Д. Полярна ли эта молекула? Определите тип гибридизации атомных орбиталей мышьяка и геометрическую конфигурацию молекулы хлорида мышьяка (V).
Решение:
Если дипольный момент молекулы равен нулю, то молекула неполярна. Мышьяк находится в 4-м периоде, 5-й группе, главной подгруппе. В молекуле AsCl5 мышьяк пятивалентен. Валентные электроны образуют конфигурацию 4s14p34d1. Гибридизация атомных орбиталей мышьяка sp3d. Геометрическая конфигурация молекулы AsCl5 отвечает тригональной бипирамиде, у которой в центре находится атом мышьяка, а в вершинах атомы хлора.
34. Определите геометрическую конфигурацию молекул NH3, PH3, AsH3, SbH3. Как и почему изменяется валентный угол НЭН в указанном ряду соединений.
Решение:
Валентные электроны элементов 5-й группы, главной подгруппы находятся в ns2np3 состоянии, где n – главное квантовое число внешнего электронного уровня. Из пяти валентных электронов атома три неспаренных находятся на трех р-орбиталях. р-Орбитали взаимно перпендикулярны. Они образуют три взаимно перпендикулярные s-связи с s-орбиталями атомов водорода. Поэтому молекулы ЭН3 имеет угол Н-Э-Н, близкий 90°. В ряду NH3, PH3, AsH3, SbH3 угол Н-Э-Н постоянно уменьшается, приближаясь к 90°. Электроотрицательность азота наибольшая в группе, а радиус атома наименьший. Следовательно связь Н-N наиболее полярна в указанном ряду соединений. Набольшие искажения прямого угла валентных связей следует ожидать именно в молекуле аммиака.
Наименьшие искажения валентного угла проявляются в молекуле SbH3, так как сурьма имеет наибольший радиус и наименьшую электроотрицательность в 5-й группе. Наименьшие искажения валентного угла проявляются в молекуле SbH3, так как сурьма имеет наибольший радиус и наименьшую электроотрицательность в 5-й группе.
Примеры решения типовых задач (темы7-11)
1. Как измениться скорость реакции N2 + 3H2 Û 2NH3, если объем системы уменьшить в 4 раза.
Решение:
При уменьшении объема газовой смеси, молярные концентрации компонентов смеси прямо пропорционально увеличиваются. В данном случае концентрации реагирующих веществ и продуктов реакции увеличиваются в 4 раза.
Согласно закону действующих масс, скорость гомогенной реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов:
V(пр) = k[N2][ H2]3.
Лабораторные работы
Лабораторная работа № 1
Свойства основных классов неорганических соединений

 Опыт 1. Взаимодействие основных оксидов с водой.
Опыт 1. Взаимодействие основных оксидов с водой.
В пробирку насыпьте немного оксида кальция CaO и добавьте 1 мл воды. Содержимое пробирки хорошо перемешайте и прибавьте 2-3 капли раствора фенолфталеина. Как изменится цвет индикатора и почему?
Опыт 2. Взаимодействие основных оксидов с кислотами.
В пробирку насыпьте немного оксида кальция (около 0,1 г) и добавьте 1 мл раствора соляной кислоты HCl. Что наблюдаете? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 3. Взаимодействие амфотерных оксидов со щелочами и кислотами.
В две пробирки насыпьте небольшое количество (около 0,1 г) оксида цинка ZnO. В первую прилейте 2-3 мл раствора соляной кислоты, во вторую 2-3 мл раствора гидроксида натрия. Что происходит? Проверьте растворимость оксида цинка в воде. Составьте уравнения всех процессов.
Опыт 4. Взаимодействие оснований с кислотами (реакция нейтрализации).
В пробирку налейте 1-2 мл раствора гидроксида натрия NaOH, добавьте 1-2 капли раствора фенолфталеина и медленно, по каплям, прибавьте 1-2 мл соляной кислоты HCl до изменения окраски индикатора. Что происходит? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 5. Исследование амфотерности гидроксидов цинка и
хрома (III).
Возьмите 2 пробирки. Налейте в первую пробирку 1 мл раствора сульфата цинка ZnSO4, во вторую - 1мл раствора сульфата хрома(III) Cr2(SO4)3. В каждую пробирку прибавьте по каплям раствор гидроксида натрия до образования осадков. Какого цвета осадки? Напишите уравнения реакций в молекулярной и ионной формах. Перемешайте осадки легким встряхиванием и каждый осадок разделите на 2 пробирки. К одной части осадков добавьте раствор соляной кислоты, а к другой - раствор гидроксида натрия (в избытке). Что наблюдаете? Напишите уравнения всех реакций в молекулярной и ионной формах.
Опыт 6. Получение нерастворимых оснований.
Налейте в пробирку 1 мл раствора хлорида железа(III) FeCI3. Добавьте 1 мл раствора гидроксида натрия. Что образуется? Составьте уравнения реакций в молекулярной и ионной формах.
Опыт 7. Взаимодействие кислот с солями.
К 1-2 мл раствора нитрата свинца(II) Pb(NO3)2 прилейте 1-2 мл раствора соляной кислоты. Что происходит? Напишите уравнения реакций в молекулярной и ионной формах.
Опыт 8. Взаимодействия кислот с металлами
Налейте в две пробирки по 1-2 мл разбавленной серной кислоты. В первую пробирку добавьте гранулу металлического цинка, а во вторую - кусочек металлической меди. Что наблюдаете? Составьте уравнения реакций.
Опыт 9. Получение солей из амфотерных гидроксидов.
Даны растворы солей: FeCI2, BaCI2, CuSO4, ZnSO4, NaCI, AI (NO3)3. Какие из этих солей могут служить исходными веществами для получения амфотерных гидроксидов? Отберите подходящие для этой цели растворы солей, налейте в пробирки по 5 мл и добавьте в каждую малыми порциями раствор щелочи до выпадения осадка. Выпавшие осадки разделите в разные пробирки на две части. В первую часть добавьте избыток щелочи, во вторую - немного раствора соляной или серной кислоты до растворения осадка. Объясните происходящие процессы. Составьте уравнения реакций.
Лабораторная работа № 2
Лабораторная работа № 3
Лабораторная работа № 4
Лабораторная работа № 5
Лабораторная работа № 6
Свойства металлов
Опыт 1. Действие кислот на металлы.
1.1. В 1 н. растворы соляной, серной, уксусной кислот поместите по кусочку магния, цинка, железа, меди. Какие продукты получаются? Напишите уравнения реакций.
Опыт 2. Сравнительная активность металлов.
2.1. В пробирки с 2-3 мл водного раствора медного купороса поместите по кусочку железа, цинка, магния. Оставьте на 10 мин. Опишите наблюдения. Напишите реакции.
2.2. Используя кусочки меди, железа, цинка, магния, растворы их солей и разбавленную серную кислоту, по методике 2.1. составьте вытеснительный ряд для предложенных металлов. Определите место водорода в этом ряду.
Опыт 3. Гальванические элементы.
3.1. В 10%-ный раствор серной кислоты поочередно поместите пластинку меди и пластинку цинка. Опишите наблюдения. Напишите уравнения протекающих реакции.
Соберите схему, состоящую из двух электродов медь-цинк, поместите электроды в раствор серной кислоты. Объясните наблюдения. Напишите реакции, протекающие на электродах.
Замкните цепь через лампочку /1В/. Опишите наблюдения в момент замыкания цепи и через 1 мин.
Определите разность потенциалов с помощью вольтметра.
Замкните цепь через насыщенный раствор сульфата натрия /на часовом стекле/, добавив несколько капель спиртового раствора фенолфталеина. Опишите наблюдения.
3.2. Составьте концентрационный гальванический элемент. В стакан, содержащий 1 М раствор сульфата меди, поместите медный электрод. В другой стакан, содержащий 0.0001 М раствор сульфата меди, также поместите медный электрод. Растворы соедините электрохимическим ключом (U -образная трубка, заполненная коллоидным раствором агар-агар, содержащим сульфат магния или натрия). С помощью милливольтметра определите разность потенциалов между электродами.
Вопросы экзамену
- Основные классы неорганических соединений. Оксиды, основания, кислоты, соли.
- Основные способы получения оксидов, оснований, кислот, солей.
- Валентность. Графические формулы, правила их составления.
- Виды оксидов: основные, кислотные, амфотерные оксиды. Особенности и свойства.
- Виды гидратов оксидов. Кислоты, основания, амфотерные гидроксиды.
- Соли средние, кислые, основные. Особенности строения и свойства.
- Основные положения атомно-молекулярной теории.
- Основные понятия в химии. Атом, молекула, элемент, атомная масса, молекулярная масса, моль, число Авогадро, молярная масса.
- Законы сохранения массы и постоянства состава.
10.Законы кратных и объемных отношений.
11.Закон эквивалентов. Эквивалент, эквивалентная масса. Способы вычисления эквивалентов простых и сложных веществ по формулам.
12.Закон Авогадро. Следствия к закону Авогадро.
13.Основные сведения о строении атомов. Состав атомных ядер. Основные характеристики протона, нейтрона, электрона. Изотопы.
14.История развития представлений о сложном строении атома. 15.Катодные лучи, термоэлектронная эмиссия, фотоэффект, рентгеновское излучение, радиоактивность. Модель атома Дж. Томсона.
16.Опыт Резерфорда. Гипотеза Резерфорда. Достоинства и недостатки гипотезы Резерфорда о строении атома.
17.Теория строения атома водорода Н. Бора.
18.Основные положения квантовой теории строения атома.
19. Квантовые числа. Электронные спектроскопические формулы атомов.
20.История открытия Периодического закона Д.И. Менделеева.
21. Экспериментальное обоснование Периодического закона
22.Закон Мозли. Роль закона Мозли. Современная формулировка Периодического закона.
23.Причины периодичности свойств элементов.
24.Связь свойств элементов, с зарядом ядра, электронным строением атомов и положением в Периодической системе.
25.Радиус атома. Энергия ионизации. Энергия сродства к электрону.
26.Электроотрицательность. Изменение свойств элементов в зависимости от положения в Периодической системе.
27.Виды и особенности химической связи.
28.Ковалентная связь. Метод валентных связей.
29.Метод молекулярных орбиталей.
30.Валентность в ковалентных соединениях. Насыщаемость.
31.Полярность химической связи. Полярность молекул. Дипольный момент.
32.Направленность химической связи. Гибридизация атомных орбиталей. Строение простейших молекул.
33.Ионная связь. Механизм образования ионной связи. Свойства ионной связи.
34.Донорно-акцепторная связь. Механизм образования донорно-акцепторной связи.
35.Металлическая связь.
36.Силы Ван-дер-Ваальса.
37. Скорость гомогенной и гетерогенной химической реакции.
38.Факторы, влияющие на скорость химической реакции.
39..Влияние концентрации на скорость химической реакции.
40.Влияние температуры на скорость химической реакции.
41..Катализ. Влияние катализаторов на скорость химической реакции.
42.Химическое равновесие. Константа равновесия.
43.Смещение химического равновесия. Принцип Ле-Шателье.
44.Влияние концентрации, давления, температуры на состояние химического равновесия.
45.Понятие раствора. Типы растворов.
46.Физическая и химическая теории растворов.
47.Способы выражения концентрации растворов.
48.Осмотическое давление. Закон Вант-Гоффа.
49.Давление насыщенного пара над раствором. Закон Рауля.
50.Повышение температуры кипения растворов. Эбулиоскопическая постоянная.
51.Понижение температуры замерзания растворов. Криоскопическая постоянная.
52.Основные положения теории электролитической диссоциации С.Аррениуса.
53.Особенности диссоциации кислот, оснований, солей (средних, кислых, основных).
54.Сильные и слабые электролиты. Степень электролитической диссоциации.
55.Особенности протекания химических реакций в растворах электролитов.
56.Ионное произведение воды. Водородный показатель (рН). Гидролиз солей.
57. Понятие окислительно-восстановительной реакции. Типы окислительно-восстановительных реакций.
58. Степень окисления. Окислитель. Восстановитель. Процесс окисления. Процесс восстановления.
59. Метод электронного баланса.
60. Метод полуреакций.
61. Физические свойства металлов.
62. Ряд напряжений Н.Н.Бекетова. Взаимодействие металлов с растворами солей.
63. Действие кислот на металлы.
64. Действие щелочей на металлы.
65. Возникновение двойного электрического слоя на границе металл-раствор. Электродный потенциал.
66.Нормальный водородный электрод. Стандартный электродный потенциал. Ряд напряжений металлов.
67. Гальванические элементы. Э.Д.С. гальванического элемента.
68.Концентрационный гальванический элемент.
69.Электролиз расплавов электролитов.
70.Электролиз водных растворов электролитов с инертным анодом.
71.Электролиз водных растворов электролитов с активным анодом.
72.Коррозия металлов. Виды коррозии.
73.Контактная коррозия металлов.
74.Коррозия под действием блуждающих токов.
75.Методы защиты металлов от коррозии.
76.Покрытия неорганические и органические.
77.Металлические покрытия.
78.Протекторная и катодная защита металлов от коррозии.
Таблица вариантов контрольных заданий
| Номер варианта | Номера задач |
| 01 | 12, 72, 102, 162, 182, 212, 242, 342, 372, 402, 432, 492 |
| 02 | 13, 73, 103, 163, 183, 213 243, 343, 373, 403, 433, 493 |
| 03 | 14, 74, 104, 164, 184, 214 244, 344, 374, 404, 434, 494 |
| 04 | 15, 75, 105, 165, 185, 215 245, 345, 375, 405, 435, 495 |
| 05 | 16, 76, 106, 166, 186, 216 246, 346, 376, 406, 436, 496 |
| 06 | 17, 77, 107, 167, 187, 217 247, 347, 377, 407, 437, 497 |
| 07 | 18, 78, 108, 168, 188, 218 248, 348, 378, 408, 438, 498 |
| 08 | 19, 79, 109, 169, 189, 219 249, 349, 379, 409, 439, 499 |
| 09 | 20, 80, 110, 170, 190, 220 250, 350, 380, 410, 440, 500 |
| 10 | 21,81, 111, 151, 191, 221 251, 351, 381, 411, 441, 481 |
| 11 | 22, 82, 112, 152, 192, 222 252, 352, 382, 412, 442,482 |
| 12 | 23, 83, 113, 153, 193, 223 253, 353, 383, 413, 443, 483 |
| 13 | 24, 84, 114,154, 194, 224 254, 354, 384, 414, 444, 484 |
| 14 | 25, 85, 115, 155, 195, 225 255, 355, 385, 415, 445, 485 |
| 15 | 26, 86, 116, 156, 196, 226 256 356, 386, 416, 446, 486 |
| 16 | 27, 87, 117, 157, 197, 227 257, 357, 387, 417, 447, 487 |
| 17 | 28, 88, 118, 158, 198, 228 258, 358, 388, 418, 448, 488 |
| 18 | 29, 89, 119, 159, 199, 229 259, 459, 389, 419, 449, 489 |
| 19 | 30, 90, 120, 160, 200, 230 260, 360, 390, 420, 450, 490 |
| 20 | 31, 92, 121, 161, 181, 211 261, 331, 361, 391, 451, 491 |
| 21 | 32, 93, 122, 162, 182, 212 262, 332, 362, 392, 452, 492 |
| 22 | 33, 94, 123, 163, 183, 213 263, 333, 363, 393, 453, 493 |
| 23 | 34, 95, 124, 164, 184, 214 264, 334, 364, 394, 454, 494 |
| 24 | 35, 96, 125, 165, 185, 215 265, 335, 365, 395, 455, 495 |
| 25 | 36, 97 126, 166, 186, 216 266, 336, 366, 396, 456, 496 |
| 26 | 37,98, 127, 167, 187, 217 267, 337, 367, 397, 457, 497 |
| 27 | 38, 99, 128, 168, 188, 218 268, 338, 368, 398, 458, 498 |
| 28 | 39, 100, 129, 169, 189, 219 269, 339, 369, 399, 459, 499 |
| 29 | 40, 101, 130, 170, 190, 220, 270, 340, 370, 400, 460, 500 |
| 30 | 41, 102, 131, 151, 191, 221 271,341, 371, 401, 461, 481 |
| 31 | 42, 103, 132, 152, 192, 222 272, 342, 372, 402, 462, 482 |
| 32 | 43, 104, 133, 153, 193, 223 273, 343, 373, 403, 463, 483 |
| 33 | 44, 105, 134, 154, 194, 224 274, 344, 374, 404, 464, 484 |
| 34 | 45, 106, 135, 155, 195, 225 275, 345, 375, 405, 465, 485 |
| 35 | 46, 107, 136, 156, 196, 226 276, 346, 376, 406, 466, 486 |
| 36 | 47, 108, 137, 157, 197, 227 277,347, 377, 407, 467, 487 |
| 37 | 48, 87, 138, 158, 198, 228 278, 348, 378, 408, 468, 488 |
| 38 | 49, 109, 139, 159, 199, 229 279, 349, 379, 409,469, 489 |
| 39 | 50, 110, 140, 160, 200, 230 280,350, 380, 410, 470, 490 |
| 40 | 51, 111, 141, 161, 171, 201 281, 351, 381, 411, 471, 491 |
| 41 | 52, 112, 142, 162, 172, 202 282, 352, 382, 412, 472, 492 |
| 42 | 53, 113, 143, 163, 173, 203 283, 353, 383, 413, 473, 493 |
| 43 | 54, 114, 144, 164, 174, 204 284, 354, 384, 414, 474, 494 |
| 44 | 55, 115, 145, 165, 175, 205 285, 355, 385, 415, 475, 495 |
| 45 2 | 56, 116, 146, 166, 176, 206 286, 356, 386, 416, 476, 496 |
| 46 | 57,117, 147, 167, 177, 207 287, 357, 387, 417, 477, 497 |
| 47 | 58,118, 148, 168, 178, 208 288, 358, 388, 418, 478, 498 |
| 48 | 59,119, 149, 169, 179, 209 289, 359, 389, 419, 479, 499 |
| 49 | 60, 120, 150, 170, 180, 210 290, 360, 390, 420, 480, 500 |
| 50 | 1, 121, 61, 151, 181, 211 291, 331, 361, 391, 421, 481 |
| 51 | 2, 122, 62, 152, 182, 212 292, 332, 362, 392,422, 482 |
| 52 | 3, 123, 63, 153, 183, 213 293, 333, 363, 393, 423, 483 |
| 53 | 4, 124, 64, 154, 184, 214 294, 334, 364, 394, 424, 484 |
| 54 | 5, 125, 65, 155, 185, 215 295, 335, 365, 395, 425, 485 |
| 55 | 6, 126, 66, 156, 186, 216 296, 336, 366, 396, 426, 486 |
| 56 | 7, 127, 67, 157, 187, 217 297, 337, 367, 397, 427, 487 |
| 57 | 8, 128, 68, 158, 188, 218 298, 338, 368, 398, 428, 488 |
| 58 | 9, 129, 69, 159, 189, 219, 299, 339, 369, 399, 429, 489 |
| 59 | 10, 130, 70, 160, 190, 220, 300, 340, 370, 400, 430, 490 |
| 60 | 11, 131, 71, 161, 191, 221 301, 341, 371, 401, 431, 491 |
| 61 | 12, 132, 72, 162, 192, 222 302, 342, 372, 402, 432, 492 |
| 62 | 13, 133, 73, 163, 193, 223 303, 343, 373, 403, 433, 493 |
| 63 | 14, 134, 74, 164, 194, 224 304, 344, 374, 404, 434, 494 |
| 64 | 15, 135, 75, 165, 195, 225 305, 345, 375, 405, 435, 495 |
| 65 | 16, 136, 76, 166, 196, 226 306, 346, 376, 406, 436, 496 |
| 66 | 17, 137, 77, 167, 197, 227 307, 347, 377, 407, 437, 497 |
| 67 | 18, 138, 78, 168, 198, 228 308, 348, 378, 408, 438, 498 |
| 68 | 19, 139, 79, 169, 199, 229 309, 349, 379, 409, 439, 499 |
| 69 | 20, 140, 80, 170, 200, 230 310, 350, 380, 410, 440, 500 |
| 70 | 21, 141, 81, 151, 181, 201 311, 351, 381, 411, 441, 481 |
| 71 | 22, 142, 82, 152, 182, 202 312, 352, 382, 412, 442, 482 |
| 72 | 23, 143, 83, 153, 183, 203 313, 353, 383, 413, 443, 483 |
| 73 | 24, 144, 84, 154, 184, 204 314, 354, 384, 414, 444, 484 |
| 74 | 25, 145, 85, 155, 185, 205 315, 355, 385, 415, 445, 485 |
| 75 | 26, 146, 86, 156, 186, 206 316, 356, 386, 416, 446, 486 |
| 76 | 27, 147, 87, 157, 187, 207 317, 357, 387, 417, 447, 487 |
| 77 | 28, 148, 88, 158, 188, 208 318, 358, 388, 418, 448, 488 |
| 78 | 29, 149, 89, 159, 189, 209 319, 359, 389, 419, 449, 489 |
| 79 | 30, 150, 90, 160, 190, 210 320, 360, 390, 420, 450, 490 |
| 80 | 31, 61, 91, 161, 191, 211 321, 331, 361, 401, 451, 491 |
| 81 | 32, 62, 92, 162, 192, 212 322, 332, 362, 402, 452, 492 |
| 82 | 33, 63, 93, 163, 193, 213 323, 333, 363, 403, 453, 493 |
| 83 | 34, 64, 94, 164, 194, 214 324, 334, 364, 404, 454, 494 |
| 84 | 35, 65, 95, 165, 195, 215 325, 335, 365, 405, 455, 495 |
| 85 | 36, 66, 96, 166, 196, 216 326, 336, 366, 406, 456, 596 |
| 86 | 37, 67, 97, 167, 197, 217 327, 337, 367, 407, 457, 497 |
| 87 | 38, 68, 98, 168, 198, 218 328, 338, 368, 408, 458, 498 |
| 88 | 39, 69, 99, 169, 199, 219 329, 339, 369, 409, 459, 499 |
| 89 | 40, 70, 100, 170, 200, 220 330, 340, 370, 410, 460, 500 |
| 90 | 1, 61, 91, 151, 171, 201, 231, 331, 361, 391, 421, 481 |
| 91 | 2, 62, 92, 152, 172, 202 232,332, 362, 392, 422, 482 |
| 92 | 3, 63, 93, 153, 173, 203 233, 333, 363, 393, 423, 483 |
| 93 | 4, 64, 94, 154, 174, 204, 234, 334, 364, 394, 424, 484 |
| 94 | 5, 65, 95, 155, 175, 205 235. 335, 365, 395, 425, 485 |
| 95 | 6, 66, 96, 156, 176, 206 236, 336, 366, 396, 426, 486 |
| 96 | 7, 67, 97, 157, 177, 207 237, 337, 367, 397, 427, 487 |
| 97 | 8, 68, 98, 158, 178, 208 238,338, 368, 398, 428, 488 |
| 98 | 9, 69, 99, 159, 179, 209 239, 339, 369, 399, 429, 489 |
| 99 | 10, 70, 100, 160, 180, 210 240, 340, 370, 400, 430, 490 |
| 00 | 11, 71, 101, 161, 181, 211 241, 341, 371, 401, 431, 491 |
Рекомендуемая литература.
1. Глинка Н.Л. Общая химия. Л.: Химия, 2014
2. Глинка Н.Л. Задачи и упражнения по общей химии. Л.: Химия,
2015.
3. Краткий справочник физико-химических величин. /Под ред. А.А.Равделя и А.М.Пономаревой. Л.: «Химия», 1983.
4. Н.Н.Павлов. Общая и неорганическая химия. М.: Дрофа, 2016
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РЕШЕНИЮ ЗАДАЧ И ВЫПОЛНЕНИЮ КОНТРОЛЬНЫХ РАБОТ
Прежде чем приступить к выполнению контрольных работ, необходимо прочитать общие указания.
1. Химию студенты-заочники изучают в течение 1 семестра.
2. В семестре студент должен представить в деканат одну контрольную работу.
Номера задач, которые студент должен включить в свою контрольную работу, определяются по таблице вариантов. Номер варианта соответствует двум последним цифрам из номера зачетной книжки.
3. Контрольные работы нужно выполнять чернилами в школьной тетради, на обложке которой приведены сведения по следующему образцу:
| Донской государственный технический университет факультет «___________________________________________» Заочная форма обучения Студент______________ Адрес______________________ Группа_______________ Шифр______________________ (номер зачетной книжки) Контрольная работа № 1 по химии за I курс |
Контрольная работа, выполненная в напечатанном виде, на проверку не принимается.
4. Условия задач в контрольной работе надо переписать полностью, без сокращений. Для замечаний преподавателя на страницах необходимо оставлять поля.
5. Вникнув в условие задачи, сделать краткую запись, выразить все данные в СИ и, где это только возможно.
6. Выявив, какие физические и химические законы лежат в основе данной задачи, решить ее в общем виде.
7. Проверив правильность общего решения, подставить числа в окончательную формулу и указать единицу искомой физической величины, проверив правильность ее размерности.
8. При получении численного ответа нужно обращать внимание на степень точности окончательного результата. Точность ответа не должна превышать точности, с которой даны исходные величины.
9. В тех задачах, где требуется начертить график, необходимо правильно выбрать масштаб и начало координатных осей.
10. В конце контрольной работы студент должен указать, какими учебниками или учебными пособиями пользовался при решении задач (название учебника, автор, год издания).
11. После проверки контрольной работы преподаватель может вернуть её на доработку.
12. Окончательное решение по контрольной работе принимает преподаватель во время устного собеседования со студентом, проводимого до сдачи экзамена.
ИЗУЧАЕМЫЕ ТЕМЫ:
Тема 1. Основные классы неорганических соединений
Тема 2. Атомно-молекулярная теория
Тема 3. Строение атома. Периодический закон Д.И. Менделеева
Тема 4. Химическая связь и строение молекул
Тема 5. Химическая кинетика и равновесие
Тема 6. Неорганическая химия
Тема 7. Дисперсные системы. Концентрация растворов. Ионные реакции в растворах электролитов. Гидролиз солей. Свойства растворов неэлектролитов. Коллоидные растворы.
Тема 8. Окислительно-восстановительные реакции
Тема 9. Общие и электрохимические свойства металлов
Тема 10. Основы химической термодинамики
Тема 11. Органическая химия и высокомолекулярные соединения
ПРАВИЛА РАБОТЫ И ТЕХНИКА БЕЗОПАСНОСТИ
В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ
Перед началом каждой лабораторной работы следует изучить по учебнику относящийся к ней теоретический материал. Ни одну аналитическую реакцию нельзя выполнять, пока не будет ясна ее химическая сущность.
1. При выполнении лабораторной работы необходимо строго соблюдать указания преподавателя и лаборантов.
2. Рабочее место, посуда и приборы всегда должны быть безукоризненно чистыми, необходимо следить за чистотой реактивов в склянках и никогда не опускать использованную пипетку в склянку с другим реактивом. Если окажется, что реактив загрязнен, то его надо заменить свежим.
3. Нельзя пробовать вещества на вкус.
4. Концентрированные кислоты, щелочи и дурно пахнущие реактивы должны находиться в вытяжном шкафу.
5. Обращение с концентрированными кислотами и щелочами требует осторожности, т.к., попадая на кожу или одежду, они вызывают ожоги или порчу одежды. Нельзя засасывать их в пипетки ртом. При попадании на кожу кислоты или щелочи пораженное место обмывают большим количеством воды под краном. Если необходимо, остатки кислоты нейтрализуют раствором Na2CO3, а остатки щелочи раствором уксусной кислоты.
6. Нельзя наклоняться над сосудом с нагреваемой жидкостью, а также над сосудом, в котором смешивают какие-либо вещества, особенно жидкости. Наблюдать за ходом реакции в стеклянном сосуде следует через его стенки.
7. Нельзя выливать в раковину растворы кислот, щелочей и солей ртути, выбрасывать осадки, фильтры, битое стекло, бумагу и т.п. Для этого служат керамические банки или эмалированные ведра.
8. Во избежание отравлений в лаборатории категорически воспрещается принимать пищу. Необходимо тщательно мыть руки после работы.
9. Нельзя держать горючие, легко воспламеняющиеся и летучие вещества (спирт, бензол, сероуглерод и т.п.) вблизи пламени или сильно нагретых приборов.
10. Следует экономно расходовать электроэнергию, газ, водопроводную и дистиллированную воду.
11. Нельзя наливать горячую жидкость в толстостенную стеклянную посуду, так как она может лопнуть.
12. После выполнения, лабораторной работы необходимо привести рабочее место в порядок, сдать его дежурному и только тогда можно оставить лабораторию.
Типовые задачи по темам 1-6
1.Докажите амфотерные свойства оксида хрома(III) и гидроксида цинка, приведите уравнения соответствующих реакций.
2.Приведите формулы всех солей, которые могут образоваться при взаимодействии гидроксида алюминия и соляной кислоты.
3.Составьте формулы сульфата алюминия, дигидрофосфата кальция, гидроксокарбоната меди(II). Приведите их графические формулы.
4.Вычислите эквиваленты и молярные массы эквивалентов Ag2O, CaHPO4, (CuOH)2CO3, H3BO3.
5.Составьте формулы оксидов и гидроксидов следующих элементов:
S+6, K+, Mn+7, Sn+2, P+5, Si+4. Определите, какие из них обладают основными, кислотными или амфотерными свойствами. Ответ аргументируйте уравнениями соответствующих реакций.
6.Составьте формулы оксидов, соответствующие следующим гидроксидам: Mn(OH)4, NaOH, H3PO4, HPO3. Составьте графические формулы всех соединений.
7.Определите плотность вещества, если 30 см3 его имеют массу 45 г.
8.Сколько сульфида железа должно получиться, если для проведения реакции взяли 8 г серы и 28 граммов железа?
9.Определите простейшую формулу поташа, если массовый состав этого вещества: калия - 56,6%, углерода - 8,7%, кислорода - 34,8%.
10.При сжигании 1,55 г фосфора получено 3,53 г фосфорного ангидрида. Определите количественный состав фосфорного ангидрида.
11.Вычислите эквивалент и молярную массу эквивалентов ортофосфорной кислоты в реакциях обмена с едким натром, в результате которых образуются нормальная и кислые соли.
12.Из 1,4 г кальция получили 2,52 г его сульфида. Определите молярную массу эквивалента металла.
13.Плотность газа по воздуху 1,52. Определите относительную молекулярную массу газа.
14.Вычислите молекулярную массу газа, если при 25оС и 800 мм рт. ст. 350 мл его имеют массу 0,78 г. Определите его относительную плотность по воздуху.
15.Какой объем при нормальных условиях занимают 1020 молекул газа.
16.Составьте полную электронную формулу элемента, расположенного в 6-ом периоде, 7-й группе, главной подгруппе.
17.Газообразный гидрид элемента "Э" имеет формулу ЭН2. Определите формулу его высшего оксида и его молекулярную массу, если плотность гидрида по воздуху равна 1,172
18. Объясните, почему сера и хлор проявляют максимальную степень окисления, равную номеру группы, а кислород и фтор таковой не проявляют.
19. Какие из перечисленных молекул будут неполярными: H2S, HF, CCl4, NH3, BCl3. Дайте мотивированный ответ.
20.Учитывая sp3-гибридизацию углерода, укажите, в какой из молекул дипольный момент наибольший: а) CH4, б) CH3Cl, в) CH2Cl2, г) CHCl3,
д) CCl4?
21. Укажите, какие молекулы, из перечисленных ниже, имеют угловую форму:
H2O, BeCl2, CO2, H2S?
Примеры решения типовых задач (темы 1-6)
1. Составьте формулы оксидов и гидроксидов следующих элементов: Cl+7, Al+3, Cr+6, Sr+2.
Решение:
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. Кислород во всех соединениях имеет валентность, равную 2. Формула оксида определяется правилом: произведение валентности кислорода на индекс в формуле, указывающий число атомов кислорода в молекуле, равно такому же произведению другого атома в молекуле. Одновременно произведение валентностей элементов равно произведению индексов этих элементов в формуле.
Учитывая вышесказанное, имеем, например, для семивалентного хлора:
формула оксида хлора (VII) Cl2O7.
Аналогично получим: Al2O3, CrO3, SrO.
Гидроксиды (гидраты оксидов) – формально можно рассматривать как продукты присоединения воды к молекуле оксида.
Основным оксидам в качестве гидратов соответствуют основания. В формуле основания на первое место записывают металл, за ним записывают гидроксогруппы. Число гидроксогрупп равно валентности металла
SrO + H2O Þ Sr(OH)2
Кислотным оксидам в качестве гидратов соответствуют кислоты (продукты присоединения молекулы воды к кислотным оксидам). В формуле кислоты на первое место записывают водород, за ним центральный атом и на последнем месте кислород.
Cl2O7 + H2O Þ H2Cl2O8 Þ 2HClO4.
CrO3 + H2O Þ H2CrO4
Амфотерным оксидам соответствуют амфотерные гидроксиды (также могут быть представлены как продукты присоединения воды к молекуле амфотерного оксида).
Al2O3 + 3H2O Þ 2Al(OH)3.
2. Докажите амфотерные свойства оксида олова(II) и гидроксида бериллия, приведите уравнения соответствующих реакций.
Решение:
Чтобы доказать амфотерность оксида или гидроксида, следует составить уравнения реакций взаимодействия данного вещества с кислотой и со щелочью.
SnO + 2HCl Þ SnCl2 + H2O
SnO + 2NaOH Þ Na2SnO2 + H2O.
Be(OH)2 + 2HCl Þ BeCl2 + 2H2O
Be(OH)2 + 2NaOH Þ Na2BeO2 + 2H2O
3. Приведите формулы всех солей, которые могут образоваться при взаимодействии гидроксида кальция и серной кислоты. Составьте уравнения соответствующих реакций. Назовите продукты реакций.
Решение:
Различают соли средние – продукт полного замещения гидроксогрупп и ионов водорода в молекулах оснований и кислот:
Сa(OH)2 + H2SO4 Þ CaSO4 + 2H2O
CaSO4 – сульфат кальция;
Кислые соли – продукт неполного замещения ионов водорода в молекуле кислоты (могут быть образованы неодноосновными кислотами):
Сa(OH)2 + 2H2SO4 Þ Ca(НSO4)2 + 2H2O
Ca(НSO4)2 – гидросульфат кальция;
Основные соли – продукт неполного замещения ионов гидроксила в молекуле основания (могут быть образованы неоднокислотными основаниями):
2Сa(OH)2 + H2SO4 Þ (CaОН)2SO4 + 2H2O
(CaОН)2SO4 – гидроксосульфат кальция.
4. Составьте графическую формулу Ca(NO3)2.
Решение:
В графической формуле указывается порядок соединения атомов в молекуле, где каждая связь обозначается черточкой. В графической формуле не учитываются валентные углы между связями. Двойные связи обозначаются двойной черточкой, а тройные – тройной. В неорганических кислородсодержащих соединениях атомы различных элементов соединяются между собой, преимущественно, через кислородные мостики.
O O
ç÷ ç÷
N-O-Ca-O-N
ç÷ ç÷
O O
5. Определите простейшую формулу вещества, содержащего 40 % мас. меди, 20% мас. серы, 40 % мас. кислорода.
Решение:
Обозначим общую формулу вещества СuxSyOz. Индексы в формуле соединения относятся как количества вещества каждого элемента. Из процентного состава вещества известно, что 100 г вещества содержат 40 г меди, 20 г серы и 40 г кислорода. Найдем количество вещества каждого элемента, возьмем их отношение и преобразуем в отношение целых чисел, для чего разделим каждое число в отношении на наименьшее:
x : y : z = n(Cu) : n(S) : n(O) = m(Cu)/ M(Cu) : m(S)/ M(S) : m(O)/ M(O) =
= (40/64) : (20/32) : (40/16) = 0,625 : 0,625 : 2,5 = 1 : 1 : 4
Cледовательно, простейшая формула соединения CuSO4.
6. Определите количественный состав марганца в оксидах марганца (IV) и марганца(VII).
Решение:
Молекулярная масса марганца равна 55 г/моль, оксида марганца (IV) MnO2 – 87 г/моль, оксида марганца (VII) Mn2O7 – 222 г/моль.
1 моль MnO2 содержит 1 моль атомов марганца Mn.
Следовательно:
87 г MnO2 содержат 55 г Mn, а
100 г MnO2 содержат х г Mn.
Решая пропорцию, имеем:
х = (100×55)/87 = 63,2 г.
Массовая доля марганца в оксиде марганца (IV) составляет 63,2%.
Аналогично для оксида марганца (VII).
1 моль Mn2O7 содержит 2 моль атомов марганца Mn.
Следовательно:
222 г Mn2O7 содержат 110 г Mn, а
100 г Mn2O7 содержат y г Mn.
Решая пропорцию, имеем:
y = (100×100)/222 = 49,5 г.
Массовая доля марганца в оксиде марганца (VII) составляет 49,5%.
7. Сколько граммов хлорида магния получится, если для реакции взяли 48 г магния и 105 г хлора?
Решение:
Составим уравнение реакции:
Mg + Cl2 Þ MgCl2.
По уравнению реакции на 1 моль магния приходится 1 моль хлора.
Определим количество вещества каждого компонента, введенных в реакцию.
n(Mg) = m(Mg)/M(Mg) = 48 /24 = 2 моль.
n(Cl2) = m(Cl2)/M(Cl2) = 105/ 70 = 1,5 моль.
Хлор находится в недостатке. Расчеты ведем по недостатку.
По уравнению реакции на 1 моль хлора приходится 1 моль хлорида магния. Следовательно, в результате реакции получено 1,5 моль хлорида магния. Тогда масса хлорида магния составляет:
m(MgCl2) = n(MgCl2) × M(MgCl2) = 1,5 × 94 = 141 г.
8. Рассчитайте эквиваленты и молекулярные массы эквивалентов соединений: MnO2, H3PO4, Ca(H2PO4)2. Назовите вещества.
Решение:
Оксид марганца (IV).
МЭ(MnO2) = М(MnO2)/n(O)×B (O) = (55+16×2)/2×2 = 21,75,г/моль
где n(O) – число атомов кислорода в молекуле;
B (O) – валентность кислорода.
Э(MnO2)=1/4 MnO2
Ортофосфорная кислота.
МЭ(H3PO4) = М(H3PO4) / n(Н) = (3+31+16×4)/3 = 32,7 г/моль
где n(Н) – число атомов водорода в молекуле кислоты.
Э(H3PO4)=1/3 H3PO4
Дигидрофосфат кальция.
МЭ(Ca(H2PO4)2) = М(Ca(H2PO4)2)/n(М)×B(М) = (40+2+31×2+16×2×4)/2×1 = 116 г/моль
Э(Ca(H2PO4)2) =1/2 Э(Ca(H2PO4)2)
где n(М) – число атомов металла в молекуле;
B (М) – валентность металла.
9. Окислением 1,4 г кадмия получили 1,6 г его оксида. Определите молярную массу эквивалента металла.
Решение:
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород. Согласно условию 1,6 г оксида кадмия содержит 1,4 г металла. Следовательно, остальное составляет кислород – 0,2 г. Молярная масса эквивалента кислорода известна и равна 8 г/моль. Из закона эквивалентов - массы реагирующих веществ относятся, как молярные массы их эквивалентов– следует:
MЭ(Cd) = m (Cd)×mЭ (O) / m (O) = 1,4×8/0,2 = 56 г/моль.
Относительная плотность газа по водороду равна 35. Определите молярную массу газа и рассчитайте массу 5 л этого газа.
Решение:
Относительная плотность одного газа по другому равна отношению их молекулярных или молярных масс. D(газа/Н2) = М( газа) / М(Н2)
М (газа) = D(газа/Н2)× М(Н2) = 35 × 2 = 70 г/моль.
Моль любого газа при нормальных условиях занимает обьем 22,4 л. Следовательно, 5 л газа при тех же условиях имеют:
m( газа)= V (газа)М(газа)/VМ(газа)=5л´70(г/моль)/22,4 л/моль =15,6 г
10. 1000 л газа при 745 мм рт. ст. и 15°С имеют массу 1,825 кг. Определите его молекулярную массу.
Решение:
Применим уравнение состояния идеального газа Менделеева - Клапейрона
pV = (m/M) RT.
Тогда:
M=mRT/(pV)=1825г× 62400мм×мл/моль×К×288К/(745мм×106мл)=44 г/моль.
11. Определите положение никеля в Периодической системе. Составьте его электронную формулу.
Решение:
Никель находится в Периодической системе в 4-ом периоде, 8-й группе, побочной подгруппе, 3-й элемент триады.
Электронная формула определяется положением в Периодической системе:
1s22s22p63s23p64s23d8
12. Обоснуйте положение в периодической системе элемента, имеющего валентные электроны в состоянии 7s26d3.
Решение:
Главное квантовое число внешнего электронного слоя указанного элемента равно 7. Следовательно, это элемент 7-го периода.
Валентные электроны его располагаются на внешнем s- и предвнешнем d- подуровнях. Следовательно, это элемент побочной подгруппы.
Общее число валентных электронов данного элемента равно 5 (2 на s- и 3 на d-подуровнях). Следовательно, это элемент 5-й группы.
13.Какой из элементов: кислород, сера или бром является наиболее типичным неметаллом и почему?
Решение:
Неметаллические свойства тем ярче проявляются, чем выше и правее в Периодической системе находится элемент.
Кислород находится во 2-ом периоде, 6-й группе Периодической системы, что характеризует его как наиболее ярко выраженный неметалл из перечисленных.
Сера находится в 3 периоде, 6 группе, а бром в 4 периоде 7 группе.
14.Составьте формулы водородных соединений кремния, фосфора и теллура.
Решение:
Все перечисленные элементы имеют электроотрицательность больше, чем у водорода. При образовании гидридов связывающие электронные пары будут смещаться к более электроотрицательному элементу. Степень окисления элементов будет определяться числом электронов, присоединяющихся к атому.
Si – элемент 4-го периода. Он присоединяет при образовании гидрида четыре электрона.
Гидрид кремния SiH4.
Р – элемент 5-го периода. Он присоединяет при образовании гидрида три электрона.
Гидрид фосфора РH3.
Те – элемент 6-го периода. Он присоединяет при образовании гидрида два электрона.
Гидрид теллура ТеH2.
15.Приведите распределение электронов по орбиталям в основном и возбужденном состояниях атома углерода. Определите состояние гибридизации атома углерода в молекуле тетрахлорметана и ее геометрическое строение.
Решение:
Углерод находится во 2-м периоде, 4-й группе Периодической системы. В основном состоянии он имеет следующую электронную формулу: 1s22s22p2.
 |
В возбужденном состоянии один электрон с 2s-подуровня переходит на свободную орбиталь 2p-подуровня: 1s22s12p3.
Валентные орбитали атома углерода в молекуле тетрахлорметана (СН4 - валентность углерода равна 4) находятся в состоянии sp3-гибридизации.
Геометрическое строение тетрахлорметана определяется типом гибридизации атома углерода. sp3-гибридизации центрального атома соответствует тетраэдрическое строение молекул.
16.Дипольный момент молекулы сероводорода равен 1,1 Д. Определите геометрическую конфигурацию. Объясните полярность молекулы.
Решение:
Валентные электроны серы находятся на 3p-орбиталях:
1s22s22p63s23p4. р-орбитали в пространстве взаимно перпендикулярны. Они образуют две взаимно перпендикулярные s-связи с s-орбиталями двух атомов водорода. Поэтому молекула сероводорода имеет угол Н-S-Н близкий 90°.
Электроотрицательность серы 2,6, а водорода – 2,2. Следовательно, связь Н-S полярна.
Рассчитанная по правилу параллелограмма сумма дипольных моментов связей Н-S отличается от нуля. Следовательно молекула H2S полярна.
17. Используя метод молекулярных орбиталей, объясните устойчивость молекулы азота. Определите порядок связи в этой молекуле.
Решение:
Составим энергетическую диаграмму образования молекулы азота. В молекуле азота электроны заселяют только связывающие орбитали. Энергия молекулы меньше, чем сумма энергий двух атомов азота. Это объясняет высокую устойчивость молекулы азота. Порядок связи определяется по формуле и равен:
N = [n(св) + n(разр)]/2 = (6 – 0)/2 = 3.
18. Составьте формулы оксидов и соответствующих им гидратов оксидов элементов Ва+2 и V+5.
Решение:
Оксидами называются вещества, состоящие из двух элементов, один из которых кислород. Кислород в оксидах всегда имеет валентность 2.
Гидроксиды можно рассматривать как продукт присоединения воды к молекуле оксида.
Оксид бария (II) имеет формулу BaO. Это основный оксид. Ему соответствует основание Ba(OH)2.
Оксид ванадия (V) имеет формулу V2O5. Это кислотный оксид. Ему соответствует метаванадиевая кислота HVO3.
19, Гидроксид олова (II) обладает амфотерными свойствами. Составьте уравнения реакций, подтверждающих его амфотерность.
Решение:
Амфотерными называются вещества, проявляющие, в зависимости от условий, свойства основания и кислоты. Для доказательства необходимо привести уравнения реакций взаимодействия его с кислотой и со щелочью.
Sn(OH)2 + 2HCl Þ SnCl2 + 2 H2O;
Учитывая, что гидроксид олова амфотерен, его формулу можно записать и в виде основания, и в виде кислоты:
Sn(OH)2 Û H2SnO2.
В уравнении реакции гидроксида олова со щелочью удобно исполь- зовать кислотную форму записи формулы амфотерного соединения.
H2SnO2 + 2KOH Þ K2SnO2 + 2H2O.
20. Составьте уравнения реакций:
а) SrO + H3PO4 Þ …
б) Al(OH)3 + H2SeO4 Þ …
Решение:
а) 3SrO + 2H3PO4 Þ Sr3(PO4)2¯ + 3H2O
3SrO + 6H+ + PO43- Þ Sr3(PO4)2¯ + 3H2O;
б) 2Al(OH)3¯ + 3H2SO4 Þ Al2(SO4)3 + 6H2O
2Al(OH)3¯ + 6H+ + 3SO42- Þ 2Al3+ + 3SO42- + 6H2O
2Al(OH)3¯ + 6H+ Þ 2Al3+ + 6H2O
21.Составьте формулы всех солей, которые могут получиться при взаимодействии гидроксида бария и угольной кислоты. Назовите образующиеся соли.
Решение:
В результате взаимодействия двухкислотного гидроксида бария и двухосновной угольной кислоты, в зависимости от соотношения исходных веществ, могут образоваться средняя, кислая и основная соль.
Средняя соль – продукт полного замещения гидроксогрупп и ионов водорода в молекулах основания и кислоты:
Вa(OH)2 + H2СO3 Þ ВaСO3 + 2H2O
ВaСO3 – карбонат бария.
Кислая соль – продукт неполного замещения ионов водорода в молекуле кислоты.
Вa(OH)2 + 2H2СO3 Þ Вa(НСO3)2 + 2H2O
Вa(НСO3)2 – гидрокарбонат бария.
Основная соль – продукт неполного замещения ионов гидроксида в молекуле основания.
2Вa(OH)2 + H2СO3 Þ (ВaОН)2СO3 + 2H2O
(ВaОН)2СO3 – гидроксокарбонат бария
22.Составьте молекулярные и графические формулы оксида алюминия и соответствующего ему гидроксида.
Решение:
В графической формуле указывается порядок соединения атомов в молекуле, где каждая связь обозначается черточкой. В неорганических кислородсодержащих соединениях атомы различных элементов соединяются между собой преимущественно через кислородные мостики.
O=Al-O-Al=O H¾O¾Al¾O¾H
Оксид алюминия ÷
O¾H
Гидроксид алюминия
23. Рассчитайте молярную массу эквивалента SiO2. Назовите соединение. К какому классу относится указанное вещество.
Решение:
SiO2 – оксид кремния (IV) относится к классу оксидов. Молярная масса эквивалента оксида определяется как сумма молярных масс эквивалентов элементов.
МЭ(.SiO2) = Э(Si) + Э(O) = 28/4 + 16/2 = 7 + 8 = 15 г/моль
24. Фторид некоторого элемента содержит 48 % фтора. Определите молярную массу эквивалента элемента.
Решение:
Фториды – это сложные вещества, состоящие из двух элементов, один из которых фтор.
Процентный состав вещества указывает на то, что в 100 г данного вещества содержится 48 г фтора и 52 г другого элемента (X). Молярная масса эквивалента фтора известна и равна его атомной массе (фтор в соединениях всегда одновалентен). Согласно закону эквивалентов, массы реагирующих веществ прямо пропорциональны молярным массам их эквивалентов. Следовательно:
Э(X) = m(X)×Э(F)/m(F) = 52×19/48 = 20 г/моль
25. Рассчитайте количество молекул в 64 г газообразного кислорода.
Решение:
Один моль любого вещества содержит число Авогадро молекул.
(NA =6,02×1023 моль-1). Чтобы определить число молекул в какой-либо массе вещества, необходимо определить количество вещества, соответствующее данной массе.
n(O2) = m(O2) / M(O2) = 64 г/32 (г/моль) = 2 моль
На основании этого можно получить ответ на вопрос задачи:
1 моль вещества содержит NA молекул;
2 моль вещества содержит N = 2NA молекул.
Следовательно, N = 2×6,02×1023 молекул.
26. Относительная плотность газа по водороду равна 15. Найдите молярную массу газа и массу 10 л его при нормальных условиях.
Решение:
Относительная плотность одного газа по другому равна отношению молярных масс этих газов. Следовательно,
М(газа) = D(газ/Н2)×М(Н2) = 15×2 = 30 г/моль.
Моль любого газа при нормальных условиях (Н.У.) занимает объем 22,4 л. Следовательно, 10 л газа при тех же условиях имеют массу:
m(газа) = V(газа)×M(газа) / VM(газа) = 10 л×30 (г/моль)/22,4 л/моль = 13,4 л
27. При 25 оС и 780 мм рт. ст. 10 г газа занимают объем 5,2 л. Найдите молярную массу газа.
Решение:
Воспользуемся уравнением состояния идеальных газов Менделеева - Клапейрона.
pV = nRT = mRT/M .
Отсюда, применяя R = 62400 мм×мл/моль К и переводя температуру в абсолютную шкалу, имеем:
M=mRT/(pV)=10 г×62400(мм×мл/моль×К)×298. К / (780 мм×5200 мл)=46 г/моль
28. Газообразный гидрид состава ЭН2 (где Э - некоторый элемент) имеет плотность по водороду 65. Определите формулу и молярную массу эквивалента его высшего оксида.
Решение:
Определим молекулярную массу гидрида, учитывая, что относительная плотность одного газа по другому определяется отношением молекулярных масс газов:
D(газа/Н2) = M(газа)/M(Н2)
Тогда М(газа) = D(газа/Н2)×M(Н2) = 65×2 = 130.
Следовательно, атомная масса элемента равна разности молекулярной массы гидрида элемента и двух атомных масс водорода:
М(Э) =М(ЭН2) – М(2Н) = 130 – 2 = 128.
Учитывая, что гидрид газообразный, делаем вывод, что это гидрид неметалла. Следовательно, это элемент 6-й группы - Te.
Высший оксид неметалла 6-й группы Te имеет формулу TeО3.
Молярная масса эквивалента оксида равна:
МЭ(ЭО3) = М(ЭО3)/(n(Э)×В(Э)) = 176/3×2 = 29,3 г/моль,
где n(Э) – число атомов элемента;
В(Э) –валентность элемента.
29. Элемент находится в 5-ом периоде, 4-й группе, главной подгруппе периодической системы. Составьте его электронную формулу, определите высшую степень окисления.
Решение:
Элемент 5-го периода, 4-й группы, главной подгруппы имеет 4 валентных электрона на 5-ом энергетическом уровне на 5s и 5p подуровнях. Его валентные (внешние) электроны имеют формулу 5s25p2.
Полная электронная формула 1s22s22p63s23p64s23d105s24d105p2.
30. Приведите распределение валентных электронов селена по ор-
биталям в основном и возбужденных состояниях. Определите
его возможные валентности.
Решение:
Селен находится в 4-ом периоде, 6-й группе, главной подгруппе периодической системы. Его электронная формула:
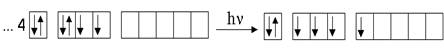
1s22s22p63s23p63d104s24p4.
Валентные электроны находятся в состоянии 4s24p4. Из них s-электроны находятся в спин - спаренном состоянии, на р - подуровне два электрона находятся в спин - спаренном состоянии, а два других в спин - свободном – распаренном.
Валентность элемента при образовании ковалентной связи определяется числом неспаренных электронов. Следовательно, в основном состоянии селен проявляет валентность, равную двум.
При переходе в возбужденное состояние по одному электрону из пар находящиеся на s- и р - подуровнях поочередно могут переходить на свободные орбитали d-подуровня, увеличивая общее число неспаренных электронов в атоме, тем самым, повышая валентность элемента. Первому возбужденному состоянию селена отвечает расположение валентных электронов в следующей конфигурации: 4s24p34d1. Число неспаренных электронов равно 4 – валентность 4.
 |
Второму возбужденному состоянию селена отвечает расположение валентных электронов в следующей конфигурации: 4s14p34d2. При этом в соответствии с правилом (Хунда) каждый электрон на 4d-подуровне занимает свободную орбиталь. Число неспаренных электронов равно 6 – валентность 6.
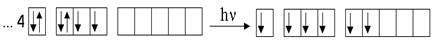 |
31. Какой из перечисленных элементов имеет наибольшее сродство
к электрону Cr, K, Br, Zn, As ?
Решение:
Все перечисленные элементы относятся к 4-му периоду. В периоде сродство к электрону увеличивается от щелочного металла (1-я группа) к галогену (7-я группа). Наибольшим сродством к электрону из перечисленных обладает Br – элемент 7-й группы.
32.Из приведенных соединений: Ni(OH)2, CaO, SO3, BaCl2, Cr2O3 выберите оксид, в составе которого находится элемент, образующий газообразный гидрид типа ЭН2. Какова
геометрическая структура такого гидрида? Какого типа химические связи реализуются в его молекуле.
Решение:
Газообразные гидриды образуют неметаллы. Неметаллы, как правило, имеют большую электроотрицательность, чем водород. Они отнимают недостающие до октета электроны у водорода. Поэтому элемент, образующий газообразный гидрид состава ЭН2, находится в 6-й группе. Такому элементу отвечает сера, образующая оксид SO3.
Между неметаллами, например, в гидриде Н2S образуются ковалентные связи. Электроотрицательность серы выше, чем у водорода, следовательно, связь полярна.
Направленность связи и геометрическая конфигурация молекул определяется ориентацией в пространстве орбиталей и направлением, в котором перекрываются в наибольшей степени орбитали при образовании химической связи.
Валентные электроны серы находятся в состоянии 3s23p4. Из них два неспаренных находятся на взаимно перпендикулярных р-орбиталях. Именно они образуют связь в молекуле H2S при перекрывании с s-орбиталями атомов водорода. Перпендикулярность р-орбиталей определяет угловое строение молекулы Н2S (ÐHSH » 90°).
33. Дипольный момент молекулы AsCl5 равен 0 Д. Полярна ли эта молекула? Определите тип гибридизации атомных орбиталей мышьяка и геометрическую конфигурацию молекулы хлорида мышьяка (V).
Решение:
Если дипольный момент молекулы равен нулю, то молекула неполярна. Мышьяк находится в 4-м периоде, 5-й группе, главной подгруппе. В молекуле AsCl5 мышьяк пятивалентен. Валентные электроны образуют конфигурацию 4s14p34d1. Гибридизация атомных орбиталей мышьяка sp3d. Геометрическая конфигурация молекулы AsCl5 отвечает тригональной бипирамиде, у которой в центре находится атом мышьяка, а в вершинах атомы хлора.
34. Определите геометрическую конфигурацию молекул NH3, PH3, AsH3, SbH3. Как и почему изменяется валентный угол НЭН в указанном ряду соединений.
Решение:
Валентные электроны элементов 5-й группы, главной подгруппы находятся в ns2np3 состоянии, где n – главное квантовое число внешнего электронного уровня. Из пяти валентных электронов атома три неспаренных находятся на трех р-орбиталях. р-Орбитали взаимно перпендикулярны. Они образуют три взаимно перпендикулярные s-связи с s-орбиталями атомов водорода. Поэтому молекулы ЭН3 имеет угол Н-Э-Н, близкий 90°. В ряду NH3, PH3, AsH3, SbH3 угол Н-Э-Н постоянно уменьшается, приближаясь к 90°. Электроотрицательность азота наибольшая в группе, а радиус атома наименьший. Следовательно связь Н-N наиболее полярна в указанном ряду соединений. Набольшие искажения прямого угла валентных связей следует ожидать именно в молекуле аммиака.
Наименьшие искажения валентного угла проявляются в молекуле SbH3, так как сурьма имеет наибольший радиус и наименьшую электроотрицательность в 5-й группе. Наименьшие искажения валентного угла проявляются в молекуле SbH3, так как сурьма имеет наибольший радиус и наименьшую электроотрицательность в 5-й группе.
Дата: 2019-02-25, просмотров: 765.