К группе миофибриллярных белков относятся миозин, актин и актомиозин – белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц.
1. Миозин (рис. 3) основа толстых нитей, составляет 50–55% от сухой массы миофибрилл. Молекулярная масса ≈ 500 кДа. Представление о миозине как о главном белке миофибрилл сложилось в результате работ А.Я. Данилевского, О. Фюрта, Э. Вебера и ряда других исследователей. Однако всеобщее внимание к миозину было привлечено лишь после опубликования работ В.А. Энгельгардта и М.Н. Любимовой (1939–1942). В этих работах впервые было показано, что миозин обладает АТФ-азной активностью, т.е. способностью катализировать расщепление АТФ на АДФ и Н3РО4. Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, превращается в механическую энергию сокращающейся мышцы. Молекула миозина имеет вытянутую часть, состоящую из двух спиралей, накрученных одна на другую. Каждая спираль имеет на одном конце глобулярную головку и называется тяжёлой цепью. Возле головок спиралей располагается по 2 лёгких цепи. При обработке ферментами молекула миозина распадается на 2 больших фрагмента: тяжёлый меромиозин (обе головки и часть двойной спирали) и лёгкий меромиозин (остальная часть двойной спирали).
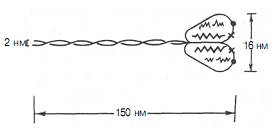
| Рис. 3. Строение молекулы миозина. Объяснение в тексте. |
Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы), способную соединяться с актином. Легкие цепи, находящиеся в «головке» миозиновой молекулы, принимают участие в проявлении АТФ-азной активности миозина, гетерогенны по своему составу. Количество легких цепей в молекуле миозина у различных видов животных и в разных типах мышц неодинаково.
Толстые нити (толстые миофиламенты) в саркомере образование, полученное путем соединения большого числа определенным образом ориентированных в пространстве молекул миозина (рис.4).

Рис. 4. Строение толстого миозинового филамента.
Функции миозина:
▪ структурная — около 400 молекул миозина соединяются между собой «хвост» в «хвост» и образуют толстую нить;
▪ каталитическая — головка миозина способна расщеплять АТФ;
▪ контактная — соединяется с актином своими головками, которые в таком случае называются «поперечные мостики».
2. Актин - белок тонких нитей, составляющий 20% от сухой массы миофибрилл, был открыт Ф. Штраубом в 1942 г. Молекулярная масса — 42 кДа. Известны две формы актина: глобулярный актин (G-актин, globular) и фибриллярный актин (F-актин) в виде двойной спирали. Молекула G-актина состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 АМК остатка. При повышении ионной силы до физиологического уровня G-актин полимеризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой (рис. 5).
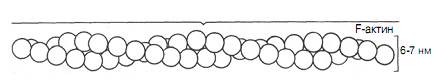
| Рис. 5. Схематическое изображение F-актина |
Актомиозин образуется при соединении миозина с F-актином. Актомиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФ-азной активностью, которая отличается от таковой миозина, она значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg 2+ и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФ-аза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны.
3. Тропомиозин (открыт К. Бейли в 1946 г.) - белок тонких нитей. Молекулярная масса—65 кДа. Состоит из двух α-спиралей в форме палочки. Располагается в бороздках, идущих вдоль обеих сторон актина. Каждая его молекула лежит на 7 молекулах актина. На долю тропомиозина приходится около 4–7% всех белков миофибрилл.
4. Тропонин – глобулярный белок тонких нитей, открытый С. Эбаси в 1963 г.; его мол.масса 80кДа. Состоит из 3 субъединиц: С-кальцийсвязывающий, обеспечивает связь с тропомиозином (Тн-С); I-ингибиторная (Тн-I), которая блокирует преждевременное соединение головок миозина с актином, может ингибировать АТФ-азную активность; Т-для связывания с тропомиозином (Тн-Т).
В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков
Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+ (рис. 6).
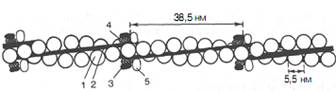
| Рис. 6. Структура тонкого филамента. 1 - актин; 2 - тропомиозин; 3 - тропонин С; 4 - тропонин I; 5 - тропонин Т. |
Установлено, что тропонин (его субъединицы Тн-Т и Тн-I) способен фосфорилироваться при участии цАМФ-зависимых протеинкиназ. Вопрос о том, имеет ли отношение фосфорилирование тропонина in vitro к регуляции мышечного сокращения, остается пока открытым.
5. α-актинин. Входит в Z-линию и фиксирует там тонкие нити. 6. β-актинин. Регулирует длину тонких нитей.7. М-белок. Входит в М-линию и фиксирует там толстые нити. 8. С-белок. Регулирует длину толстых нитей. 9. Десмин. Содержится между Z-линиями соседних миофибрилл, обеспечивая совпадение границ всех их саркомеров.
Белки саркоплазмы - протеины, растворимые в солевых средах с низкой ионной силой. Глобулин X представляет собой смесь различных белковых веществ со свойствами глобулинов. В состав белков группы миогена входит ряд протеинов, наделенных ферментативной активностью: например, ферменты гликолиза. Дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обмена. Парвальбумины (кальмодулин и кальсеквестрин и др.), которые способны связывать ионы Са2+.
Таким образом, к белкам саркоплазмы можно отнести: миоглобин, ферменты гликолиза, кальмодулин и кальсеквестрин, способные обратимо связываться с ионами Са2+.
Белки стромы. Это коллаген и эластин. Известно, что строма скелетных мышц, остающаяся после исчерпывающей экстракции мышечной кашицы солевыми растворами с высокой ионной силой, состоит в значительной мере из соединительнотканных элементов стенок сосудов и нервов, а также сарколеммы и некоторых других структур.
Дата: 2019-02-25, просмотров: 362.