Биохимия обмена веществ
Тема: МЫШЕЧНАЯ ТКАНЬ
I Научно-методическое обоснование темы:
Мышечная ткань взрослого человека составляет 40–42% (у пожилых людей – 30% , у детей – 35%) от массы тела. Основная динамическая функция мышц – обеспечить подвижность путем сокращения и последующего расслабления. При сокращении мышц осуществляется работа, связанная с превращением химической энергии в механическую.
К мышечной ткани относятся (типы):
▪ скелетная мускулатура (поперечно-полосатые относятся мышцы языка и верхней трети пищевода, внешние мышцы глазного яблока и некоторые другие);
▪ сердечная мышца;
▪ гладкая мускулатура.
Отличаются они друг от друга морфологически, биохимически, функционально, а так же в зависимости от путей развития.
Морфологически миокард относится к поперечно-полосатой мускулатуре, но по ряду других признаков он занимает промежуточное положение.
ХИМИЧЕСКИЙ СОСТАВ ПОПЕРЕЧНО-ПОЛОСАТОЙ МЫШЦЫ
В мышечной ткани взрослых животных и человека содержится от 72 до 80% воды. Около 20–28% от массы мышцы приходится на долю сухого остатка, главным образом белков. Помимо белков, в состав сухого остатка входят гликоген и другие углеводы, различные липиды и др.
Таблица 1. Химический состав поперечно-полосатой мышц млекопитающих
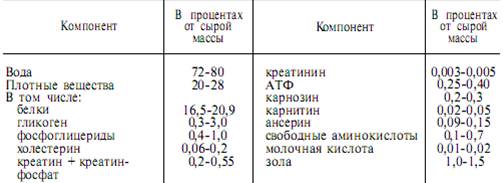
Данилевский впервые разделил экстрагируемые из мышц белки на 3 класса: растворимые в воде, экстрагируемые 8–12 % раствором хлорида аммония и белки, извлекаемые разбавленными растворами кислот и щелочей.
Около 25 % массы мышц составляют белки. В настоящее время их делят на три основные группы:▪ миофибриллярные (сократительные) белки (35% от общего количества мышечного белка); ▪ белки саркоплазмы (45%);▪ белки стромы (20%). Эти группы белков резко отличаются друг от друга по растворимости в воде и солевых средах с различной ионной силой.
Рис. 4. Строение толстого миозинового филамента.
Функции миозина:
▪ структурная — около 400 молекул миозина соединяются между собой «хвост» в «хвост» и образуют толстую нить;
▪ каталитическая — головка миозина способна расщеплять АТФ;
▪ контактная — соединяется с актином своими головками, которые в таком случае называются «поперечные мостики».
2. Актин - белок тонких нитей, составляющий 20% от сухой массы миофибрилл, был открыт Ф. Штраубом в 1942 г. Молекулярная масса — 42 кДа. Известны две формы актина: глобулярный актин (G-актин, globular) и фибриллярный актин (F-актин) в виде двойной спирали. Молекула G-актина состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 АМК остатка. При повышении ионной силы до физиологического уровня G-актин полимеризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой (рис. 5).
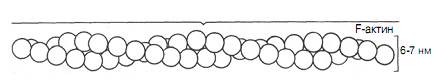
| Рис. 5. Схематическое изображение F-актина |
Актомиозин образуется при соединении миозина с F-актином. Актомиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФ-азной активностью, которая отличается от таковой миозина, она значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg 2+ и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФ-аза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны.
3. Тропомиозин (открыт К. Бейли в 1946 г.) - белок тонких нитей. Молекулярная масса—65 кДа. Состоит из двух α-спиралей в форме палочки. Располагается в бороздках, идущих вдоль обеих сторон актина. Каждая его молекула лежит на 7 молекулах актина. На долю тропомиозина приходится около 4–7% всех белков миофибрилл.
4. Тропонин – глобулярный белок тонких нитей, открытый С. Эбаси в 1963 г.; его мол.масса 80кДа. Состоит из 3 субъединиц: С-кальцийсвязывающий, обеспечивает связь с тропомиозином (Тн-С); I-ингибиторная (Тн-I), которая блокирует преждевременное соединение головок миозина с актином, может ингибировать АТФ-азную активность; Т-для связывания с тропомиозином (Тн-Т).
В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков
Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+ (рис. 6).
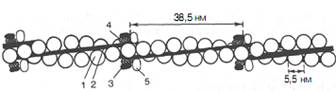
| Рис. 6. Структура тонкого филамента. 1 - актин; 2 - тропомиозин; 3 - тропонин С; 4 - тропонин I; 5 - тропонин Т. |
Установлено, что тропонин (его субъединицы Тн-Т и Тн-I) способен фосфорилироваться при участии цАМФ-зависимых протеинкиназ. Вопрос о том, имеет ли отношение фосфорилирование тропонина in vitro к регуляции мышечного сокращения, остается пока открытым.
5. α-актинин. Входит в Z-линию и фиксирует там тонкие нити. 6. β-актинин. Регулирует длину тонких нитей.7. М-белок. Входит в М-линию и фиксирует там толстые нити. 8. С-белок. Регулирует длину толстых нитей. 9. Десмин. Содержится между Z-линиями соседних миофибрилл, обеспечивая совпадение границ всех их саркомеров.
Белки саркоплазмы - протеины, растворимые в солевых средах с низкой ионной силой. Глобулин X представляет собой смесь различных белковых веществ со свойствами глобулинов. В состав белков группы миогена входит ряд протеинов, наделенных ферментативной активностью: например, ферменты гликолиза. Дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обмена. Парвальбумины (кальмодулин и кальсеквестрин и др.), которые способны связывать ионы Са2+.
Таким образом, к белкам саркоплазмы можно отнести: миоглобин, ферменты гликолиза, кальмодулин и кальсеквестрин, способные обратимо связываться с ионами Са2+.
Белки стромы. Это коллаген и эластин. Известно, что строма скелетных мышц, остающаяся после исчерпывающей экстракции мышечной кашицы солевыми растворами с высокой ионной силой, состоит в значительной мере из соединительнотканных элементов стенок сосудов и нервов, а также сарколеммы и некоторых других структур.
Наглядные пособия:
Рисунки: 1. Структура волокна скелетной мышцы (по Гассельбаху), 2. Строение саркомера скелетной мышцы, 3. Строение молекулы миозина, 4. Строение толстого миозинового филамента, 5. Схематическое изображение F-актина, 6. Структура тонкого филамента, 7. Перенос энергии из митохондрий в цитоплазму клетки миокарда (схема по В.А. Саксу и др.), 9. Схематическое изображение происхождения креатинурии при прогрессирующей мышечной дистрофии (по Д.Л. Фердману); Таблица 1. Химический состав поперечно-полосатой мышц млекопитающих
V Наименование лабораторной работы:
Лабораторная работа № 1.
Биохимия обмена веществ
Тема: МЫШЕЧНАЯ ТКАНЬ
I Научно-методическое обоснование темы:
Мышечная ткань взрослого человека составляет 40–42% (у пожилых людей – 30% , у детей – 35%) от массы тела. Основная динамическая функция мышц – обеспечить подвижность путем сокращения и последующего расслабления. При сокращении мышц осуществляется работа, связанная с превращением химической энергии в механическую.
К мышечной ткани относятся (типы):
▪ скелетная мускулатура (поперечно-полосатые относятся мышцы языка и верхней трети пищевода, внешние мышцы глазного яблока и некоторые другие);
▪ сердечная мышца;
▪ гладкая мускулатура.
Отличаются они друг от друга морфологически, биохимически, функционально, а так же в зависимости от путей развития.
Морфологически миокард относится к поперечно-полосатой мускулатуре, но по ряду других признаков он занимает промежуточное положение.
МОРФОЛОГИЧЕСКАЯ ОРГАНИЗАЦИЯ ПОПЕРЕЧНО-ПОЛОСАТОЙ МЫШЦЫ
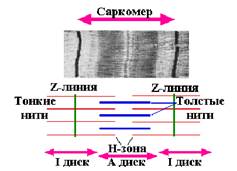
Поперечно-полосатая мышца состоит из многочисленных удлиненных волокон, миобластов (многоядерных клеток гигантских размеров), покрытых эластичной оболочкой - сарколеммой (рис. 1). Двигательные нервы входят в различных точках в мышечное волокно и передают ему электрический импульс, вызывающий сокращение. Диаметр функционально зрелого поперечно-полосатого мышечного волокна обычно составляет от 10 до 100 мкм, а длина волокна часто соответствует длине мышцы.
Миобласты состоят из миофибрилл, функциональной единицей которых является саркомер. Миофибриллы расположены по длине волокна в полужидкой саркоплазме (толщиной менее 1 мкм), обладающих поперечной исчерченностью (зависящая от оптической неоднородности белковых веществ).
Выделяют белые и красные (с высоким содержанием миофибрилл и миоглобина, обеспечивают более быстрые мышечные сокращения, тонического характера) мышечные волокна.
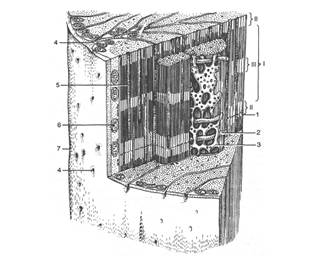
| Рис. 1. Структура волокна скелетной мышцы (по Гассельбаху). I - А-диск; II - I-диск; III - Н-зона; 1 - Z-линия; 2 - Т-система; 3 - саркоплазматическая сеть; 4 - устье Т-системы; 5 - гликоген; 6 - митохондрия; 7 - сарколемма |
В саркоплазме мышечных волокон обнаруживается и ряд других структур: митохондрии, микросомы, рибосомы, трубочки и цистерны саркоплазматической сети, различные вакуоли, глыбки гликогена и включения липидов, играющие роль запасных энергетических материалов, и т.д. (рис. 1).
При рассмотрении миофибриллы под электронным микроскопом видны два типа вытянутых нитей: темные и светлые полосы или диски (А и I диски).
Один тип — это толстая нить, соответствующая А диску (анизотропный диск). Центральная зона А диска (H зона) при этом кажется менее оптически плотной, чем остальная его часть. В центре диска А расположена линия М, которую можно наблюдать только в электронном микроскопе.
Второй тип — тонкая нить, расположена в I диске и проходит в А диск, не достигая Н зоны. Диск I (изотропный диск), с очень слабым двойным лучепреломлением. В фазово-контрастном микроскопе они кажутся более светлыми, чем диски А. Длина дисков I около 1 мкм. Каждый из них разделен на две равные половины Z-мембраной, или Z-линией.
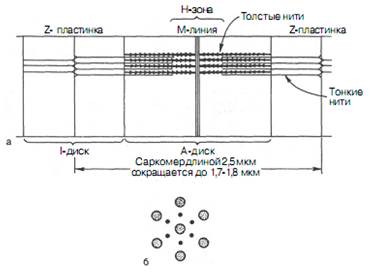
| Рис. 2. Строение саркомера скелетной мышцы.
а - схематическое изображение структуры саркомера; б - расположение толстых и тонких нитей (поперечное сечение).
|
Толстые нити состоят из белка миозина, и тонкие - как правило, из второго компонента актомиозиновой системы – белка актина. Тонкие (актиновые) нити начинаются в пределах каждого саркомера у Z-линии, тянутся через диск I, проникают в диск А и прерываются в области зоны Н (рис. 2).
Согласно модели, предложенной Э. Хаксли и Р. Нидергерке, а также X. Хаксли и Дж. Хенсон, при сокращении миофибрилл одна система нитей проникает в другую, т.е. нити начинают, как бы скользить друг по другу, что и является причиной мышечного сокращения.
Дата: 2019-02-25, просмотров: 325.