В термодинамике наряду с понятием равновесного состояния большую роль играет понятие обратимого процесса.
Обратимым процессом называется такой процесс, при котором возможен обратный переход системы из конечного состояния в начальное через те же промежуточные состояния, чтобы в окружающих телах не произошло никаких изменений. Обратимый процесс является физической абстракцией. Примером процесса, приближающегося к обратимому, является колебание тяжелого маятника на длинном подвесе. В этом случае кинетическая энергия практически полностью превращается в потенциальную, и наоборот. Колебания происходят долго без заметного уменьшения амплитуды ввиду малости сопротивления среды и сил трения.
Обратимым может быть только равновесный процесс.
Обратимый процесс, очевидно, обладает следующим свойством: если при прямом ходе на каком-то элементарном участке система получает тепло D Q1 и совершает работу D A1 , то при обратном ходе на том же участке система отдает тепло D Q2 = D Q1 и над ней совершается работа D A2 = D A1. По этой причине после протекания обратимого процесса в одном, а затем в обратном направлении и возвращения системы в первоначальное состояние в окружающих систему телах не должно оставаться никаких изменений.
Любой процесс, сопровождаемый трением или теплопередачей от нагретого тела к холодному, называется необратимым процессом. Примером необратимого процесса является расширение газа, даже идеального, в пустоту. Расширяясь, газ не преодолевает сопротивления среды, не совершает работы, но для того чтобы вновь собрать все молекулы газа в прежний объем, т. е. привести газ в начальное состояние, необходимо затратить работу. Таким образом, все реальные процессы являются необратимыми.
Круговым процессом (или циклом) называется такой процесс, при котором система после ряда изменений возвращается в исходное состояние. На графике цикл изображается замкнутой кривой (см. рис.). Работа, совершаемая при круговом процессе, численно равна площади, охватываемой кривой. В самом деле, работа на участке 1–2 положительна и численно равна площади, отмеченной наклоненной вправо штриховкой (рассматривается цикл, совершаемый по часовой стрелке). Работа на участке 2–1 отрицательна и численно равна площади, отмеченной наклоненной влево штриховкой. Следовательно, работа за цикл численно равна площади, охватываемой кривой, и будет положительна при прямом цикле (т. е. таком, который совершается в направлении по часовой стрелке) и отрицательна при обратном.
 После совершения цикла система возвращается в прежнее состояние. Поэтому всякая функция состояния, в частности внутренняя энергия, имеет в начале и в конце цикла одинаковое значение.
После совершения цикла система возвращается в прежнее состояние. Поэтому всякая функция состояния, в частности внутренняя энергия, имеет в начале и в конце цикла одинаковое значение.
 Всякий двигатель представляет собой систему, совершающую многократно некий круговой процесс (цикл). Пусть в ходе цикла рабочее вещество (например, газ) сначала расширяется до объема V2, а затем снова сжимается до первоначального объема V1. Чтобы работа за цикл была больше нуля, давление (а, следовательно, и температура) в процессе расширения должно быть больше, чем при сжатии. Для этого рабочему веществу нужно в ходе расширения сообщать тепло, а в ходе сжатия отнимать от него тепло.
Всякий двигатель представляет собой систему, совершающую многократно некий круговой процесс (цикл). Пусть в ходе цикла рабочее вещество (например, газ) сначала расширяется до объема V2, а затем снова сжимается до первоначального объема V1. Чтобы работа за цикл была больше нуля, давление (а, следовательно, и температура) в процессе расширения должно быть больше, чем при сжатии. Для этого рабочему веществу нужно в ходе расширения сообщать тепло, а в ходе сжатия отнимать от него тепло.
Напишем уравнение первого начала термодинамики для обеих частей цикла. При расширении внутренняя энергия изменяется от значения U1 до U2, причем система получает тепло Q1 и совершает работу А1. Согласно первому началу
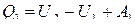 .
.
При сжатии система совершает работу А2 и отдает тепло Q2. что равнозначно получению тепла –Q2. Следовательно,
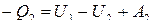 .
.
Складывая последние два уравнения, получаем:
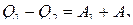 .
.
Замечая, что А1 + А2 есть полная работа А, совершаемая системой за цикл, можно написать:
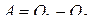 .
.
Периодически действующий двигатель, совершающий работу за счет получаемого извне тепла, называется тепловой машиной.
Из последней формулы следует, что не все получаемое извне тепло Q1 используется для получения полезной работы. Для того чтобы двигатель работал циклами, часть тепла, равная Q2, должна быть возвращена во внешнюю среду и, следовательно, не используется по назначению (т. е. для совершения полезной работы). Очевидно, что чем полнее превращает тепловая машина получаемое извне тепло Q1 в полезную работу А, тем эта машина выгоднее. Поэтому тепловую машину принято характеризовать коэффициентом полезного действия h (сокращенно КПД), который определяется как отношение совершаемой за цикл работы А к получаемому за цикл теплу Q1:
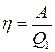 .
.
 Поскольку согласно
Поскольку согласно 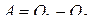 , выражение для КПД можно записать в виде
, выражение для КПД можно записать в виде
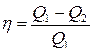 .
.
Цикл Карно.
Наиболее простым по содержанию, но важным в принципиальном отношении, является цикл Карно. Он состоит из двух изотерм при температурах Т1 и Т2 между состояниями 1, 2 и 3, 4 и двух адиабат между состояниями 2, 3 и 4, 1. Направление цикла указано стрелками. При выполнении цикла Карно необходимы два термостата. Термостат с более высокой температурой T1 называется нагревателем, а с более низкой температурой Т2 – холодильником. При прохождении адиабатических участков цикла система должна быть изолирована от окружающей среды в тепловом отношении, т. е. не должна обмениваться теплом с окружающей средой.
КПД цикла Карно равен
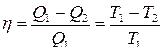 .
.
КПД определяется лишь температурами нагревателя и холодильника и не зависит от рода рабочего вещества.
Из последнего уравнения следуют выводы:
1. Для повышения КПД тепловой машины нужно увеличивать температуру нагревателя и уменьшать температуру холодильника.
2. КПД тепловой машины всегда меньше 1.
Второе начало термодинамики
Первое начало термодинамики устанавливает количественное соотношение между количеством теплоты, работой и изменением внутренней энергии тела, но оно не определяет направления течения процессов. С точки зрения первого начала термодинамики, одинаково возможен переход энергии в форме теплоты как от более нагретого к менее нагретому телу, так и наоборот.
Второе начало термодинамики определяет направление процессов, происходящих в природе и связанных с превращением энергии.
Превращение теплоты в работу возможно только при наличии нагревателя и холодильника; во всех тепловых машинах полезно используется только часть энергии, передаваемая от нагревателя к холодильнику.
Иначе говоря, ни один тепловой двигатель, включая двигатель внутреннего сгорания, не может дать КПД, равный единице. Существует несколько формулировок второго начала термодинамики:
1. «Коэффициент полезного действия идеальной тепловой машины определяется только температурами теплоотдатчика и теплоприемника» (С. Карно).
2. «В природе невозможен процесс, единственным результатом которого был бы переход теплоты полностью в работу» (М.Планк).
3. «Теплота не может сама собой переходить от тела с более низкой температурой к телу с более высокой температурой» (Р. Клаузиус).
Второе начало отрицает возможность использования запасов внутренней энергии какого-либо источника без перевода ее на более низкий температурный уровень, т. е. без холодильника. Например, практически неограниченные запасы внутренней энергии океанов не могут быть полностью использованы, поскольку, как только температура океана станет ниже температуры окружающей среды, произойдет процесс, в котором должен осуществляться переход теплоты от более холодного к более горячему телу, а такой процесс самопроизвольно протекать не может. Таким образом, второе начало термодинамики утверждает невозможность построения вечного двигателя второго рода, т. е. двигателя, работающего за счет охлаждения какого-либо одного тела.
Вопросы для самоконтроля:
1. Каким методом исследования свойств макроскопических систем пользуется термодинамика?
2. Что называют термодинамической системой?
3. Что называют термодинамическим процессом?
4. Дайте определение внутренней энергии системы.
5. От чего зависит внутренняя энергия идеального газа?
6. Какие формы передачи энергии вам известны?
7. Какова разница между теплоемкостью тела и удельной теплоемкостью?
8. Сформулируйте первое начало термодинамики.
9. Дайте определение адиабатного процесса.
10. Дайте определение обратимого и необратимого процессов.
11. От чего зависит КПД тепловой машины?
12. Сформулируйте второе начало термодинамики.
13. Приведите примеры известных вам тепловых двигателей.
Лекция № 10. Свойства паров
Цель: объяснить явления испарения, конденсации, кипения и выяснить условия, от которых зависят эти процессы; ввести понятие «насыщенный пар»; объяснить понятие «влажность воздуха», показать практическое применение и важность данной физической величины.
Основные понятия:
Парообразование – явление перехода вещества в пар называется.
Испарение и кипение – формы парообразования.
Конденсация – явление перехода пара в жидкое состояние.
Динамическое равновесие пара и жидкости – состояние, при котором за одно и то же время испаряется и конденсируется одинаковое число молекул пара.
Насыщенный пар – пар, находящийся в динамическом равновесии с жидкостью.
Абсолютная и относительная влажность воздуха – физические величины, показывающие количество водяных паров в воздухе.
Точка росы – это температура, при которой пар, находящийся в воздухе, становится насыщенным.
Испарение.
Молекулы газов и жидкостей хотя и малы по размерам, но имеют конечные размеры и определенную форму и между ними существуют довольно значительные силы взаимодействия. В этом состоит главное отличие реальных газов и жидкостей от идеальных, как упрощенной модели реальных объектов.
При изучении идеальных газов отмечалось, что многие его свойства не зависят от природы газа. Однако чем ниже температура и больше давление, тем заметнее зависимость свойств газа от его природы. Газ в таких условиях называют паром, тем самым указывая, что он образовался из определенной жидкости.
Явление перехода вещества в пар называется парообразованием. В природе парообразование происходит в виде испарения и кипения.
Парообразование с открытой поверхности жидкости называется испарением.
Испаряются не только жидкости, но и твердые тела. Испарение твердых тел называется сублимацией.
Рассмотрим процесс испарения жидкостей. Так же как диффузия, испарение происходит вследствие непрерывного хаотического движения молекул жидкости. Всякая молекула, движущаяся из глубины жидкости к ее поверхности, испытывает в поверхностном слое действие силы, препятствующей вырыванию молекулы с поверхности жидкости. Чтобы пройти сквозь поверхностный слой, молекула должна обладать достаточной кинетической энергией для совершения работы выхода с поверхности жидкости. Скорости молекул жидкости, как и молекул газа, различны. Жидкость покидают наиболее «быстрые» молекулы, вследствие чего средняя кинетическая энергия оставшихся молекул уменьшается, что ведет к понижению температуры жидкости. Для поддержания постоянной температуры жидкости ей необходимо сообщать энергию извне, например, в виде теплоты. Количество теплоты Q, необходимое для превращения в пар 1 кг жидкости при постоянной температуре, называется удельной теплотой парообразования:
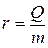 .
.
В СИ удельная теплота парообразования выражается в джоулях на килограмм (Дж/кг).
После того как молекула жидкости переместилась от границы поверхностного слоя на расстояние, большее радиуса действия молекулярных сил жидкости, она становится молекулой пара. Молекулярные силы действуют на сравнительно коротких расстояниях (порядка 10 нм).
Конденсация.
В результате хаотического движения над поверхностью жидкости молекула пара, попадая в сферу действия молекулярных сил, вновь возвращается в жидкость. Этот процесс называют конденсацией. При конденсации пара некоторой массы выделяется столько энергии, сколько затрачивается при испарении жидкости такой же массы. Испарение жидкости происходит при любой температуре и тем быстрее, чем выше температура, больше площадь свободной поверхности испаряющейся жидкости и быстрее удаляются образовавшиеся над жидкостью пары.
Если жидкость находится в открытом сосуде, то молекул испаряется больше, чем конденсируется, и масса жидкости уменьшается.
Следует обратить внимание, что процесс парообразования связан с увеличением внутренней энергии вещества, а процесс конденсации – с уменьшением ее.
Следовательно, конденсация и парообразование происходят только в процессе обмена энергией между окружающей средой и веществом.
Дата: 2019-02-25, просмотров: 364.