В рассмотренных выше процессах получения диоксида урана технологические схемы состоят из двух основных операций – прокаливания соединений урана до высших оксидов и восстановления полученного триоксида или закиси-окиси водородом. В тех случаях, когда в составе соединений урана, выделяемых из водных растворов, присутствуют компоненты, обладающие восстановительными свойствами, можно получить диоксид урана в одну стадию. Такими соединениями урана служат полиуранаты аммония, оксалат уранила и аммонийуранилтрикарбонат. Оксалат уранила при разложении выделяет оксид углерода, а полиуранаты аммония и аммонийуранилтрикарбонат разлагаются с отщеплением аммиака; оба эти восстановителя переводят образующийся триоксид урана в диоксид.
Полиуранаты аммония
При термическом разложении диуранатов аммония без доступа воздуха получается диоксид урана. Восстановление в данном случае осуществляется за счет аммиака, выделяющегося при разложении соли. Процесс проходит по схеме:
(NH4)2UnО3n+1 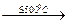 nUO3 + 2NH3 + Н2O;
nUO3 + 2NH3 + Н2O;
2UO3 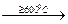
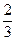 U3O8 +
U3O8 + 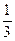 О2;
О2;
2NН3  N2 + 3H2;
N2 + 3H2;
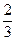 U3O8 +
U3O8 + 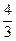 H2
H2  2UO2 +
2UO2 + 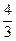 Н2O
Н2O
___________________________________________________________________________________
(NH4)2UnО3n+1  2UO2 + N2 +
2UO2 + N2 + 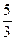 H2 +
H2 + 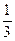 О2 +
О2 + 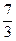 Н2O. (1.2.27)
Н2O. (1.2.27)
При этом для восстановления используется 33,3 % аммиака.
Исходные полиуранаты аммония сначала подсушивают при 100 °С. При этой температуре термической диссоциации полиуранатов еще не наблюдается и потери аммиака не происходит. После сушки продукт измельчают и загружают в печь для прокаливания. При температурах ниже 450 °С восстановление почти не происходит из-за незначительной диссоциации аммиака. При более высоких температурах аммиак разлагается в значительной степени, и процесс восстановления интенсифицируется. Для осуществления совмещенного процесса прокаливания и восстановления необходима циркуляция газов в печи с удалением из них влаги.
Решающее влияние на степень восстановления урана в таком процессе оказывает температура, причем резкий перелом наблюдается в интервале 650-700 °С; дальнейшее повышение температуры сравнительно мало сказывается на степени превращения (табл. 1.2.12).
Длительность процесса прокаливания диураната аммония также оказывает влияние на степень восстановления урана (табл. 1.2.13).
Уранилоксалат
При обработке растворов уранилнитрата щавелевой кислотой образуется осадок уранилоксалата, гидратированный тремя молекулами воды:
UО2(NО3)2 + H2C2О4 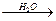 UО2C2О4·3H2О + 2HNО3. (1.2.28)
UО2C2О4·3H2О + 2HNО3. (1.2.28)
Таблица 1.2.12
Влияние температуры прокаливания полиуранатов аммония на мольное
соотношение О : U в оксиде урана *
| Температура прокаливания, °С | Мольное соотношение О : U в оксиде урана |
| 800 700 650 | UO2,059 UO2,076 UO2,516 |
* Длительность прокаливания во всех случаях 1,5 ч; увеличение длительности не приводило к увеличению степени восстановления урана.
Таблица 1.2.13
Изменение степени восстановления урана во времени при прокаливании
полиуранатов аммония без доступа воздуха при температуре 700° С
| Длительность прокаливания, мин | Состав оксида урана |
| 15 30 45 60 90 | UO2,352 UO2,200 UO2,101 UO2,086 UO2,076 |
Термическое разложение этой соли в атмосфере воздуха при температуре выше 500 °С приводит к образованию закиси-окиси урана. Диоксид урана может быть получен при прокаливании без доступа воздуха. Разложение уранилоксалата в этом случае описывается уравнениями:
UО2C2О4 → UO3 + СО + СO2, (1.2.29)
UO3 + CO → UО2 + СO2. (1.2.30)
Из приведенных реакций следует, что восстановитель получается только в стехиометрических количествах. При проведении процесса разложения тригидрата уранилоксалата в атмосфере аргона в интервале 400-900 °С состав газовой фазы изменяется следующим образом: СО2 от 52,0 до 57,2 %; СО от 10,5 до 4,8 % (оставшееся количество составляют аргон и влага). Эти данные свидетельствуют о том, что скорость разложения уранилоксалата выше скорости восстановления триоксида оксидом углерода. Следовательно, получить диоксид урана из уранилоксалата в статических условиях невозможно. Для получения диоксида урана необходим непрерывный процесс, причем в аппарате должно быть две температурные зоны: зона разложения и зона восстановления. Продолжительность процесса тем меньше, чем выше температура в зоне восстановления.
При разложении уранилоксалата без доступа воздуха наблюдаются следующие термические эффекты:
а) при температуре до 270 °С удаляется кристаллизационная влага (сначала две молекулы при 120 °С, а затем третья);
б) в интервале 310-340 °С уран восстанавливается до диоксида (в продуктах обнаруживается оксид урана состава UО2,25);
в) при 500-550 °С в продуктах разложения присутствуют обычный диоксид урана и оксид состава UО2,25;
г) в интервале 620-900 °С в твердом продукте обнаруживается лишь диоксид урана, образовавшийся из фазы состава UО2,25 вследствие восстановления.
Образующийся в результате термического разложения уранилоксалата диоксид обладает высокой реакционной способностью; при обычных условиях он пирофорен, поэтому необходимы специальные меры по его защите от атмосферного кислорода. Это достигается совмещением процессов прокаливания, восстановления и гидрофторирования. Непосредственно после прокаливания диоксид урана обрабатывают фтороводородом; при этом происходит образование тетрафторида урана.
Аммонийуранилтрикарбонат
Кристаллы аммонийуранилтрикарбоната выделяют из растворов у содержащих избыток карбоната или бикарбоната аммония. Кристаллизационной воды они не содержат. Термическое разложение аммонийуранилтрикарбоната на воздухе при температуре выше 500 °С сопровождается образованием закиси-окиси урана:
3(NH4)4[UO2(СО3)3] → U3O8 + 10NН3 + 9СO2 +N2+ 7Н2O + 2Н2. (1.2.31)
Как видно из уравнения реакции, в ходе процесса выделяется значительное количество аммиака, углекислоты, воды, водорода и азота.
Кристаллы аммонийуранилтрикарбоната при нагревании без доступа воздуха начинают разлагаться при 170 °C. Полное разложение соли до триоксида урана происходит в интервале 240-350 °C. При этом образуется аморфный триоксид урана:
(NН4)4[UO2(СО3)3] → UО3 + 3СO2 + 4NH3 + 2Н2O. (1.2.32)
Повышение температуры приводит сначала к перекристаллизации триоксида, а затем к образованию закиси-окиси урана. Начиная с 620 °С появляется диоксид урана. Восстановление до диоксида происходит за счет водорода, выделяющегося при разложении аммиака. При разложении соли без доступа воздуха образуется четыре моля аммиака на один моль триоксида урана. Получающийся избыток водорода приводит к образованию водяного газа.
Разложение аммонийуранилтрикарбоната без доступа воздуха, приводящее к получению диоксида, выражается следующей реакцией:
(NН4)4[UO2(СО3)3] → UО2 + 2NH3 + 3CO2 + 2H2 + N2 + 3H2O. (1.2.33)
Состав газовой фазы зависит от температуры процесса.
В заключение в табл. 1.2.14 приведены данные Уранового института в Лондоне о производстве урана в разных странах в конце ХХ века.
Таблица 1.2.14
Производство природного урана в мире, т U3O8/год
| Страна | 1996 г. | 1997 г. | 1998 г. |
| Аргентина | 28 | 35 | 35 |
| Австралия | 4974 | 5520 | 4885 |
| Бельгия | 28 | 27 | 27 |
| Канада | 11788 | 12029 | 10924 |
| Китай* | 500 | 500 | 500 |
| Чехия | 598 | 590 | 590 |
| Франция | 940 | 748 | 508 |
| Габон | 560 | 472 | 731 |
| Германия | 40 | 40 | 40 |
| Венгрия | 200 | 200 | 0 |
| Индия* | 200 | 200 | 200 |
| Казахстан | 1320 | 1000 | 1250 |
| Намибия | 2452 | 2905 | 2762 |
| Нигер | 3160 | 3497 | 3731 |
| Пакистан* | 23 | 23 | 23 |
| Португалия | 15 | 17 | 17 |
| Румыния* | 100 | 100 | 100 |
| Россия* | 2000 | 2000 | 2000 |
| ЮАР | 1436 | 1100 | 962 |
| Испания | 255 | 255 | 255 |
| Украина* | 500 | 500 | 500 |
| США | 2420 | 2170 | 1872 |
| Узбекистан | 1459 | 1764 | 2000 |
| ВСЕГО | 34996 | 35692 | 33912 |
* Данные по этим странам, представляют собой оценку Уранового института. Ежегодная мировая потребность в уране составляет 62 тыс. тонн U3O8.
Дата: 2019-02-25, просмотров: 300.