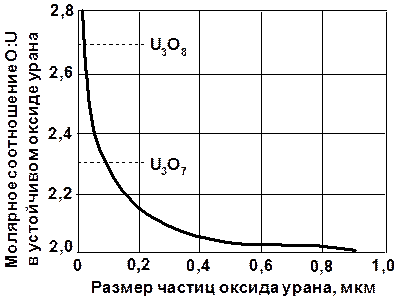Общие сведения
Оксиды урана – диоксид, закись-окись и триоксид – представляют важнейшие в технологическом отношении соединения урана. Диоксид применяется для изготовления тепловыделяющих элементов (ТВЭЛов) ядерных реакторов.
Огнеупорность диоксида урана, устойчивость к действию радиационного излучения и относительная инертность являются главными факторами, обусловливающими его применение как ядерного горючего. Применение обогащенного изотопом 235U диоксида в виде зерен в металлической или керамической матрицах позволяет создавать ТВЭЛы, способные работать при высоких температурах в реакторах с большим удельным теплосъемом. Основным недостатком диоксида урана является низкая теплопроводность, которая ограничивает величину изделий.
Диоксид урана имеет важное значение как промежуточный продукт при производстве тетрафторида и далее гексафторида урана. Достоинство диоксида урана в данном случае перед другими оксидами заключается в том, что в этом соединении уран четырехвалентен, как в тетрафториде, в связи с чем не требуется дополнительных операций по его восстановлению. Диоксид урана совместно с закисью-окисью может использоваться в качестве исходного продукта в производстве металлического урана. Шихту в этом случае готовят из оксидов урана, металлического кальция и флюсующих добавок (например, хлорида кальция). После восстановления порошкообразный уран отмывают от примесей, прессуют и обжигают при высоких температурах до компактного металла или переплавляют.
Технологическое значение других оксидов урана – закиси-окиси и триоксида – несколько меньше. Эти соединения не применяются в качестве ядерного горючего, но служат промежуточными продуктами в производстве диоксида, тетрафторида, гексафторида и металлического урана. Кроме того, благодаря высокой стабильности при обычных условиях закись-окись и триоксид урана могут использоваться для хранения.
К оксидам урана в соответствии с указанными областями их применения предъявляют определенные требования, связанные прежде всего с их чистотой. При самостоятельном использовании диоксида урана в ядерных реакторах содержание примесей в ней должно соответствовать требованиям ядерной чистоты (ASTM стандарт). Требования к обогащенному диоксиду урана приведены в табл. 1.2.1.
Если оксиды используются для производства тетрафторида или других соединений урана, требования по чистоте могут быть несколько иными. В частности, содержание примесей определяется методом получения тетрафторида; так, при получении тетрафторида урана из водных растворов достигается хорошая очистка от примесей, в то время как при сухом процессе возможно даже загрязнение урана продуктами коррозии. Поэтому в зависимости от принятого метода получения тетрафторида оксиды урана могут содержать большее или меньшее количество примесей.
Таблица 1.2.1
Таблица 1.2.3
Свойства триоксида урана различного происхождения
| Свойства | ||||
Термическая диссоциация
Например, наиболее крупные кристаллы триоксида получаютя при разложении уранилнитрата, наиболее мелкие – при термической диссоциации пероксида урана. В то же время размер агрегатов триоксида урана, получающегося из уранилнитрата, меньше, чем полученного из пероксида урана.
От физических свойств триокида урана зависят как скорость и эффективность последующего процесса его восстановления, так и в значительной мере физические свойства образующегося при этом диоксида. Триоксид, полученный из полиуранатов аммония, восстанавливается водородом быстрее, чем изготовленный из уранилнитрата. Это вызвано, по-видимому, различием в условиях фазового контакта твердого вещества и газа.
Влияние состава исходной соли, а также температуры восстановления триоксида урана водородом на физические свойства диоксида урана характеризуется данными, приведенными в табл. 1.2.4.
Таблица 1.2.4
Влияние состава исходной соли и температуры восстановления на свойства диоксида урана
| Соль, из которой получен | Размер частиц триоксида, мкм |
Свойства диоксида | |||
| восстановление при 700 °С | восстановление при 850 °С | ||||
| диаметр частиц, мкм | удельная поверх-ность, м2/г | диаметр частиц, мкм | удельная поверх-ность, м2/г | ||
| Диуранат аммония Уранилнитрат Аммонийуранилтрикарбонат | 0,08 0,59 0,43 | 0,032 0,330 0,320 | 17,40 1,82 1,90 | 0,086 1,52 0,39 | 6,40 0,39 1,60 |
В общем случае, чем более крупнокристаллической является триоксид урана, тем больше размер кристаллов получаемого из него диоксида; повышение температуры восстановления обычно приводит к увеличению размера частиц и к уменьшению удельной поверхности порошка.
|
Рис. 1.2.1 Влияние размера частиц на соотношение кислорода и урана в устойчивых оксидах урана (при 25 °С, в воздушной среде) |
Скорость гидрофторирования диоксида урана фтороводородом зависит прежде всего от его реакционной способности, от размера кристаллов и агрегатов. Диоксид урана, полученный из диураната аммония, состоит из больших агрегатов сравнительно мелких частиц и обладает высокой удельной поверхностью. В связи с этим скорость гидрофторирования подобных образцов довольно значительна даже при низкой температуре; повышение температуры приводит к закупориванию пор агрегатов в результате спекания образовавшегося тетрафторида урана.
Диоксид урана, полученный из уранилнитрата, менее склонен к образованию агрегатов, но размер кристаллов его довольно велик; поэтому реакционная способность диоксида урана, приготовленного из уранилнитрата, ниже.
Примерно такие же закономерности характерны и для процесса окисления диоксида урана кислородом воздуха. Диоксид с размером частиц порядка сотых долей микрона и ниже пирофорен уже при 0 °С; интенсивное окисление диоксида урана с размером частиц 0,4 мкм протекает при 150 °С. При обычной температуре окисление диоксида, как правило, не приводит к образованию стехиометрических соединений закиси-окиси или триокида урана; состав полученных продуктов сильно меняется, причем степень этого изменения и степень окисления диоксида урана всецело определяются размером частиц (рис. 1.2.1).
Для любой другой температуры эти кривые сдвигаются в область более высоких соотношений кислорода и урана.
Полиуранаты аммония
При термическом разложении диуранатов аммония без доступа воздуха получается диоксид урана. Восстановление в данном случае осуществляется за счет аммиака, выделяющегося при разложении соли. Процесс проходит по схеме:
(NH4)2UnО3n+1 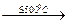 nUO3 + 2NH3 + Н2O;
nUO3 + 2NH3 + Н2O;
2UO3 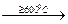
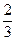 U3O8 +
U3O8 + 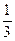 О2;
О2;
2NН3  N2 + 3H2;
N2 + 3H2;
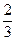 U3O8 +
U3O8 + 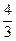 H2
H2  2UO2 +
2UO2 + 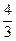 Н2O
Н2O
___________________________________________________________________________________
(NH4)2UnО3n+1  2UO2 + N2 +
2UO2 + N2 + 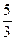 H2 +
H2 + 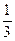 О2 +
О2 + 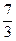 Н2O. (1.2.27)
Н2O. (1.2.27)
При этом для восстановления используется 33,3 % аммиака.
Исходные полиуранаты аммония сначала подсушивают при 100 °С. При этой температуре термической диссоциации полиуранатов еще не наблюдается и потери аммиака не происходит. После сушки продукт измельчают и загружают в печь для прокаливания. При температурах ниже 450 °С восстановление почти не происходит из-за незначительной диссоциации аммиака. При более высоких температурах аммиак разлагается в значительной степени, и процесс восстановления интенсифицируется. Для осуществления совмещенного процесса прокаливания и восстановления необходима циркуляция газов в печи с удалением из них влаги.
Решающее влияние на степень восстановления урана в таком процессе оказывает температура, причем резкий перелом наблюдается в интервале 650-700 °С; дальнейшее повышение температуры сравнительно мало сказывается на степени превращения (табл. 1.2.12).
Длительность процесса прокаливания диураната аммония также оказывает влияние на степень восстановления урана (табл. 1.2.13).
Уранилоксалат
При обработке растворов уранилнитрата щавелевой кислотой образуется осадок уранилоксалата, гидратированный тремя молекулами воды:
UО2(NО3)2 + H2C2О4 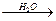 UО2C2О4·3H2О + 2HNО3. (1.2.28)
UО2C2О4·3H2О + 2HNО3. (1.2.28)
Таблица 1.2.12
Влияние температуры прокаливания полиуранатов аммония на мольное
соотношение О : U в оксиде урана *
| Температура прокаливания, °С | Мольное соотношение О : U в оксиде урана |
| 800 700 650 | UO2,059 UO2,076 UO2,516 |
* Длительность прокаливания во всех случаях 1,5 ч; увеличение длительности не приводило к увеличению степени восстановления урана.
Таблица 1.2.13
Изменение степени восстановления урана во времени при прокаливании
полиуранатов аммония без доступа воздуха при температуре 700° С
| Длительность прокаливания, мин | Состав оксида урана |
| 15 30 45 60 90 | UO2,352 UO2,200 UO2,101 UO2,086 UO2,076 |
Термическое разложение этой соли в атмосфере воздуха при температуре выше 500 °С приводит к образованию закиси-окиси урана. Диоксид урана может быть получен при прокаливании без доступа воздуха. Разложение уранилоксалата в этом случае описывается уравнениями:
UО2C2О4 → UO3 + СО + СO2, (1.2.29)
UO3 + CO → UО2 + СO2. (1.2.30)
Из приведенных реакций следует, что восстановитель получается только в стехиометрических количествах. При проведении процесса разложения тригидрата уранилоксалата в атмосфере аргона в интервале 400-900 °С состав газовой фазы изменяется следующим образом: СО2 от 52,0 до 57,2 %; СО от 10,5 до 4,8 % (оставшееся количество составляют аргон и влага). Эти данные свидетельствуют о том, что скорость разложения уранилоксалата выше скорости восстановления триоксида оксидом углерода. Следовательно, получить диоксид урана из уранилоксалата в статических условиях невозможно. Для получения диоксида урана необходим непрерывный процесс, причем в аппарате должно быть две температурные зоны: зона разложения и зона восстановления. Продолжительность процесса тем меньше, чем выше температура в зоне восстановления.
При разложении уранилоксалата без доступа воздуха наблюдаются следующие термические эффекты:
а) при температуре до 270 °С удаляется кристаллизационная влага (сначала две молекулы при 120 °С, а затем третья);
б) в интервале 310-340 °С уран восстанавливается до диоксида (в продуктах обнаруживается оксид урана состава UО2,25);
в) при 500-550 °С в продуктах разложения присутствуют обычный диоксид урана и оксид состава UО2,25;
г) в интервале 620-900 °С в твердом продукте обнаруживается лишь диоксид урана, образовавшийся из фазы состава UО2,25 вследствие восстановления.
Образующийся в результате термического разложения уранилоксалата диоксид обладает высокой реакционной способностью; при обычных условиях он пирофорен, поэтому необходимы специальные меры по его защите от атмосферного кислорода. Это достигается совмещением процессов прокаливания, восстановления и гидрофторирования. Непосредственно после прокаливания диоксид урана обрабатывают фтороводородом; при этом происходит образование тетрафторида урана.
Аммонийуранилтрикарбонат
Кристаллы аммонийуранилтрикарбоната выделяют из растворов у содержащих избыток карбоната или бикарбоната аммония. Кристаллизационной воды они не содержат. Термическое разложение аммонийуранилтрикарбоната на воздухе при температуре выше 500 °С сопровождается образованием закиси-окиси урана:
3(NH4)4[UO2(СО3)3] → U3O8 + 10NН3 + 9СO2 +N2+ 7Н2O + 2Н2. (1.2.31)
Как видно из уравнения реакции, в ходе процесса выделяется значительное количество аммиака, углекислоты, воды, водорода и азота.
Кристаллы аммонийуранилтрикарбоната при нагревании без доступа воздуха начинают разлагаться при 170 °C. Полное разложение соли до триоксида урана происходит в интервале 240-350 °C. При этом образуется аморфный триоксид урана:
(NН4)4[UO2(СО3)3] → UО3 + 3СO2 + 4NH3 + 2Н2O. (1.2.32)
Повышение температуры приводит сначала к перекристаллизации триоксида, а затем к образованию закиси-окиси урана. Начиная с 620 °С появляется диоксид урана. Восстановление до диоксида происходит за счет водорода, выделяющегося при разложении аммиака. При разложении соли без доступа воздуха образуется четыре моля аммиака на один моль триоксида урана. Получающийся избыток водорода приводит к образованию водяного газа.
Разложение аммонийуранилтрикарбоната без доступа воздуха, приводящее к получению диоксида, выражается следующей реакцией:
(NН4)4[UO2(СО3)3] → UО2 + 2NH3 + 3CO2 + 2H2 + N2 + 3H2O. (1.2.33)
Состав газовой фазы зависит от температуры процесса.
В заключение в табл. 1.2.14 приведены данные Уранового института в Лондоне о производстве урана в разных странах в конце ХХ века.
Таблица 1.2.14
Производство природного урана в мире, т U3O8/год
| Страна | 1996 г. | 1997 г. | 1998 г. |
| Аргентина | 28 | 35 | 35 |
| Австралия | 4974 | 5520 | 4885 |
| Бельгия | 28 | 27 | 27 |
| Канада | 11788 | 12029 | 10924 |
| Китай* | 500 | 500 | 500 |
| Чехия | 598 | 590 | 590 |
| Франция | 940 | 748 | 508 |
| Габон | 560 | 472 | 731 |
| Германия | 40 | 40 | 40 |
| Венгрия | 200 | 200 | 0 |
| Индия* | 200 | 200 | 200 |
| Казахстан | 1320 | 1000 | 1250 |
| Намибия | 2452 | 2905 | 2762 |
| Нигер | 3160 | 3497 | 3731 |
| Пакистан* | 23 | 23 | 23 |
| Португалия | 15 | 17 | 17 |
| Румыния* | 100 | 100 | 100 |
| Россия* | 2000 | 2000 | 2000 |
| ЮАР | 1436 | 1100 | 962 |
| Испания | 255 | 255 | 255 |
| Украина* | 500 | 500 | 500 |
| США | 2420 | 2170 | 1872 |
| Узбекистан | 1459 | 1764 | 2000 |
| ВСЕГО | 34996 | 35692 | 33912 |
* Данные по этим странам, представляют собой оценку Уранового института. Ежегодная мировая потребность в уране составляет 62 тыс. тонн U3O8.
Общие сведения
Оксиды урана – диоксид, закись-окись и триоксид – представляют важнейшие в технологическом отношении соединения урана. Диоксид применяется для изготовления тепловыделяющих элементов (ТВЭЛов) ядерных реакторов.
Огнеупорность диоксида урана, устойчивость к действию радиационного излучения и относительная инертность являются главными факторами, обусловливающими его применение как ядерного горючего. Применение обогащенного изотопом 235U диоксида в виде зерен в металлической или керамической матрицах позволяет создавать ТВЭЛы, способные работать при высоких температурах в реакторах с большим удельным теплосъемом. Основным недостатком диоксида урана является низкая теплопроводность, которая ограничивает величину изделий.
Диоксид урана имеет важное значение как промежуточный продукт при производстве тетрафторида и далее гексафторида урана. Достоинство диоксида урана в данном случае перед другими оксидами заключается в том, что в этом соединении уран четырехвалентен, как в тетрафториде, в связи с чем не требуется дополнительных операций по его восстановлению. Диоксид урана совместно с закисью-окисью может использоваться в качестве исходного продукта в производстве металлического урана. Шихту в этом случае готовят из оксидов урана, металлического кальция и флюсующих добавок (например, хлорида кальция). После восстановления порошкообразный уран отмывают от примесей, прессуют и обжигают при высоких температурах до компактного металла или переплавляют.
Технологическое значение других оксидов урана – закиси-окиси и триоксида – несколько меньше. Эти соединения не применяются в качестве ядерного горючего, но служат промежуточными продуктами в производстве диоксида, тетрафторида, гексафторида и металлического урана. Кроме того, благодаря высокой стабильности при обычных условиях закись-окись и триоксид урана могут использоваться для хранения.
К оксидам урана в соответствии с указанными областями их применения предъявляют определенные требования, связанные прежде всего с их чистотой. При самостоятельном использовании диоксида урана в ядерных реакторах содержание примесей в ней должно соответствовать требованиям ядерной чистоты (ASTM стандарт). Требования к обогащенному диоксиду урана приведены в табл. 1.2.1.
Если оксиды используются для производства тетрафторида или других соединений урана, требования по чистоте могут быть несколько иными. В частности, содержание примесей определяется методом получения тетрафторида; так, при получении тетрафторида урана из водных растворов достигается хорошая очистка от примесей, в то время как при сухом процессе возможно даже загрязнение урана продуктами коррозии. Поэтому в зависимости от принятого метода получения тетрафторида оксиды урана могут содержать большее или меньшее количество примесей.
Таблица 1.2.1
Характеристика диоксида урана ядерной чистоты
| Примесь | Максимально допустимое содержание примесей, % | Примесь | Максимально допустимое содержание примесей, % |
| Серебро Бор Кадмий Хром Медь Железо | 1·10–4 2·10–5 2·10–5 1·10–3 1.10–3 5·10–3 | Марганец Молибден Никель Кремний Диспрозий Гадолиний | 5·10–4 1·10–4 1,5·10–3 2·10–3 1·10–5 5·10–6 |
Далее тетрафторид, полученный из оксидов, можно перерабатывать либо до металла, либо до гексафторида. В первом случае тетрафторид должен быть ядерночистым и даже несколько чище на случай возможного загрязнения урана при плавке. Во втором достигается хорошая очистка урана от примесей нелетучих фторидов, в связи с чем к исходному тетрафториду, а следовательно, и к оксидам предъявляются менее жесткие требования по содержанию примесей.
Особенно большое значение имеют физические свойства оксидов урана: насыпной вес, размер кристаллов и агрегатов, пористость и т. д. Изделия из диоксида урана, используемые в качестве тепловыделяющих элементов, должны обладать высокой плотностью, близкой к теоретической (10,96 г/см3). Изделия такой высокой плотности можно получить лишь из определенных порошков диоксида урана. Пригодность диоксида для последующего прессования и спекания в изделия обусловливается способом его получения (табл. 1.2.2).
Таблица 1.2.2
Плотность образцов диоксида урана, полученного различными методами
| Метод приготовления диоксида | Плотность диоксида в спеченном состоянии, г/см3* |
| а) UО2(NO3)2·6Н2О → UО3 б) UО3 + Н2 → UO2 | 7,8 |
| а) UО2(NO3)2·6Н2О → UО3 б) Мокрый размол UО3 в) UО3 +Н2 → UO2 | 10,3 |
| а) UО2(NO3)2 + NH4OH → (NH4)2U2O7 б) (NH4)2U2O7 + H2 → UO2 | 10,6 |
* Образцы прессовали на холоду под давлением 2,8 т/см2 и спекали в течение 30 мин в атмосфере при 1700 °С.
Как видно из этих данных, более удобен для получения диоксида керамического сорта метод термического разложения с одновременным восстановлением полиураната аммония. Образцы плотностью выше 10 г/см3 можно получить и из худшего по спекаемости порошка, но тогда потребуются более высокие давления прессования и большее время спекания. Размер кристаллов диоксида керамического сорта колеблется в пределах десятых долей микрона.
Если оксиды урана используются в качестве промежуточных продуктов в производстве тетрафторида и других соединений урана, их физические свойства в существенной степени определяют эффективность операций восстановления и фторирования. Реакционная способность оксидов урана зависит от метода их получения, в частности наиболее активные образцы получают разложением солей при низкой температуре; при осуществлении тех же операций при более высокой температуре реакционная активность оксидов снижается.
Однако не только температура, но и вид исходного соединения урана влияет на физические свойства полученных из него оксидов (табл. 1.2.3).
Таблица 1.2.3
Дата: 2019-02-25, просмотров: 427.