Институт тонких химических технологий
Им. М.В. Ломоносова
Реферат по теме:
«Органические производные титана со связью Ti-C Природа связей. Получение, физические и химические свойства. Возможности практического использования.»
Работу выполнил: Павловский М.М.
Группа: ХЕМО-01-17
Москва 2018
Введение
Долгое время все попытки получить титанорганические соединения действием металлоорганических соединений, главным образом на тетрахлорид титана, оказывались безуспешными. Вместо образования ожидаемых титан(IV)-органических соединений происходило восстановление титана до более низких степеней окисления. Это объяснялось невозможностью существования титанорганических соединений, причем положение о нестабильности ковалентной связи между атомом переходного металла (образованной d-электронами) и атомом углерода органического радикала обосновывалось теоретически. Допускалось, однако, что возможно существование титан(II)-органических соединений, образованных за счет валентных s-электронов. И только в середине XX века были получены и исследованы алкилгалогениды, а затем алкилалкоксиды и другие титан(IV)-органические соединения. Эти соединения, особенно титантетраалкилы, оказались очень нестойкими. Интерес к титанорганическим соединениям сильно возрос в связи с их способностью (в смеси с алюминийорганическими соединениями) оказывать каталитическое влияние на реакции полимеризации олефинов.
Первые попытки выделить и охарактеризовать соединения, содержащие связь ≡Ti−С≡, были сделаны в 1938 г. Однако оказалось, что в условиях, в которых обычно проводился эксперимент в химической лаборатории, выделить и охарактеризовать указанные соединения не удается. Как стало ясно в дальнейшем, ввиду чрезвычайно высокой реакционной способности синтезируемых соединений по отношению к кислороду воздуха и влаге, а также их термической нестабильности работать с ними необходимо в специальных условиях и часто даже при отрицательных температурах. Развитию химии титанорганических соединений способствовали работы по исследованию каталитических систем, состоящих из галогенидов титана и металлалкилов, получивших название «катализаторов Циглера—Натта». Очень интенсивно эти работы начали проводиться с середины 1950-х годов.
Задачи
1. Рассмотреть строение, физические, химические свойства органических производных титана с σ-связью Ti-C.
2. Рассмотреть строение, физические, химические свойства π-комплексов титана.
3. Показать области применения органических производных титана со связью Ti-C.
Титаноалкилы
Алкилгалогениды титана(IV).
Из титана(IV)-органических соединений первоначально были получены и исследованы алкилхлориды типа TiClnR4-n где R — метил, этил, бутил. В настоящее время известны также соответствующие бромиды и иодиды, а также соединения с другими алкильными радикалами. Все эти соединения получаются при взаимодействии соответствующего тетрагалогенида титана с алкильными производными лития, цинка, алюминия, свинца и других металлов. Легче всего получаются моноалкилтригалогениды титана.
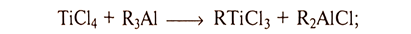
Получение алкилгалогентитанов и тетраалкилтитанов осуществляют в инертной атмосфере при температурах от -80 до 0 °С в среде органических растворителей алифатической или ароматической природы (гексан, бензол и т. п.). Соотношением исходных компонентов регулируют степень замещения образующихся органотитанов. Разделение продуктов реакции осуществляют, переводя алкилалюминийгалогениды или АlСl3 в нерастворимое или нелетучее состояние действием галогенидов щелочных металлов или другими комплексообразователями, а образовавшийся алкилгалогенид титана выделяют перегонкой реакционной смеси в вакууме. В качестве алкилирующих средств можно использовать металлоорганические соединения лития, цинка, ртути, свинца, магния, кадмия и других металлов.
Органические производные титана со связями Ti−С, как правило, термически нестабильны. Термическая нестабильность алкил(арил)галогенидтитанов возрастает с увеличением числа органических радикалов и уменьшается соответственно с увеличением числа заместителей X (галоген) и ростом их электроотрицательных свойств.
Метилтрихлорид титана
Метилтрихлорид титана TiCl3(CH3) был получен путем медленного добавления диметилхлорида алюминия к избытку тетрахлорида титана в гексановой среде при комнатной температуре:
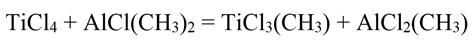
В гексановом растворе метилтрихлорид титана может быть получен также при взаимодействии тетрахлорида титана с метилхлоридом магния (не содержащим эфира) при - 20° С.
Метилтрихлорид титана представляет собой темно-фиолетовые кристаллы, плавящиеся при 28,5° С в желтую жидкость; растворим в углеводородах и их галогенпроизводных. Метилтрихлортитан устойчив в отсутствии влаги и воздуха при 20 °С в течение нескольких дней, но растворах легко подвергается термическому распаду по уравнению:
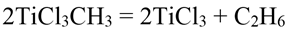
Выделяющийся трихлорид титана, в свою очередь, катализирует процесс термораспада. Метилтрихлорид в растворах легко окисляется кислородом с образованием метоксидтрихлорида титана.
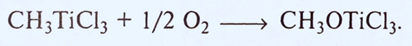
Метилтрихлорид титана легко реагирует с жидкими алкенами, причем происходит образование комплексов и отщепление свободных метил-радикалов. С тетрагидрофураном метилтрихлорид титана реагирует с образованием комплекса, который легко распадается также с выделением свободных метил-радикалов.
Этилтрихлорид титана
Этилтрихлорид титана TiCl3(C2H5) образуется при взаимодействии тетраэтилсвинца с избытком тетрахлорида титана в гексановом растворе при -80°С:
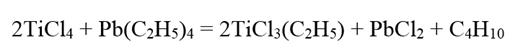
Этилтрихлорид титана представляет собой (при 20° С) красноватую жидкость, распадающуюся за 24 ч, т. е. значительно менее устойчивое соединение, чем метилтрихлорид. Легко окисляется кислородом с образованием этоксидтрихлорида титана.
Пропилтрихлорид титана TiCl3(С3Н7) и изобутилтрихлорид TiCl3(изо-С4Н9) образуются аналогично метилтрихлориду, но только при более низкой температуре.
Диалкилдигалогениды титана
К образованию диалкилдигалогенидов титана приводит дальнейшее алкилирование моноалкилтригалогенидов:
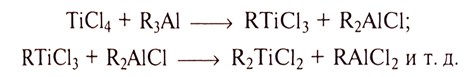
Диалкилдигалогениды титана образуются также при взаимодействии соответствующего тетрагалогенида титана с избытком алкилгалогенида алюминия. Диалкилдигалиды титана менее устойчивы, чем моноалкилтригалогениды.
Диметилдихлорид титана
Диметилдихлорид титана ТiСl2(СН3)2 образуется при действии триметилалюминия на охлажденный до -80°С раствор метилтрихлорида титана в гексане:
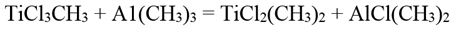
Диметилдихлорид титана представляет собой черно-фиолетовые кристаллы, растворимые в углеводородах (например, гексане). Растворы окрашены в желтый цвет.
Диэтилдихлорид титана
Диэтилдихлорид титана ТiСl2(С2Н5)2 образуется при приливании гексанового раствора тетрахлорида титана к избытку диэтилхлорида алюминия:
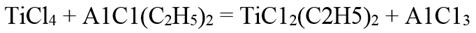
Титантетраалкилы
Тетраметилтитан
Тетраметилтитан Ti(CH3)4 образуется при действии метиллития или метилгалогенида магния на тетрахлорид титана в эфирном растворе:
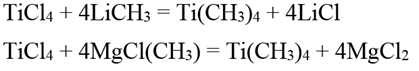
Тетраметилтитан представляет собой блестящие желтые иглообразные кристаллы. Может быть перегнан вместе с эфиром в вакууме при температуре ниже 0° С. Устойчив лишь при низких температурах; при температуре выше 0° С спонтанно разлагается с образованием черных пирофорных продуктов. При разложении тетраметилтитана в эфирном растворе первоначально желтая окраска переходит в зеленую, затем в черную; выделяется метан и, наконец, выпадает черный осадок, представляющий собой в основном диметилтитан Ti(CH3)2 с примесью элементарного титана и других продуктов. Диметилтитан диамагнитен. Термически он значительно более устойчив, чем тетраметилтитан: разлагается при нагревании до 250°С с выделением углеводородов (в основном метана) и образованием смеси (возможно, твердого раствора) элементарного титана с диметилтитаном. Соляной кислотой диметилтитан разлагается с выделением водорода, метана и образованием трихлорида титана. При действии воды гидролизуется с образованием ортотитановой кислоты и метана:
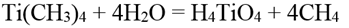
Кислородом тетраметилтитан легко окисляется. При действии галогенов, даже иода, легко разрушается с образованием тетрагалида титана и соответствующего галогенметана:
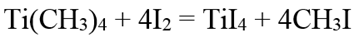
С тетрахлоридом титана дает метилтрихлорид титана:
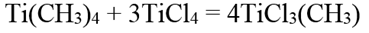
В предельных углеводородах тетраметилтитан растворяется без разложения и из гексана может быть перекристаллизован. В эфирном растворе со многими органическими соединениями азота и фосфора (амины, фосфины, гетероциклические соединения) тетраметилтитан образует нейтральные комплексы в виде кристаллов желтого или красного цвета. Все эти комплексы очень неустойчивы и разлагаются при температуре около 0°С.
Тетраэтилтитан
Тетраэтилтитан Ti(C2H5)4 образуется при действии этиллития на этилтрихлорид титана в эфирном или гексановом растворе:
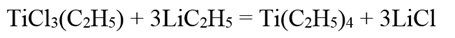
Тетраэтилтитан представляет собой оранжево-желтые кристаллы. Он чрезвычайно неустойчив и при выделении из раствора, даже при низкой температуре, моментально разлагается.
Тетрапропилтитан
Тетрапропилтитан Ti(C3H7)4 образуется при действии пропиллитня на пропилтрихлорид титана в гексановом растворе:
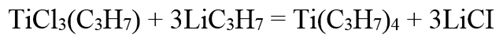
Титанциклоалкадиенилы
Для переходных элементов характерно образование π-комплексов. Не является исключением и титан. Он образует циклопентадиенильные, индиенильные и циклогептатриенильные соединения. Эти соединения построены по типу ферроцена, в них связь атома титана с лигандом осуществляется за счет взаимодействия π-электронов лиганда с 3d-орбиталями титана. Имеет место обобщенная связь металла с лигандом, например, циклопентадиенильным кольцом. Все кольцо циклопентадиена равномерно присоединено к атому титана, а не посредством связи металла с каким-то одним углеродом кольца. Такие структуры являются π-комплексами и получили название металлоценов (для титана — титаноценов). Эти соединения значительно устойчивее и менее реакционноспособны по сравнению с титанорганическими соединениями с σ-связью Ti—С.
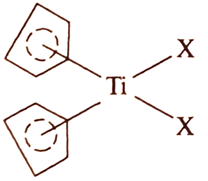
На рис. 1 представлена структура бис(циклопентадиенильного) производного титана.
Рис. 1. Структура бис-(циклопентадиенильного) производного титана, где X=Hal, OR; R=Alk, Аг
Титанциклопентадиенилалкилы
Из алкилциклопентадиенилгалидов титана можно указать на метилдициклопентадиенилхлорид — TiCl(С5Н5)2(СН3), который представляет собой красно-оранжевые кристаллы, плавящиеся при 169°С и растворимые без разложения в холодной воде. Вещество устойчиво лишь в темноте; на прямом солнечном свету быстро и необратимо разлагается.
Дициклопентадиенилтитан
Дициклопентадиенилтитан или титаноцен Тi(C5H5)2 образуется при взаимодействии дихлорида титана с циклопентадиенилнатрием:
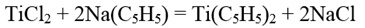
К его образованию приводит также восстановление диметилдициклопентадиенилтитана водородом. Таким образом, он является соединением титана (II) и относится к классу π-циклопентадиенилов, или так называемых «ценов» с характерной «сэндвичевой» структурой молекулы.
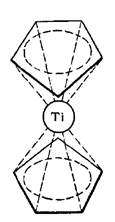
Рис. 2. Структура молекулы дициклопентадиенилтитана.
Дициклопентадиенилтитан представляет собой кристаллы, возгоняющиеся в вакууме (0,001 мм рт. ст. 120—180°С). Чрезвычайно легко окисляется кислородом воздуха. С концентрированной соляной кислотой образует дициклопентадиенилдихлорид титана. Труднорастворим в жидких алканах, циклоалканах и тетрагидрофуране. По свойствам дициклопентадиенилтитан сильно отличается от аналогичного ему «ферроцена», химически очень устойчивого. Характерным свойством дициклопентадиенилтитана является его способность образовывать соединение с окисью углерода — дициклопентадиенилдикарбонил титана — Ti(СО)2(С5Н5)2.
Институт тонких химических технологий
Им. М.В. Ломоносова
Реферат по теме:
«Органические производные титана со связью Ti-C Природа связей. Получение, физические и химические свойства. Возможности практического использования.»
Работу выполнил: Павловский М.М.
Группа: ХЕМО-01-17
Москва 2018
Введение
Долгое время все попытки получить титанорганические соединения действием металлоорганических соединений, главным образом на тетрахлорид титана, оказывались безуспешными. Вместо образования ожидаемых титан(IV)-органических соединений происходило восстановление титана до более низких степеней окисления. Это объяснялось невозможностью существования титанорганических соединений, причем положение о нестабильности ковалентной связи между атомом переходного металла (образованной d-электронами) и атомом углерода органического радикала обосновывалось теоретически. Допускалось, однако, что возможно существование титан(II)-органических соединений, образованных за счет валентных s-электронов. И только в середине XX века были получены и исследованы алкилгалогениды, а затем алкилалкоксиды и другие титан(IV)-органические соединения. Эти соединения, особенно титантетраалкилы, оказались очень нестойкими. Интерес к титанорганическим соединениям сильно возрос в связи с их способностью (в смеси с алюминийорганическими соединениями) оказывать каталитическое влияние на реакции полимеризации олефинов.
Первые попытки выделить и охарактеризовать соединения, содержащие связь ≡Ti−С≡, были сделаны в 1938 г. Однако оказалось, что в условиях, в которых обычно проводился эксперимент в химической лаборатории, выделить и охарактеризовать указанные соединения не удается. Как стало ясно в дальнейшем, ввиду чрезвычайно высокой реакционной способности синтезируемых соединений по отношению к кислороду воздуха и влаге, а также их термической нестабильности работать с ними необходимо в специальных условиях и часто даже при отрицательных температурах. Развитию химии титанорганических соединений способствовали работы по исследованию каталитических систем, состоящих из галогенидов титана и металлалкилов, получивших название «катализаторов Циглера—Натта». Очень интенсивно эти работы начали проводиться с середины 1950-х годов.
Задачи
1. Рассмотреть строение, физические, химические свойства органических производных титана с σ-связью Ti-C.
2. Рассмотреть строение, физические, химические свойства π-комплексов титана.
3. Показать области применения органических производных титана со связью Ti-C.
Титаноалкилы
Алкилгалогениды титана(IV).
Из титана(IV)-органических соединений первоначально были получены и исследованы алкилхлориды типа TiClnR4-n где R — метил, этил, бутил. В настоящее время известны также соответствующие бромиды и иодиды, а также соединения с другими алкильными радикалами. Все эти соединения получаются при взаимодействии соответствующего тетрагалогенида титана с алкильными производными лития, цинка, алюминия, свинца и других металлов. Легче всего получаются моноалкилтригалогениды титана.
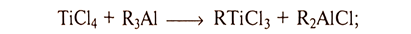
Получение алкилгалогентитанов и тетраалкилтитанов осуществляют в инертной атмосфере при температурах от -80 до 0 °С в среде органических растворителей алифатической или ароматической природы (гексан, бензол и т. п.). Соотношением исходных компонентов регулируют степень замещения образующихся органотитанов. Разделение продуктов реакции осуществляют, переводя алкилалюминийгалогениды или АlСl3 в нерастворимое или нелетучее состояние действием галогенидов щелочных металлов или другими комплексообразователями, а образовавшийся алкилгалогенид титана выделяют перегонкой реакционной смеси в вакууме. В качестве алкилирующих средств можно использовать металлоорганические соединения лития, цинка, ртути, свинца, магния, кадмия и других металлов.
Органические производные титана со связями Ti−С, как правило, термически нестабильны. Термическая нестабильность алкил(арил)галогенидтитанов возрастает с увеличением числа органических радикалов и уменьшается соответственно с увеличением числа заместителей X (галоген) и ростом их электроотрицательных свойств.
Дата: 2019-02-19, просмотров: 581.