Все вещества в твердом состоянии имеют кристаллическое или аморфное строение (смола, битум). При нагревании аморфные вещества размягчаются и переходят в жидкое состояние в широком интервале температур.
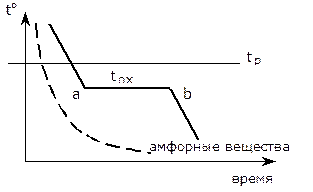 Все металлы, металлические сплавы и подавляющее большинство минералов – тела кристаллические, т.е. атом расположен в металле закономерно с образованием кристаллической решетки (это правильное расположение атомов в твердом теле и периодически повторяющимися пространствами) - такие вещества при нагреве остаются твердыми и переходят в жидкое состояние при определенной температуре (рисунок 1).
Все металлы, металлические сплавы и подавляющее большинство минералов – тела кристаллические, т.е. атом расположен в металле закономерно с образованием кристаллической решетки (это правильное расположение атомов в твердом теле и периодически повторяющимися пространствами) - такие вещества при нагреве остаются твердыми и переходят в жидкое состояние при определенной температуре (рисунок 1).
 Металлическое состояние возникает в комплексе атомов, когда при их сближении внешние электроны теряют связь с отдельными атомами и становятся общими, т.е. коллективизируются и свободно перемещаются по определенным энергетическим уровням между положительно заряженными ионами, которые периодически располагаются в пространстве.
Металлическое состояние возникает в комплексе атомов, когда при их сближении внешние электроны теряют связь с отдельными атомами и становятся общими, т.е. коллективизируются и свободно перемещаются по определенным энергетическим уровням между положительно заряженными ионами, которые периодически располагаются в пространстве.
Таким образом, устойчивость металла представляет собой ионно - электронную систему определенного электронного взаимодействия между положительно заряженными ионами и коллективи-зированными электронами. Такое взаимодействие между ионным скелетом и электронами получило название металлической связи.
Сила связи в металле определяется соотношением между силами отталкивающими и силами притяжения между ионами и электронами .
Атомы располагаются на таком расстоянии один от другого, чтобы энергия взаимодействия была меньше (путь наименьшего сопротивления) Кристалл, кристаллит и зерно являются основой структуры металла.
Порядок расположения атомов в кристаллической решетке может быть различным.
Кристаллические решетки бывают 7 видов. Большинство технических металлов имеют:
1) 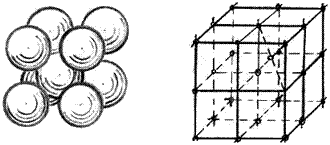 объемно-центрированную кубическую решетку (ОЦК) (хром, молибден, ванадий). Плотность решетки характеризуется координационным числом. Координационное число – это число атомов, находящихся на одинаковом расстоянии от главного. ОЦК ограничивается 9 атомами, 8 из которых расположены по вершинам куба, 1 – в центре, повторением этой ячейки путем переноса образуется вся структура кристалла (рисунок 2);
объемно-центрированную кубическую решетку (ОЦК) (хром, молибден, ванадий). Плотность решетки характеризуется координационным числом. Координационное число – это число атомов, находящихся на одинаковом расстоянии от главного. ОЦК ограничивается 9 атомами, 8 из которых расположены по вершинам куба, 1 – в центре, повторением этой ячейки путем переноса образуется вся структура кристалла (рисунок 2);
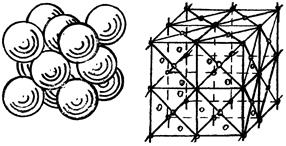
 2) кубическая гранецентрированная решет-ка (КГЦ) (алюминий, медь, никель). К=12 т.к. каждый атом имеет 12 ближайших соседей. КГЦ ограничивается 14 атомами , 8 из которых располагаются по вершинам куба , 6 - по его граням (рисунок 3).
2) кубическая гранецентрированная решет-ка (КГЦ) (алюминий, медь, никель). К=12 т.к. каждый атом имеет 12 ближайших соседей. КГЦ ограничивается 14 атомами , 8 из которых располагаются по вершинам куба , 6 - по его граням (рисунок 3).
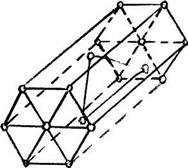 3) гексагональная кристаллическая решетка (ГК) ( ГНУ) (титан, кобальт, цинк). ГК ограничивается 17 атомами , 12 из которых располагаются по вершинам шестигранника, 2 атома - в центре основания , и 3 внутри призмы (рисунок 4).
3) гексагональная кристаллическая решетка (ГК) ( ГНУ) (титан, кобальт, цинк). ГК ограничивается 17 атомами , 12 из которых располагаются по вершинам шестигранника, 2 атома - в центре основания , и 3 внутри призмы (рисунок 4).
| Рисунок 3 – Часть кубической гранецентрированной пространственной решетки | Рисунок 4 – Элементарная ячейка гексагональной решетки |
Параметры решетки у различных металлов различные: У меди - 0,36 нМ; у алюминия - 0,405 нМ; у цинка - 0,267 нМ.
Атомы не находятся в покое, а непрерывно колеблются около положения равновесия; с повышением t амплитуда колебания увеличивается, что вызывает расширение кристалла, а при t плавления колебания частиц увеличивается настолько, что кристаллическая решетка разрушается, поэтому в реальных кристаллических решетках имеются дефекты:
1) точечный дефект - это пустые узлы или вакансии
2) линейные дефекты - это дислокации или сдвиг части кристаллической решетки (одномерный дефект)
3) поверхностный дефект - это нарушение симметрии расположения атомов.
4) объемные дефекты - это поры, газовые пузыри, трещины, и неметаллические включения.
Кристаллизация металлов
Все вещества в твердом состоянии имеют кристаллическое или аморфное строение (смола, битум). При нагревании аморфные вещества размягчаются и переходят в жидкое состояние в широком интервале температур.
Это процесс образования кристаллов в металлах и сплавах при переходе из жидкого состояния в твердое (первичная кристаллизация), а также перекристаллизация в твердом состоянии при их охлаждении (вторичная кристаллизация).
Выше t плавления устойчив жидкий металл, ниже устойчив твердый металл. Температура плавления соответствует равновесной t кристаллизации данного вещества, при которой обе фазы - жидкая и твердая могут сосуществовать одновременно, и притом бесконечно долго.
Процесс кристаллизации начинается с образования центров кристаллизации и продолжается в процессе роста их числа и размеров. При переохлаждении сплава ниже t плавления во многих участках жидкого сплава образуются устойчивые, способные к росту критические точки. Пока имеется жидкость, образованные кристаллы растут свободно и имеют правильную геометрическую форму. Однако при столкновении растущих кристаллов их правильная форма нарушается, т.к. в этих участках рост граней прекращается и продолжается только в тех направлениях, в которых есть доступ для жидкого металла.
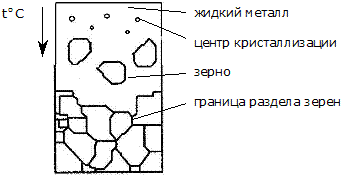 В результате кристаллы после затвердевания имеют неправильную внешнюю форму и называются кристаллитами или зернами.
В результате кристаллы после затвердевания имеют неправильную внешнюю форму и называются кристаллитами или зернами.
Скорость зарождения центров - это число центров, возникших в единице объема за единицу времени.
Скорость роста кристаллов - это линейное увеличение размеров кристалла в единицу времени.
 Различают макро- и микроструктуру материала.
Различают макро- и микроструктуру материала.
Макроструктура - структура металла, видимая при увеличении до 50 раз или невооруженным глазом.
Микроструктура - структура металла, видимая при больших увеличениях: на метало-графическом микроскопе до 2,5 тыс. раз; на электронном до 25 тыс. раз.
Дата: 2018-12-28, просмотров: 450.