Задача 1. Определите степень окисления комплексообразователя в комплексном соединении [Cо(NH3)5Br]SO4
Решение: Внешняя сфера SO4 2-, имеет заряд -2, значит внутренняя сфера [Cо(NH3)5Br] имеет заряд +2. [Cо(NH3)5Br]2+
Поскольку заряд внутренней сферы определяется как алгебраическая сумма заряда комплексообразователя и лигандов, можно определить степень окисления комплексообразователя, т.е. кобальта. Зная, что заряд NH3 равен 0, а для Br-1, степень окисления Со будет равна +3.
Ответ: +3
Задача 2. Определите заряд комплексного иона и тип гибридизации атомных орбиталей комплексообразователя в данном соединении: [Cu+2(H2O)4]x
Решение: Заряд лиганда Н2О равен 0, тогда заряд комплексного иона равен 2+ [Cu+2(H2O)4]2+
Координационное число равно 4, что определяет гибридизацию атомных орбиталей по типу sp3 .
Ответ: 2+, sp3 - гибридизация.
Задача 3. Запишите константу нестойкости для следующего соединения: Na2[Zn(OH)4]
Решение: В водном растворе соединение полностью диссоциирует на внешнюю и внутреннюю сферу: Na2[Zn(OH)4] ® 2Na+ + [Zn(OH)4]2-
Данный процесс называется первичной диссоциацией. Внутренняя среда диссоциирует слабо, этот процесс является обратимыми и он характеризуется константой равновесия, называемой константой нестойкости
[Zn(OH)4]2- « Zn+2 + 4OH-
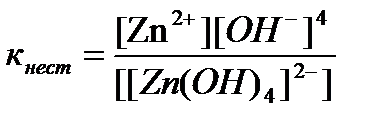
[Zn+2]∙ [OH-]4
К нест. = ¾¾¾¾¾¾¾
[[Zn(OH)4]2-]
Задача 4. Британский антилюизит (БАЛ) используется как антидот при отравлении солями ртути. Запишите уравнение взаимодействия солей ртути с БАЛ в качестве лечебного средства.
Ответ
Н
| СН2 - SH CH2 - S S - CH2 ç ê Hg+2 ê 2 CH - SH + Hg2+ ® CH - S S - CH ç ê Н ê CH2 - OH CH2-OH HO - CH2 |
+ 2 Н+
Задача 5. Сколько изомеров существует у иона [Co(H2N-CH2-CH2-NH2)2Cl2]+ ? Ответ обоснуйте и проиллюстрируйте.
Ответ: Существует 2 изомера транс (а)- и цис- изомер (б).
NH2 NH2
NH2 NH2
Cl NH2 Со
Со
NH 2 Cl
NH 2 Cl
NH 2 Cl
а- транс-изомер б –цис-изомер
Задача 6. Существует два изомера состава CrCl 2 ( NO 2 )( NH 3 )4. Один из них дает осадок с раствором нитрата серебра, другой не образует осадка. Чем можно объяснить это различие в поведении двух изомеров?
Ответ:
1. [Cr(NH3)4 Cl2]NO2 + AgNO3 ¾® [Cr(NH3)Cl(NO2)]NO3 + AgNO2 осадка нет
2. [Cr(NH3)Cl(NO2)]Cl + AgNO3 ¾¾¾® [Cr(NH3)Cl(NO2)]NO3 + AgCl¯
выпадает осадок, т.к. в комплексном соединении хлорид-ион находится во внешней сфере.
Упражнения для самостоятельной работы
1. Определите степень окисления комплексообразователя, назовите комплексное соединение и выразите константу нестойкости:
K3[Fe(CN)6] [Co(H2O)6]Cl3 K4[Fe(CN)6] KFe[Fe(CN)6]
2. Отразите химизм взаимодействия унитиола (2,3-димеркаптопропансульфоната натрия) с солями Hg+2.
3. Из предложенных ниже молекул и ионов составьте комплексные соединения анионного, катионного и нейтрального типа (Pt+2, NН3, К+, С1-, Сu+2).
Назовите их.
4. В аналитической и медицинской практике используется ЭДТА (этилендиаминтетрауксусная кислота) и его соль Na2H2Т (трилон Б) С какими катионами: Со3+ (kн=2,51×10-41), Мg2+ (kн=7,59×10-10), Fe2+ (kн=6,31×10-15), Fe3+ (kн=5,89×10-25) он образует менее прочное комплексное соединение? Расположите комплексы по убыванию их прочности.
5. Укажите, в состав каких ферментов входит кобальт: 1) карбоангидразы; 2) витамина В12
3) цитохромов 4) супероксиддисмутазы; 5) ксантиноксидазы
6. При отравлениях ляписом (нитрат серебра) желудок промывают 2%-ным раствором хлорида натрия. Рассчитайте массу AgCl, которая получится при взаимодействии 0,1 г нитрата серебра с избытком хлорида натрия.
Ответ: m(AgCl)=0,084г
7.Сульфат цинка ZnSO4 применяется в виде 0,25% раствора, как глазные капли. Сколько нужно добавить воды к 25г раствора ZnSO4 c массовой долей 2%, чтобы приготовить глазные капли?
Ответ: 175 г воды.
8. Массовая доля цинка, входящего в состав яда кобры (ценное лекарство!), равно 0,5%. Сколько атомов цинка потребуется кобре для производства 1 капли (30мг) яда?
Ответ: N (Zn)=1,38×1018 атомов
Тестовые вопросы
1. Общее число электронов в ионе Cr 3+ равно:
1) 21 2) 27 3) 24 4) 52
2. Соль образуется при…
1) разложении пероксида водорода 3) обугливании сахара в серной кислоте
2) горении железа в хлоре 4) растворении негашеной извести в воде
3. При частичном восстановлении Сr2O3 образуется…
1) СrO 2) СrO4 2- 3) СrO2 – 4) Сr2O7 2-
Дата: 2019-02-02, просмотров: 434.