(Е0Сu2+/Cu=0,34B, Е0Zn2+/Zn=-0,76B) равна___ В.
1) 1,10 2) 0,70 3) 0.28 4)0,43
3) Если при электролизе водного раствора соли значение рН в катодном пространстве возросло, то электролизу подвергался раствор…
1) Cu(NO3)2 2)KCl 3) CuCl2 4) ZnCl2
4) В гальваническом элементе, состоящем из никелевого 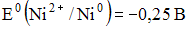 и железного
и железного 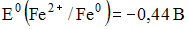 электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс …
электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс …
1) 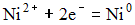 2)
2) 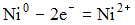
3) 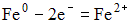 4)
4) 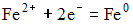
5) Сумма коэффициентов в суммарном уравнении процесса электролиза водного раствора AgNO3 равна…
1) 11 2) 15 3) 3 4) 7
6) При электролизе раствора хлорида меди (II) на катоде выделилось 2,7 г меди. Объем газа (н.у.), выделившегося на аноде равен _______ л.
1) 4,48 2) 0,945 3) 2,24 4) 6,72
7) Сумма коэффициентов в левой части уравнения реакции KMnO4 + Na2SO3 + H2SO4 ® … составляет…
1) 6 2) 8 3) 12 4) 10
8) При прохождении через раствор нитрата серебра количества электричества величиной 48250Кл на катоде образуется ___граммов чистого серебра (F=96500Кл/моль).
1) 27 2) 54 3) 18 4) 108
9) Коэффициент перед молекулой восстановителя в уравнении реакции KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O равен.
1) 5 2) 3 3) 2 4) 1
10) Если гальванический элемент составлен из двух серебряных электродов, один из которых стандартный, то для достижения наибольшего ЭДС другой электрод следует погрузить в раствор AgNO3 c концентрацией
1) 0,5 М 2) 0,2 М 3) 0,4 М 4) 0,1 М
11) ЭДС гальванического элемента состоящего из железного и серебрянного электродов, погруженных в 0,1 М растворы их нитратов Е0(Fe+2/ Fe)= -0,44 В, Е0(Ag+/ Ag)= 0,80 В, равна_______В.
1) 1,21 2) 1,24 3) – 1,21 4)– 1,24
12) Для получения 54 г серебра электролизом водного раствора нитрата серебра (выход по току 100%), необходимо чтобы в растворе содержалось___граммов чистой соли
1) 255 2) 85 3) 340 4) 170
13) При электролизе воды на аноде выделилось 11,2 л (н.у.) кислорода. Объем водорода, выделившегося на катоде равен ____ л (н.у.)
1) 22.4 2) 5.6 3) 44.8 4) 11.2
15) Если гальванический элемент составлен из двух электродов, один из которых стандартный цинковый электрод Е0 = -0,76В, то для достижения наибольшего значения Э.Д.С. другим электродом должен быть стандартный
1) медный Е0=+0,34 В 2) серебряный Е=+0,8 В
3)свинцовый Е=-0,13 В 4) водородный
15) Максимальное значение ЭДС (при одинаковых концентрациях солей) будет у гальванического элемента Ме|Me(NO3)2||Cu(NO3)2|Cu, если стандартный потенциал второго металла равен ___В.
1) – 0,76 2) – 2,36 3) + 1,19 4) +1,50
Занятие № 3
ТЕМА: Растворы. Коллигативные свойства растворов.
ЦЕЛЬ: Изучить коллигативные свойства растворов и приобрести навыки криометрических измерений.
Теоретические вопросы:
1. Растворы, определение. Роль воды и растворов в жизнедеятельности. Физико-химические свойства воды, обуславливающие ее роль в качестве единственного биорастворителя. Строение воды, образование межмолекулярных водородных связей.
2. Концентрация растворов, способы ее выражения. Массовая доля, молярная концентрация, моляльная концентрация, молярная концентрация эквивалента, молярная доля и титр.
3. Автопротолиз воды. Константа автопротолиза воды.
4. Зависимость растворимости вещества в воде от соотношения гидрофильных и гидрофобных свойств; влияние внешних условий на растворимость.
5. Понятие об идеальном растворе.
6. Закон Рауля и следствия из него: понижение температуры замерзания, повышение температуры кипения раствора.
7. Коллигативные свойства разбавленных растворов неэлектролитов.
8. Коллигативные свойства разбавленных растворов электролитов.
9. Осмос. Омотическое давление: закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
10. Понятие о изоосмии. Роль осмоса в биологических системах. Плазмолиз, гемолиз.
11. Законы растворения газов в воде и биологических жидкостях.
Основные уравнения по теме:
«Растворы. Коллигативные свойства растворов»
Способы выражения концентрации растворов:
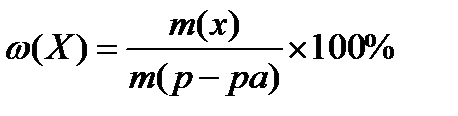
1. массовая доля
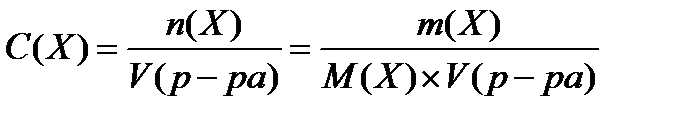
2. молярная концентрация (моль/л)
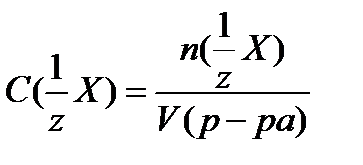 3. молярная концентрация эквивалента (моль/л)
3. молярная концентрация эквивалента (моль/л)
где,
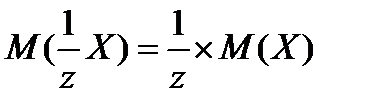
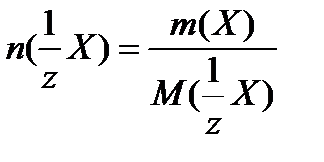
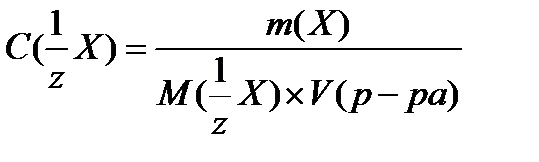
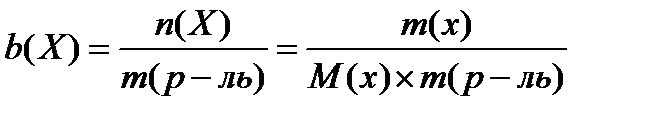
4. моляльная концентрация (моль/кг)
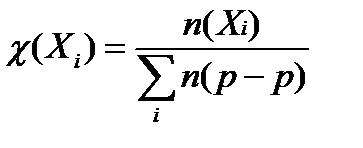
5. молярная доля
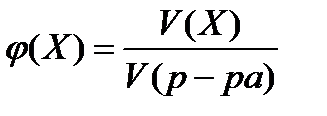
6. объёмная доля
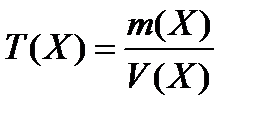
7. титр (г/мл)
8. P = P0× c (X1) закон Рауля
9. 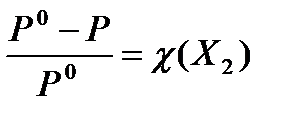 закон Рауля
закон Рауля
10. ∆Р = Р0×χ(Х2) закон Рауля
11. DTк = Кэ × b(x) - повышение температуры кипения растворов
12. D Tз = Кз × b(x) - понижение температуры замерзания растворов
13.
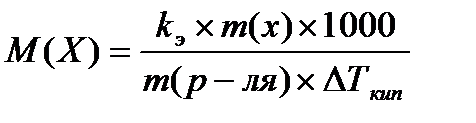 расчёт молярной массы вещества эбулиометрическим методом
расчёт молярной массы вещества эбулиометрическим методом
14.
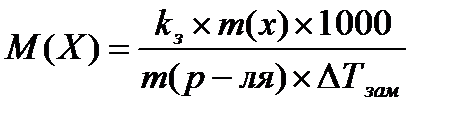 расчёт молярной массы вещества криометрическим методом
расчёт молярной массы вещества криометрическим методом
15. p осм. = С(х) × RT - уравнение Вант-Гоффа
16. 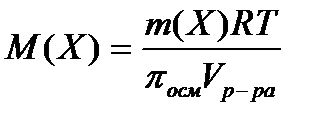 осмометрическое определение молярной массы вещества.
осмометрическое определение молярной массы вещества.
17. 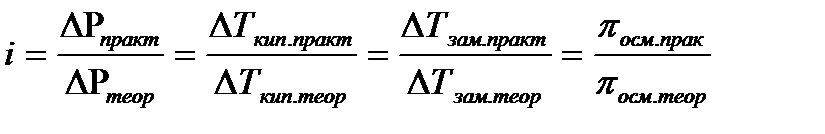 - расчет изотонического коэффициента
- расчет изотонического коэффициента
Уравнения коллигативных свойств растворов электролитов:
1. DP = i P0 c (X2)
2. DTкип = i ×Кэ ×b (х)
3. DTзам = i ×Кз × b (x)
4. p осм. = i ×C(х) ×R×T
Обучающие задачи:
1. Какой объем раствора серной кислоты с массовой долей 98 % (ρ = 1,81г/мл) необходимо взять для приготовления 500 мл раствора с молярной концентрацией кислоты 0,25 моль/л. (Кз=1,86 кг×К/моль)
2. Решение:
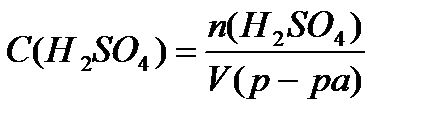
n (H2SO4) = C (H2SO4) × V (p-pa) = 0,25 моль/л×0,5л = 0,125моль
2. m (H2SO4) = n (H2SO4)×M (H2SO4)
M (H2SO4) = 2 + 32 + 64 = 98 г/моль
m (H2SO4) = 0,125моль×98 г/моль = 12,25 г
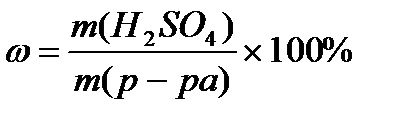
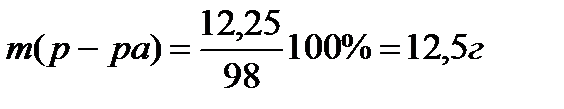
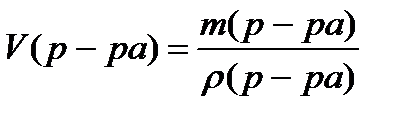
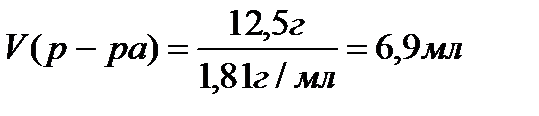
Ответ: V(р-ра) = 6,9 мл
3. Вычислите температуру замерзания раствора, содержащего 10г глюкозы в 180г воды (изотонический раствор).
Решение:
1. DTзам = K∙× b (C6H12O6)
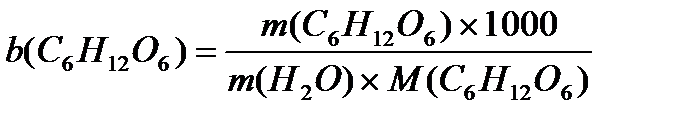
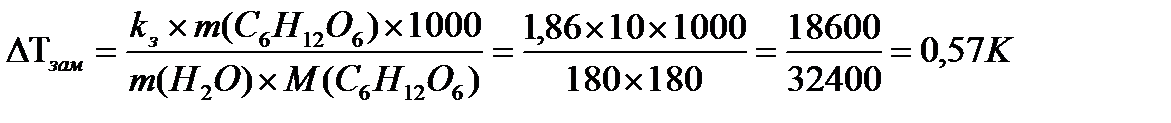
Tзам раствора = Tзам. р-ля - DTзам.
Tзам. раствора = 273 - 0,57 = 272,430К или -0,570С
Ответ: -0,570С
4. Определите осмотическое давление при 370С в растворе с молярной концентрацией NaCl 0,16 моль/л. Будет ли этот раствор изотоничен плазме крови? Изотонический коэффициент NaCl равен 1,95.
Решение:
p = i×C (NaCl)∙×R×T R = 8,31 кПа×л/моль×К T = 273 + 37 = 310 K
p = 1,95 × 0,16моль/л × 8,31кПа×л/моль×К × 310К = 803,7 кПа
Осмотическое давление близко плазме крови, раствор изотоничен плазме крови.
Задачи для самостоятельного решения.
Упражнение 1
В каких системах можно наблюдать явление осмоса? Приведите примеры природных осмотических явлений.
Упражнение 2
Почему клубника, посыпанная сахаром, даёт сок?
Упражнение 3
Какую цель преследуют, посыпая снег на тротуаре солью?
Упражнение 4
Почему при аллергических реакциях, сопровождающихся отеками тканей, в организм вводят высококонцентрированные растворы хлорида кальция (10%) и глюкозы (20%) ?
Задача 1.
Вычислить молярную, моляльную, моль-эквивалентную концентрации и молярную долю серной кислоты в 20% её растворе с плотностью 1,14 г/мл.
Ответ: С(Н2SO4)=2,33 моль/л; b(Н2SO4)=2,55моль/кг; С(1/2Н2SO4)=2,33 моль/л; χ(Н2SO4)=0,044
Задача 2.
Температура кипения раствора, содержащего 6,4г адреналина в 360г ССl4 на 0,49 К выше температуры кипения чистого ССl4, (Кэ = 5,02 кг∙к/моль). Какова молярная масса адреналина?
Ответ: 182 г/моль
Задача 3.
Этиловый спирт внутривенно иногда вводят при гангрене и абсцессе легкого в виде раствора с массовой долей 20%. Определите, будет ли при 370С данный раствор этилового спирта изотоничен плазме крови? Плотность раствора принять за 1 г/мл.
Ответ: 11200 кПа, раствор спирта –гипертонический.
Задача 4.
Рассчитайте осмотическое давление при 310К водного раствора, содержащего в 0,1л дезоксирибозу массой 1,34г. Каким (гипо-, гипер- или изотоническим) является этот раствор по отношению к плазме крови?
Ответ: Посм= 258 кПа
Задача 5
Осмотическое давление раствора гемоглобина в воде, содержащего 124 грамма в литре при 170С равно 4×103 Н/м2. Рассчитайте молярную массу гемоглобина.
Ответ:67822г/моль
Задача 6
Осмотическое давление плазмы крови равно 7,8×105Н/м2. Рассчитайте, сколько граммов хлорида натрия необходимо для приготовления 200мл раствора изотоничного плазме крови. Степень диссоциации хлорида натрия 95%.
Ответ:1,81г.
Задача 7
Опишите состояние эритроцитов при 310К в растворах сахарозы с массовой долей 8% (плотность 1,03 г/мл) и глюкозы с ω=2% (плотность 1,006 г/мл).
Ответ: гемолиз
Задача 8
Определите молярную массу камфоры, если раствор 0,552г её в 17г эфира, кипит на 0,450 выше, чем чистый эфир (Кэ=2,16 кг×К/моль).
Ответ:155,8 г/моль
Задача 9
Осмотическое давление крови в норме 780 кПа. Вычислите осмолярность крови при 310 К.
Ответ: Сосм = 0,303 осмоль/л
Задача 10
Морская вода, содержащая 2,5% солей по массе, замерзает при -1,3320С. Чему равна осмоляльность морской воды?
Ответ: Сосм=0,716 осмоль/кг
Задача 11
Рассчитайте кажущуюся степень электролитической диссоциации LiCl в растворе с молярной концентрацией эквивалента равной 0,1 моль/л, если раствор изотоничен с 0,19 моль/л раствором сахара С12Н22О11 при 00С.
Ответ: i = 1,89
Тестовые вопросы
1. Раствор, содержащий 4,6 г глицерина (М=92) в 100 г воды 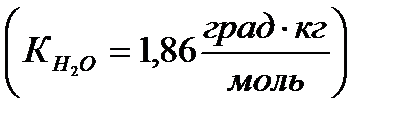 , замерзает при темпратуре___ ° С
, замерзает при темпратуре___ ° С
1) -0,465 2) -0,372 3) 0,186 4) -0,93
2. Растворение твердых веществ в воде характеризуется:
1) DH<0, DS<0 3) DH<0, DS=0
2) DH<0, DS>0 4) DH=0, DS<0
3. Сольватирование частиц растворенного вещества является процессом ______
1) Эндотермическим 3) Экзотермическим
2) Физическим 4) Необратимым
4. Растворимость газов в жидкости повышается при___
1) понижении температуры 3) повышении температуры
2) понижении давления газа 4) введении в жидкость электролитов
5. Зависимость растворимости газа от концентрации электролита в растворе описывается законом____
1) Генри 3) Вант-Гоффа
2) Рауля 4) Сеченова
6. Осмотическое давление раствора глюкозы с молярной концентрацией 0,1 моль/л при 25 ° С равно _____ кПа.
1) 61,9 2) 51,6 3) 123,8 4) 247,6
7. Осмотическое давление раствора хлорида натрия с молярной концентрацией 0,1 моль/л (изотонический коэффициент 1,95) при 25 ° С равно _____ кПа.
1) 247,6 2) 482,9 3) 20,8 4) 40,5
8.Уравнение π=С RT является математическим выражением закона ___
1) Вант-Гоффа 3) Дальтона
2) Рауля 4) Сеченова
9. Осмолярная концентрация раствора глюкозы, если при температуре 25 ° С его осмотическое давление равно 247,6 кПа, составляет _____ моль/л.
1) 1,2 2) 0,12 3) 0,1 4) 12
10. Процесс перехода молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией называется___
1) электролитическая диссоциация 3) осмос
2) гидролиз 4) диффузия
11. Растворы хлорида натрия и глюкозы с одинаковой концентрацией имеют:
1) Одинаковое осмотической давление 3) Одинаковое давление пара над раствором
2) Разное осмотическое давление 4) Разный цвет
12. Водный раствор глюкозы с моляльной концентрацией 0,5 моль/кг замерзнет при температуре___ ° С. Криоскопическая постоянная воды равна 1,86.
1) – 0,93 2) 0,93 3) 0 4) – 3,72
13. Водный раствор глюкозы с моляльной концентрацией 1 моль/кг закипит при температуре ___ ° С. Эбулиоскопическая постоянная воды 0,516.
1) 0,516 2) 100,516 3) 273,516 4) 298,516
14. Растворы глицерина и глюкозы будут иметь одинаковое осмотическое давление при 25 ° С если у них ____.
1) Одинаковый объем 3) Разная концентрация
2) Одинаковая концентрация 4) Разный объем
Дата: 2019-02-02, просмотров: 611.