1. Q = D E + W - уравнение первого начала термодинамики
2. W = P D V
3. Qv = D Ev - теплота изохорного процесса
4. Qp = D Hp - теплота изобарного процесса
5. D Hp = D E + P D V - уравнение первого начала термодинамики для изобарных процессов
6. D H = å n D H 0 298 обр. прод. реак. - å n D H 0 298 обр. исх. веществ - первое следствие закона Гесса
7. D H = å n D H 0 298 сгор. исход. в. - å n D H 0 298 сгор. прод. реакции - второе следствие закона Гесса
8. Q = W - уравнение первого начала термодинамики для биосистем
Q
9. D S = ¾¾ - энтропия как функция состояния системы
T
10. D S ³ 0 - уравнение второго начала термодинамики
11 S = å n S 0 298 прод. р. - å n S 0 298 исх. в. - расчет энтропии реакции
12. D G 0 = D H 0 - T D S 0 - уравнения для расчета энергии Гиббса
13. D G 0 = å n D G 0 298 прод. р. - å n D G 0 298 исх. в.(x)
14. DG0 = - 2,3RT lg Кс - уравнение изотермы химической реакции при стандартных условиях
15. 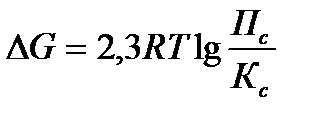 - уравнение изотермы химической реакции
- уравнение изотермы химической реакции
16. 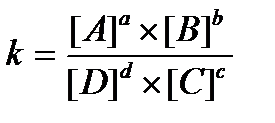 - константа химического равновесия, выраженная через равновесные концентрации вещества
- константа химического равновесия, выраженная через равновесные концентрации вещества
17. 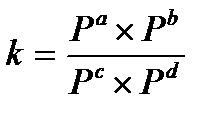 - константа химического равновесия, выраженная через равновесные парциальные давления вещества
- константа химического равновесия, выраженная через равновесные парциальные давления вещества
18. 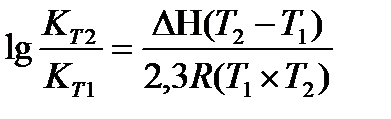 - уравнение изобары
- уравнение изобары
19. 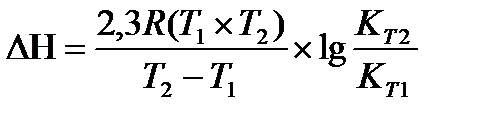 - расчет теплового эффекта по значениям констант
- расчет теплового эффекта по значениям констант
Таблица 1
Стандартные энтальпии образования веществ, стандартные энтропии и стандартные энергии Гиббса образования веществ
| Вещество | Стандартная энтальпия образования кДж/моль | Стандартная энтропия Дж/моль×К | Стандартная энергия Гиббса образования кДж/моль |
| Неорганические вещества | |||
| С (графит) | 0 | +6 | |
| СО (г) | -110 | +198 | -137 |
| СО2 (г) | -393,5 | +214 | -394 |
| Cl2 (г) | 0 | +223 | 0 |
| Cl2O (г) | +76 | +266 | +94 |
| FeСО3 (тв) | -753 | +96 | -680 |
| H2 (г) | 0 | +131 | 0 |
| HCl (г) | -92 | +187 | -95 |
| HI (г) | +24 | +206 | -1 |
| HNO2 (р-р) | -119 | +153 | -56 |
| HNO3 (ж) | -174 | +156 | -81 |
| H2O (ж) | -286 | +70 | -237 |
| H2O2 (ж) | -187 | +110 | -120 |
| H2S (г) | -21 | +206 | -34 |
| H2SO4 (ж) | -814 | +157 | -690 |
| KNO3 (тв) | -495 | +133 | -395 |
| KOH(р-р) | -477 | +92 | -441 |
| N2 (г) | 0 | +192 | 0 |
| NH3 (г) | -46 | +192 | -16 |
| H2O (г) | +82 | +220 | +104 |
| NO (г) | +91 | +211 | +87 |
| NO2 (г) | +33 | +240 | +51 |
| N2O3 (г) | +11 | +356 | +115 |
| Na2O2 (тв) | -510 | +95 | -447 |
| Na2S2O3 (тв) | -1117 | +225 | -1043 |
| O2 (г) | 0 | +205 | 0 |
| SO2 (г) | -297 | +248 | -300 |
| SO3 (г) | -396 | +257 | -371 |
| Органические вещества | |||
| Метан (г) | -75 | +186 | -51 |
| Этан (г) | -85 | +229 | -33 |
| Этилен (г) | +52 | +219 | +68 |
| Ацетилен (г) | +227 | +201 | +209 |
| Бензол (ж) | +49 | +173 | +125 |
| Циклогексан (ж) | -156 | +204 | +27 |
| Хлорметан (г) | -86 | +234 | -63 |
| Дихлорметан (г) | -95 | +270 | -69 |
| Трихлорметан (г) | -101 | +296 | -69 |
| Тетрахлорметан (г) | -100 | +310 | -58 |
| Метанол (ж) | -239 | +127 | -166 |
| Этанол (ж) | -277 | +161 | -174 |
| Диэтиловый эфир (ж) | -279 | +253 | -123 |
| Ацетальдегид (г) | -166 | +264 | -133 |
| Ацетон (ж) | -247 | +199 | -154 |
| Пируват-ион (р-р) | + | -559 | |
| L-молочная кислота (р-р) | -686 | +222 | -539 |
| Сахароза (тв) | -2222 | +360 | -1545 |
| D-глюкоза (р-р) | -1264 | +269 | -917 |
| Нитробензол (ж) | +16 | +224 | +146 |
| Анилин (ж) | +31 | +191 | +149 |
| L-лейцин (р-р) | -643 | +208 | -362 |
| Глицин (р-р) | -523 | +159 | -380 |
| D,L-лейцилглицин (р-р) | + | -464 | |
| Глицилглицин (р-р) | -734 | +231 | -492 |
Стандартные энтальпии сгорания органических веществ, кДж/моль
| Метан (г) | -890 | Этанол (ж) | -1371 |
| Ацетилен (г) | -1300 | Диэтиловый эфир (ж) | -2727 |
| Бензол (ж) | -3268 | Нитробензол (ж) | -3091 |
| Циклогексан (ж) | -3920 | Анилин (ж) | -3396 |
| Метанол (ж) | -727 | Глюкоза | -2802 |
Дата: 2019-02-02, просмотров: 368.