К электрохимической коррозии относятся все случаи коррозии в водных растворах или во влажной атмосфере. Для предупреждения от электрохимической коррозии применяются различные методы. Например, защитные металлические покрытия. Железные изделия могут покрываться тонкой пленкой хрома, никеля, цинка, кадмия, алюминия, олова, серебра, золота и др. При нарушении целостности металлического покрытия в влажной среде, возникает гальванический элемент, что приводит к растворению более активного металла. Металл, который в ряду напряжения стоит левее, становится анодом и разрушается, при этом менее активный металл не изменяется.
Для защиты металлов от коррозии используют как анодное, так и катодное покрытие металлов. При анодном покрытии берется более активный металл (например, покрытие цинком железного изделия), он и растворяется при коррозии, а основной металл не разрушается. Катодное покрытие (например, серебрение железного изделия), защищает металл до тех пор пока пленка не нарушена. При нарушении защитной пленки основной металл становится анодом, а покрытие катодом, соответственно разрушается защищаемый металл, а покрытие не разрушается.
Обучающие задачи
Задача №1. Сумма коэффициентов в уравнении реакции:
Cu + HNO3 = Cu(NO3)2 + NO + H2O, составляет
1) 10 2) 15 3) 20 4) 18
Решение:
0 +5 +2 +2
Cu + HNO3 = Cu(NO3)2 + NO + H2O
Сu - 2e = Cu+2 | 3 Окисление восстановителя
N+5 + 3e = N+2 | 2 восстановление окислителя
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Ответ: №3
Задача №2 При электролизе водного раствора NaCI c нейтральными электродами протекает следующая окислительно – восстановительная реакция:
1) 2NaCI + 2Н2О = Н2  + CI2
+ CI2  + 2NaOH 2) 2NaCI = 2Na + CI2
+ 2NaOH 2) 2NaCI = 2Na + CI2 
3) NaCI + Н2О = НCI + NaOH 4) 2NaCI + 2Н2О = CI2  + 2NaOH
+ 2NaOH
Решение:
Катод (—) 2Н2О + 2е = Н2  + 2ОН— Анод (+) 2 CI– — 2е = CI2
+ 2ОН— Анод (+) 2 CI– — 2е = CI2 
Суммарное ионное уравнение: 2Н2О + 2 CI– = Н2 + 2ОН— + CI2 
электролиз
Суммарное молекулярное уравнение: 2NaCI + 2Н2О = Н2  + CI2
+ CI2  + 2NaOH Ответ: №1
+ 2NaOH Ответ: №1
Задача №3. Написать уравнения электролиза раствора Cu(NO3)2 c инертным анодом.
Решение: Катод (—) Сu2+ + 2е = Cu0 Анод (+) 2Н2О — 4е = О2  + 4Н+
+ 4Н+
Суммарное ионное уравнение: 2Сu2+ + 2Н2О = 2Cu0 + О2  + 4Н+
+ 4Н+
Суммарное молекулярное уравнение: 2 Cu(NO3)2 + 2Н2О = 2Cu0 + О2  + 4НNO3
+ 4НNO3
Задача №4 При прохождении через раствор нитрата серебра количества электричества величиной 48250 Кл на катоде образуется ____граммов чистого серебра. (F = 96500Кл/моль)
1) 27 2) 54 3) 18 4) 108
Решение: Можно рассчитать массу серебра по закону Фарадея 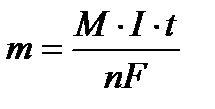 ; М(Ag = 108 г/моль, I ·t = 48250Кл, F = 96500Кл/моль
; М(Ag = 108 г/моль, I ·t = 48250Кл, F = 96500Кл/моль

Ответ: №2
Задания для самостоятельного решения.
При выполнении самостоятельной работы необходимо полностью приводить обоснования правильности выбора номера верного ответа (посмотрите примеры решения теста выше).
1) Согласно уравнению Нернста потенциал электрода…
1) Зависит от его массы 2) Зависит от его природы
3)Не зависит от температуры 4) Не зависит от концентрации электролита
Дата: 2019-02-02, просмотров: 382.