2) DG0 > 0
35) Равновесие в реакции, уравнение которой СН4(г) + 4 S (ж) ↔ С S 2 (г) + 2Н2 S (г), Δ H <0, сместиться влево при
4) увеличении концентрации H2S
36) Будет ли проходить реакция в прямом направлении, если D G = 18 кДж/моль
1) нет
Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направления
4) С2Н2(г) + 2Н2(г) ↔ С2Н6 (г), ΔН<0
38) Как нужно изменить давление, чтобы реакция гемоглобина с кислородом была смещена влево Hb + O 2 « HbO 2
1) уменьшить давление
39) В реагирующей системе, уравнение которой NO (г) + Cl 2 (г) ↔ NOCl 2 (г) Δ H > 0, равновесие сместиться вправо при:
1) повышении давления
Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в прямом направлении
1) DG < 0
Как нужно изменить давление, чтобы сместить равновесие реакции
N 2 + 3 H 2 « 2 NH 3 влево
1) уменьшить
42) Для смещения равновесия в системе SO2(г)+Cl2(г) 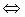 SO2Cl2(г), ΔH < 0 в сторону продуктов реакции необходимо
SO2Cl2(г), ΔH < 0 в сторону продуктов реакции необходимо
1) понизить температуру
На состояние химического равновесия в системе
2 SO 2(г) + О2 (г) ↔2 SO 3 , Δ H 0 < 0 не влияет
1) катализатор
44) Какое выражение соответствует константе химического равновесия для данной реакции N 2 +3 H 2 = 2 NH 3
2) Кс = [NH3]2 / [N2][H2]3
45) Будет ли влиять давление на смещение равновесия данной реакции H 2 + Cl 2 = 2 HCl
2) нет
Равновесие в реакции, уравнение которой
СН4(г) + 4 S (ж) ↔ С S 2 (г) + 2Н2 S (г), Δ H <0, сместиться влево при
4) увеличении концентрации H2S
47) Как нужно изменить давление, чтобы реакция гемоглобина с кислородом была смещена влево Hb + O 2 « HbO 2
1) уменьшить давление
В каком направлении идёт данная реакция
H 3 PO 4 + аденозин = АТФ + H 2 O , D G 0 298 = 14 кДж/моль
1) в обратном
49) Согласно уравнению гомогенной химической реакции С2Н2 + Н2 « С2Н4; D Н < 0, …
3) повышение давления смещает равновесие вправо
50) При увеличении давления в системе Н2(г) + I2(г) « 2HI(г), D f H0 < 0…
3) состояние равновесия не изменяется
51) Исходя из уравнения реакции C2H4(г) = 2С (графит) + 2Н2(г), ∆Н0=-52,3 кДж, стандартная энтальпия образования этилена равна____кДж/моль
1) 52,3
52) Повышение давления смещает равновесие в сторону продуктов для реакции…
1) ВаО(к.) + СО2(г) ↔ ВаСО3(к.)
53) Для увеличения выхода продуктов реакции FeO(т) + H2(г)↔Fe(т) + H2O(г), ∆Н>0 необходимо…
Повысить температуру
54) Согласно первому началу термодинамики, справедливо выражение…
1) ∆U=Q-A
55) Для нахождения ∆Н0298 реакции 4HCN(г) + 5О2(г) = 2Н2О(ж) + 4СО2(г) + 2N2(г) ,
следует воспользоваться формулой…
1) ∆Н0298 = 2∆Н0298, Н2О (ж) + 4∆Н0298, СО2 (г) - 4∆Н0298, НСN (г)
56) Неверно, что согласно 2 началу термодинамики…
2) тепловой эффект обратной реакции больше теплового эффекта прямой реакции
57) Если прямая экзотермическая реакция протекает с уменьшением количества газообразных веществ, то согласно принципу Ле-Шателье , чтобы сместить равновесие в сторону продуктов, следует…
1) повысить давление
58) Наибольшему значению энтропии соответствует состояние воды…
4) Н2О(г) 398К
59) Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает______ закон термодинамики
2) первый
60) Реакция CaCO3= CaO + CO2, для которой ∆Н=178кДж, ∆S=160Дж/моль×К, при стандартных условиях:
2) протекает в обратном направлении
61) Для экзотермического процесса синтеза аммиака одновременное понижение температуры и увеличение давления_________выход аммиака
Увеличивает
62) Уравнение реакции, проходящей с увеличением энтропии, имеет вид…
1) NH4NO3(Т) = N2(Г) + 2 H2O(Г)
63) Выберите соединения с макроэргическими связями:
2) АТФ
2) Окислительно-восстановительные реакции. Электролиз .
1) Перманганат ион MnO4- в кислой среде восстанавливается до …
4) Mn2+
2) Оксид марганца (IV) MnO2 может проявлять в окислительно-восстановительных реакциях свойства
1) и окислителя, и восстановителя
3) При электролизе водного раствора KCl на катоде выделяется …
1) H2
4) В качестве восстановителей в промышленных условиях используют…
1) СО и Н2
5) Согласно уравнению Нернста потенциал электрода…
1) Зависит от его природы
6) Окислителем в реакции KMnO4+KNO2+H2SO4 ® K2SO4+MnSO4+H2O является…
1) KMnO4
Дата: 2018-12-28, просмотров: 1184.