ТЕСТЫ к МОДУЛЮ №1 (для итогового рубежного контроля)
ТЕРМОДИНАМИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
1) Известно, что для реакции 2CH4(г) + 2NH3(г)=2HCN(г) + 3H2O (ж) ΔH0=-345,2кДж и ΔG0=-325,9кДж. Следовательно, это реакция…
4) экзотермическая и при стандартных условиях протекает в прямом направлении
2) Для получения 1132 кДж тепла по реакции 2NO(г)+O2(г)↔2NO2(г), ∆Но= -566кДж необходимо затратить____ литр(ов) кислорода
3) 44,8
3) Теплота, необходимая для испарения 18 г воды, если DfH0 образования жидкой воды (-285,3 кДж/моль), DfH0 образования газообразной воды (-241,8 кДж/моль) равна…
1) 43,5 кДж
4) Для нахождения 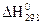 реакции
реакции 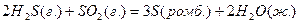 , следует воспользоваться формулой…
, следует воспользоваться формулой…
1) 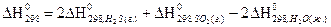
2) 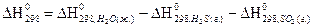
3) 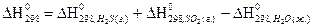
4) 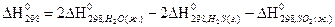
5) Для нахождения 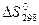 реакции
реакции 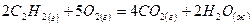 , следует воспользоваться формулой …
, следует воспользоваться формулой …
1) 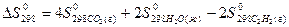
2) 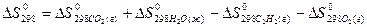
3) 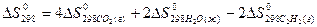
4) 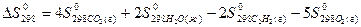
6) Если энтальпия образования SO 2 равна -297 кДж/моль, то количество теплоты, выделяемое при сгорании 16г серы, равно . . . кДж
3) 594
В реакции, протекающей в соответствии с термохимическим уравнением
3 H 2 + N 2 = 2 NH 3 + 92 кДж
Выделилось 23 кДж теплоты. Объём полученного (при н.у.) аммиака составляет
2) 11,2л
8) По термохимическому уравнению реакции С2Н4 + Н2О ↔ С2Н5ОН +46 кДж вычислите объём взятого этилена (н,у.), если известно, что выделившаяся в этом процессе теплота составила 138 кДж.
3) 67,2л
9) В реакцию, протекающую в соответствии с термохимическим уравнением2 Al + 3 S = Al 2 S 3 +509 кДж вступило 108 г алюминия. Количество выделившейся теплоты равно
3) 1018 кДж
10. В результате реакции, термохимическое уравнение которой 2 Al + Fe 2 O 3 = Al 2 O 3 + 2 Fe +848 кДж, выделилось 169,6 кДж теплоты. Масса образовавшегося железа равна:
2) 22,4 г
11) По термохимическому уравнению реакции горения ацетилена 2С2Н4 + 5О2 = 4СО2 + 2Н2О +2610 кДж рассчитайте, сколько выделится теплоты, если в реакцию вступило 67, 2 л ацетилена (н.у.)
2) 3915 кДж
В результате реакции, описываемой термохимическим уравнением
2С2Н4+ 5О2 = 4СО2 + 2Н2О +2610 кДж выделилось 652, 5 кДж теплоты. Оцените объём сгоревшего ацетилена
1) 11,2 л
13. Согласно термохимическому уравнению реакции СН4 + 2О2 = СО2 + 2Н2О + 802 кДж количество теплоты, выделившейся при сжигании 24 г метана, равно
2) 1203 кДж
14. В результате реакции, термохимическое уравнение которой 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O + 902 кДж, выделилось 1127,5 кДж теплоты. Объём (н.у.) образовавшегося при этом оксида азота ( II ) равен
1) 112л
В реакции, протекающей в соответствии с термохимическим уравнением
3 H 2 + N 2 = 2 NH 3 + 92 кДж
Выделилось 23 кДж теплоты. Объём полученного (при н.у.) аммиака
2) 11,2л
24) По термохимическому уравнению С2Н4+Н2О↔С2Н5ОН+46 кДж
Будет ли влиять давление на смещение равновесия данной реакции
H 2 + Cl 2 = 2 HCl
2) нет
Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в обратном направлении
2) DG0 > 0
35) Равновесие в реакции, уравнение которой СН4(г) + 4 S (ж) ↔ С S 2 (г) + 2Н2 S (г), Δ H <0, сместиться влево при
4) увеличении концентрации H2S
36) Будет ли проходить реакция в прямом направлении, если D G = 18 кДж/моль
1) нет
Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в прямом направлении
1) DG < 0
1) 52,3
52) Повышение давления смещает равновесие в сторону продуктов для реакции…
1) ВаО(к.) + СО2(г) ↔ ВаСО3(к.)
53) Для увеличения выхода продуктов реакции FeO(т) + H2(г)↔Fe(т) + H2O(г), ∆Н>0 необходимо…
Повысить температуру
54) Согласно первому началу термодинамики, справедливо выражение…
1) ∆U=Q-A
55) Для нахождения ∆Н0298 реакции 4HCN(г) + 5О2(г) = 2Н2О(ж) + 4СО2(г) + 2N2(г) ,
следует воспользоваться формулой…
1) ∆Н0298 = 2∆Н0298, Н2О (ж) + 4∆Н0298, СО2 (г) - 4∆Н0298, НСN (г)
56) Неверно, что согласно 2 началу термодинамики…
2) тепловой эффект обратной реакции больше теплового эффекта прямой реакции
57) Если прямая экзотермическая реакция протекает с уменьшением количества газообразных веществ, то согласно принципу Ле-Шателье , чтобы сместить равновесие в сторону продуктов, следует…
1) повысить давление
58) Наибольшему значению энтропии соответствует состояние воды…
4) Н2О(г) 398К
59) Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает______ закон термодинамики
2) первый
60) Реакция CaCO3= CaO + CO2, для которой ∆Н=178кДж, ∆S=160Дж/моль×К, при стандартных условиях:
2) протекает в обратном направлении
61) Для экзотермического процесса синтеза аммиака одновременное понижение температуры и увеличение давления_________выход аммиака
Увеличивает
62) Уравнение реакции, проходящей с увеличением энтропии, имеет вид…
1) NH4NO3(Т) = N2(Г) + 2 H2O(Г)
63) Выберите соединения с макроэргическими связями:
2) АТФ
2) Окислительно-восстановительные реакции. Электролиз .
1) Перманганат ион MnO4- в кислой среде восстанавливается до …
4) Mn2+
2) Оксид марганца (IV) MnO2 может проявлять в окислительно-восстановительных реакциях свойства
1) и окислителя, и восстановителя
3) При электролизе водного раствора KCl на катоде выделяется …
1) H2
4) В качестве восстановителей в промышленных условиях используют…
1) СО и Н2
5) Согласно уравнению Нернста потенциал электрода…
1) Зависит от его природы
6) Окислителем в реакции KMnO4+KNO2+H2SO4 ® K2SO4+MnSO4+H2O является…
1) KMnO4
В реакции
K2Cr2O7 +6KI +7H2SO4=Cr2(SO4)3 + 4K2SO4 +3I2 +7H2O
восстанавливается ион…
1) Н+
2) Сr2O72-
3) I-
4) SO42-
36) При электролизе водного раствора СuCl2 с графитовым анодом на …
1) катоде выделяется водород
2) аноде выделяется кислород
3) аноде выделяется хлор
4) катоде выделяется хлор
37) Oкислительно-восстановительная реакция в стандартных условиях возможна, если…
1) электроотрицательность окислителя выше электроотрицательсности восстановителя
2) стандартный потенциал Е0 восстановителя имеет отрицательное значение
3) значение разности потенциалов полуреакций окисления и восстановления положительно
4) стандартный потенциал Е0 окислителя имеет положительное значение
38) Согласно схеме гальванического элемента Fe|Fe2+||Ni2+|Ni ,…
1) электроны движутся от железного электрода к никелевому
2) никель окисляется
3) никелевый электрод является анодом
4) в процессе работы элемента на электроде осаждается железо
39) В системе, состоящей из луженого (покрытого оловом) железа при нарушении целостности покрытия в морской воде самопроизвольно протекает…
1) восстановление олова
2) окисление олова
3) восстановление железа
4) окисление железа
40) При электролизе водного раствора хлорида натрия на катоде протекает реакция…
1) 2H2O –4e → O2+4H+
2) 2H2O +2e → H2+2OH-
3) Na+ +e→Na
4) 2H++2e→H2
41) При электролизе воды на аноде выделилось 11,2 л (н.у.) кислорода. Объем водорода, выделившегося на катоде равен ____ л (н.у.)
1) 22.4
В реакции
2 KMnO4 + 3 Na2SO3 + H2O = 2MnO2 + 3 Na2SO4+ 2 KOH восстанавливается ион …
1) SO42-
2) K+
3) MnO4-
4) SO32-
54) Максимальное значение ЭДС (при одинаковых концентрациях солей) будет у гальванического элемента Ме|Me(NO3)2||Cu(NO3)2|Cu, если стандартный потенциал второго металла равен ___В.
1) – 0,76
2) – 2,36
3) + 1,19
4) +1,50
55) Раствор, образующийся в результате электролиза водного раствора Cu(NO3)2 c инертными электродами, имеет ___ среду
1) Щелочную
2) Кислую
3) Нейтральную
4) Зависящую от времени электролиза!
56) Увеличение концентрации растворенного вещества в водном растворе происходит при электролизе раствора…
1) NiBr2
2) CuCl2
3) Na2SO4
4) MgI2
57) Краткое ионное уравнение реакции окисления меди хлоридом железа () имеет вид:
1) Cu0 + 2Fe3+ = Cu2+ + 2Fe2+
2) 3Cu0 + 2Fe3+ = 3Cu2+ = 2Fe0
3) Cu0 + Fe3+ = Cu+ + Fe2+
4) Cu0 + Fe3+ = 3Cu+ + Fe0
58) Согласно схеме гальванического элемента Zn | Zn 2+ || Fe 2+ | Fe
1) цинк восстанавливается
2) цинковый электрод является анодом
3) железный электрод в процессе работы элемента растворяется
4) электроны движутся от железного электрода к цинковому
59) Коэффициент перед окислителем в реакции H 2 S + HNO 3 = S + NO + H 2 O
1) 1
2) 2
3) 3
4) 4
60) В реакции 2 NO 2 + 2 NaOH = NaNO 2 + NaNO 3 + H 2 O ионы натрия
1) окисляются
2) не изменяют степени окисления
3) окисляются и восстанавливаются одновременно
4) восстанавливаются
61) Гидроксид хрома () С r ( OH )3 может проявлять в окислительно – восстановительных реакциях свойства:
1) только окислителя
2) и окислителя и восстановителя
3) только восстановителя
4) ни окислителя ни восстановителя
3) Способы выражения состава растворов. Коллигативные свойства растворов
1. Молярная масса неэлектролита, раствор 11,6 г которого в 200 г воды замерзает при -1,86 ° С ( 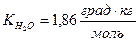 ), равна _____ г/моль.
), равна _____ г/моль.
2) 58
2. Массовая доля метанола в растворе, содержащем 60 г спирта и 40 г воды равна…
3) 0,6
3. Метод определения молярной массы растворенного вещества по понижению температуры замерзания его раствора называется…
3) криоскопией
4. Если водные растворы различных неэлектролитов имеют одинаковую температуру кипения, то это растворы с одинаковой …
1) моляльной концентрацией
5. Для приготовления 2 л 0,1 М раствора NaOH требуется ___ г растворенного вещества
4) 8
6. Моляльная концентрация раствора, содержащего 18 г глюкозы (М (С6Н12О6)=180 г/моль) в 1 кг воды, равна…
1) 0,1 моль
7. Вычислите молярность 20% раствора хлороводородной кислоты. Плотность раствора принять равную 1,10 г/мл
3) 6,03 моль/л
8. Массовая доля растворенного вещества в растворе рассчитывается по формуле:
1) 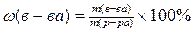
9. Раствор, содержащий 9,2 г этилового спирта в 200 г воды 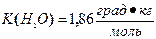 , замерзает при температуре_____ °С
, замерзает при температуре_____ °С
3) –1,86
10. Массовая доля метанола в растворе, содержащем 60 г спирта и 40 г воды равна…
3) 0,6
11. Молярная концентрация раствора, в 2 л которого содержится 4,25 г хлорида лития, равна ______ моль/л.
3) 0,05
12. Укажите верное определение понятия «раствор»
2) это гомогенные системы, состоящие из двух и более компонентов и продуктов их взаимодействия
13. Формула для расчета молярной концентрации имеет вид:
1) 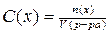
При смешивании воды объемом 50 мл (плотностью 1 г/мл) и метилового спирта объемом 70 мл (плотностью 0,8 г/мл) получили раствор с плотностью 0,9 г/мл. Определите объемную долю метилового спирта в растворе
3) 59,4 %
24. Какую массу медного купороса CuSO 4 ×5 H 2 O и воды надо взять для приготовления раствора сульфата меди ( II ) массой 40 кг с массовой долей CuSO 4 2%?
1) 1,25 кг CuSO4×5H2O и 38,75 кг H2O
3) 46
70. Мольная доля растворенного вещества может быть выражена в …
Процентах
71. Молярная масса вещества, при растворении 2,3 г которого в 100г воды, температура кипения раствора относительно температуры кипения воды повышается на 0,26 градуса(k=0,52 град×кг/моль), составляет
3) 46
72. 500 см3 водного раствора, содержащего 106 г Na2CO3, разбавили дистилированной водой в 2 раза. Молярная концентрация карбоната натрия в полученном растворе составляет____ моль/л
3) 1
73. Водный раствор неэлектролита замерзает при -1,860С. Концентрация вещества в растворе составляет _____ моль/кг. (КН2О=1,86 град×кг/моль)
3) 1
74. В 500 см3 растворили 105 г фторида натрия. Моляльность раствора составляет_____ моль/кг
2) 5
75. После растворения нелетучего вещества в растворителе при температуре 200С давление насыщенного пара растворителя над раствором…
3) понижается
76. К 250 г раствора, содержащего 25 г сульфата калия, добавили 250 см3 дистиллированной воды. Массовая доля растворённого вещества в растворе…
2) уменьшилась в 2 раза
Алкалоз - это
3) смещение рН крови в щелочную область
Ацидоз - это
1)  смещение рН крови в кислую область
смещение рН крови в кислую область
Уменьшается в 4 раза
21. В состоянии химического равновесия скорость прямой реакции ________ скорости обратной реакции.
1) равна
22. Для увеличения скорости прямой реакции 2NO(г) + О2(г)↔2NO2(г) в 1000 раз, необходимо увеличить давление в ____раз
4)10
23. Правило Вант-Гоффа выражает зависимость скорости химической реакции от…
Температуры
24. Введение катализатора в систему приводит к ______ реакции.
ТЕСТЫ к МОДУЛЮ №1 (для итогового рубежного контроля)
Дата: 2018-12-28, просмотров: 1120.