МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УЧЕРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«ГРОДНЕНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ»
КАФЕДРА ХИРУРГИЧЕСКИХ БОЛЕЗНЕЙ №2 С
КУРСОМ УРОЛОГИИ.
В.А.Филиппович
ЛЕКЦИИ ПО УРОЛОГИИ ДЛЯ СТУДЕНТОВ IV КУРСА ГРОДНЕНСКОГО ГОСУДАРСТВЕННОГО МЕДИЦИНСКОГО УНИВЕРСИТЕТА.
пособие для студентов
Гродно, 2008 год
Белок мочи. Обязательным и важным элементом исследования мочи является определение в ней белка. В моче здорового человека белок нельзя обнаружить теми методами исследования, которыми пользуются для его выявления при общем анализе, хотя в суточном объеме мочи в норме его содержится от 10 до 50 мг. Наличие белка даже в минимальных количествах должно настораживать в отношении возможного заболевания почек или мочевых путей. В сомнительных случаях следует определить суточное количество белка, экскретируемого с мочой.
Виды протеинурии.
1.Физиологическая протеинурия. Белок мочи в норме состоит из отдельных фракций белка, профильтровавшихся через клубочковую мембрану и не реабсорбировавшихся полностью эпителием проксимальных канальцев почек. Физиологическая протеинурия возникает под воздействием различных факторов. Разновидностями физиологической протеинурии является:
холодовая (связанная с нарушением кровоснабжения в почках в результате охлаждения), инсоляционная протеинурия (связанная с нарушением кровоснабжения в почках в результате сильной инсоляции кожи), алиментарная (связанная с обильной белковой пищей и усиленным кровообращением в почках), маршевая протеинурия или протеинурия напряжения, связанная с физической нагрузкой, ортостатическая (лордотическая) протеинурия, возникающая у лиц с выраженным лордозом позвоночника при длительном нахождении в вертикальном положении)
При физиологической протеинурии содержание белка в суточной моче колеблется от следов до 200 мг. Основным отличием ее от патологической протеинурии является отсутствие анатомических изменений в почках и структурных изменений нефрона.
Патологическая протеинурия. При данном виде имеются анатомические изменения почек и структурные изменения нефрона.
Сахар (глюкоза) в моче здорового человека отсутствует, за исключением случаев, когда преходящая и незначительная глюкозурия может отмечаться при избыточном употреблении углеводов с пищей либо после внутривенного введения больших доз концентрированного раствора глюкозы. Во всех других случаях присутствие сахара в моче следует расценивать как явление патологическое. Наличие глюкозурии при нормальном уровне сахара в крови может быть обусловлено нарушением реабсорбции глюкозы в проксимальных отделах почечных канальцев вследствие первичного или вторичного поражения ферментных систем канальцевого эпителия.
Метод Нечипоренко. Более простым, доступным и менее трудоемким является подсчет форменных элементов крови в моче методом Нечипоренко. Количество эритроцитов и лейкоцитов определяют в 1 мл мочи. Мочу для исследования берут из средней порции (т. е. больной начинает мочиться в унитаз, затем в специально приготовленную посуду и заканчивает мочеиспускание снова в унитаз), полученной за любой отрезок времени и в любое время суток. Преимущество этого метода по сравнению с методом Каковского-Аддиса в том, что он не обременителен для больного и медицинского персонала, не требует сбора мочи за строго определенный промежуток времени и. результаты можно получить значительно быстрее. В норме у здорового человека в 1 мл мочи обнаруживается не более 2000 лейкоцитов и до 1000 эритроцитов.
Провокационные тесты. Нередко при латентном течении пиелонефрита отсутствуют не только клинические признаки заболевания, но и не выявляется лейкоцитурия как в общем анализе мочи, так и при исследовании ее по Нечипоренко и Каковскому-Аддису. Особенно часто такая ситуация встречается при при одностороннем поражении почек, когда моча из больной почки в мочевом пузыре разбавляется мочой из здоровой. В таких случаях для уточнения диагноза используются провокационные тесты. К числу таких тестов относится преднизолоновый.
Преднизолоновый тест основан на активации воспалительного процесса в почках и, соответственно, увеличении лейкоцитурии при внутривенном введении 30 мг преднизолона. Число лейкоцитов в осадке мочи до и после введения преднизолона определяют по методу Нечипоренко.
Утром больной опорожняет мочевой пузырь, мочу выливают. Через 1 ч собирают контрольную порцию мочи и внутривенно вводят 30 мг преднизолона в 10–20 мл изотонического раствора натрия хлорида. После этого с интервалами в 1 ч больной трижды собирает мочу по описанной методике. Последнюю порцию мочи для исследования по Нечипоренко берут через 24 ч после введения преднизолона.
В каждой порции мочи подсчитывают количество лейкоцитов в 1 мл мочи, а также определяют «активные» лейкоциты.
Если хотя бы в одной из 4-х порций мочи, взятых после введения преднизолона, обнаруживают двукратное увеличение числа лейкоцитов в осадке мочи по сравнению с контролем, а также «активные» лейкоциты, пробу считают положительной. Положительный преднизолоновый тест указывает на наличие скрытого воспалительного процесса в почках или мочевыводящих путях (пиелонефрит, цистит, уретрит, простатит и др.).
Проба Реберга-Тареева. В 1926 г. Реберг предложил определять скорость клубочковой фильтрации по экзогенному креатинину. Однако этот метод представлял определенные трудности, связанные с необходимостью внутривенного введения экзогенного креатинина. В 1936 г. Е. М. Тареев предложил исследовать скорость клубочковой фильтрации по клиренсу эндогенного креатинина. Было установлено, что концентрация креатинина в плазме крови не подвергается существенным колебаниям и практически постоянна. Поэтому отпала необходимость внутривенного введения экзогенного креатинина, что значительно упростило методику исследования клубочковой фильтрации. Определение скорости клубочковой фильтрации по клиренсу эндогенного креатинина называют также пробой Реберга-Тареева.
Чтобы определить скорость клубочковой фильтрации F по клиренсу эндогенного креатинина, необходимо знать концентрацию креатинина в плазме крови, в моче и минутный диурез: F = (U/P)V.
Методика определения скорости клубочковой фильтрации.
Утром, сразу после сна, больной выпивает 300-400мл (1,5-2 стакана) воды или некрепкого чая (для получения достаточного минутного диуреза) и спустя 10-15 мин мочится в унитаз. Точно отмечает время окончания мочеиспускания, ложится в постель и строго через час мочится в отдельную посуду (I порция мочи). Снова точно замечает время окончания мочеиспускания и через час собирает вторую порцию мочи в отдельную посуду. В середине сбора мочи из вены берут 6-8 мл крови. В лаборатории в каждой часовой порции определяют объем мочи и вычисляют минутный диурез. Кроме того, в каждой из двух часовых порций мочи и в плазме крови определяют концентрацию креатинина. Затем по формуле для каждой порции мочи вычисляют клиренс эндогенного креатинина:
F1 = (U1/P)V1,
где FI - клубочковая фильтрация; U1 - концентрация креатинина в моче; VI - минутный диурез в первой порции мочи; Р - концентрация креатинина в плазме крови.
Аналогично определяют скорость клубочковой фильтрации по второй порции мочи:
F2 = (U2/P)V2.
Показатели клубочковой фильтрации, определяемые по первой и второй порциям мочи, обычно неидентичны
Определение скорости клубочковой фильтрации имеет большую практическую ценность, так как снижение этого показателя является наиболее ранним признаком начинающейся хронической почечной недостаточности
Каналъцевую реабсорбцию, которая отражает суммарную концентрационную функцию (проксимальных и дистальных отделов канальцев), можно определить по следующей формуле:
R = (F - V)/F • 100 %,
где R - канальцевая реабсорбция; F - клубочковая фильтрация; V - минутный диурез.
В норме канальцевая реабсорбция составляет 98-99 %, однако при большой водной нагрузке даже у здоровых людей может уменьшаться до 94-92 %. Снижение канальцевой реабсорбции рано наступает при пиелонефрите, гидронефрозе, поликистозе.
По локализации
Инфекции верхних мочевыводящих путей (пиелонефрит, острый и хронический)
Инфекции нижних мочевыводящих путей (цистит, уретрит, бактериальный простатит)
По характеру течения
Неосложненные
Осложненные
Неосложненные инфек ции возникают при отсутствии структурных изменений в почках и мочевыводящих путях у больных без серьезных сопутствующих заболеваний; они, как правило, наблюдаются в амбулаторной практике.
Осложненные инфекции возникают у больных с различными обструктивными уропатиями (мочекаменная болезнь, аномалии развития почек, стриктуры мочеточника или уретры, доброкачественная гиперплазия предстательной железы и др.), на фоне катетеризации мочевого пузыря, а также у больных с сопутствующей патологией (сахарный диабет, иммуносупрессивная терапия и др.).
Внебольничные инфекции (возникают в амбулаторных условиях).
Нозокомиальные инфекции (развиваются после 48 ч пребывания пациента в стационаре).
К атетер-ассоциированные инфекции (инфицирование происходит в стационаре в результате катетеризации мочевого пузыря, часто антибиотикорезистентными госпитальными штаммами, однако большинство подобных инфекций исчезает вскоре после удаления катетера).
ПИЕЛОНЕФРИТ.
Пиелонефрит - инфекционно-воспалительный неспецифический процесс, первично поражающий интерстициальную ткань, канальцы, лоханку и чашечки почки. В конечной стадии он распространяется на кровеносные сосуды и клубочки.
Этиология.
• E. coli -75%
• Proteus - 8%
• Klebsiella - 6%
• Enterococci - 3%
• Staphylococci -3%
• другие - 5%.
Проникновение инфекции в почку может осуществляться:
1)Уриногенно через поврежденные форникальные синусы или канальцевым путем. В этом случае наблюдаются очаги инфекции, распостраняющиеся веерообразно в виде клиньев от лоханки до поверхности почки
2)Гематогенно – через клубочки в капилярную сеть мозгового вещества а оттуда в интерстициальную ткань. Воспалительные очаги располагаются преимущественно в корковом веществе вокруг внутридольковых сосудов.
Гематогенный и уриногенный пути проникновения часто сочетаются
Почечные рефлюксы открывают пути для восходящей инфекции из лоханки в межуточную ткань почки. Благодаря пиеловенозным и пиелолимфатическим рефлюксам происходит инфицирование почки гематогенным путем – микрофлора лоханки попадает в общий ток крови по венозной системе и возвращается в почку по артериальной.
Лоханочная гипертензия приводит к нарушению почечной гемодинамики и лимфатическому стазу в интерстиции, что способствует развитию гнойно-воспалительного процесса и облегчает проникновение микроорганизмов из почки в общий ток крови.
Уросепсис - синдром мультиситемной дисфункции, обусловленный воспалительным процессом, локализованным в мочевых путях, инвазией микроорганизмов или их токсинов в кровяное русло с последующим развитием болезненного состояния, вызванного системным воспалительным ответом на инфекцию.
При остром гнойном пиелонефрите инфекция попадает в кровь двояким путем – посредством рефлюксов и гематогенно – вследствие массивного неконтролируемого размножения микробов в паренхиме почки с деструкцией сосудов. Бактериемия и эндогенная токсемия приводит к вторичной иммунодепрессии и резкому снижению естественной реактивности с нарушением гомеостаза. При уросепсисе возникает дефицит факторов иммунной защиты, которых становится недостаточно для предотвращения повреждающих действий микробов и токсинов на основные физиологические системы, в том числе на иммунную.
ЦИСТИТЫ
Циститом называют острые или хронически текущие воспалительные процессы в слизистой оболочке мочевого пузыря. Иногда в патологический процесс вовлекается вся стенка мочевого пузыря. Циститы являются наиболее частыми урологическими заболеваниями, из-за которых больные обращаются к врачам скорой и неотложной медицинской помощи, к терапевтам, урологам, гинекологам, иногда к хирургам. Чаще заболевают женщины, что связано с анатомо-морфологическими и гормональными особенностями их организма.
Классификации циститов (О.Л. Тиктинский )
1. По течению болезни различают острый и хронический цистит.
2. По происхождению различают первичный и вторичный: при пиелонефрите, при заболеваниях мочевого пузыря, предстательной железы, уретры.
3. По этиологии и патогенезу различают инфекционный, химический, лучевой, паразитарный, при сахарном диабете, у спинальных больных, аллергический, обменный, ятрогенный, цистит после аденомэктомии, нейрогенный.
4. По локализации и распространенности воспалительного процесса: диффузный, шеечный, тригонит.
5. По характеру морфологических изменений: катаральный, геморрагический, язвенный и фиброзно-язвенный, гангренозный, инкрустирующий, опухолевый, интерстициальный.
Симптомы и течение
Ведущим симптомом острого цистита является учащенное болезненное мочеиспускание, возникающее, обычно внезапно на фоне переохлаждения. Боли при мочеиспускании достаточно быстро усиливаются, к ним присоединяется тянущая боль внизу живота. Моча становится мутной, нередко в ней обнаруживается примесь крови. Больные жалуются на жжение при мочеиспускании, невозможность удерживать мочу. Острый цистит часто сопровождается повышением температуры до субфебрильных цифр и ознобом. В клинической практике встречаются случаи легкого течения заболевания, характеризующиеся только болями внизу живота. Симптомы острого цистита могут исчезать самопроизвольно, без какого либо лечения через 2-3 дня после начала заболевания.
Клиническая картина хронического цистита в значительной степени обусловлена первичным заболеванием, вызвавшим воспалительный процесс в мочевом пузыре, что приводит к разнообразию имеющихся симптомов. Хронический цистит может иметь рецидивирующее течение, в ходе которого наблюдается постоянная смена периода покоя с периодами обострения заболевания. Клиника хронического цистита в период обострения мало отличается от клиники острого воспаления мочевого пузыря. Встречается также вялотекущий цистит, протекающий без выраженных обострений, но с постоянными жалобами больных на учащенное и несколько болезненное мочеиспускание, слабость и периодические подъемы температуры тела до субфебрильных цифр.
В большинстве случаев постановка диагноза цистита затруднения не представляет. Так как острый цистит и хронический цистит в стадии обострения сопровождаются характерными жалобами на частые болезненные мочеиспускания с резью, имеют значение анамнестические данные на внезапное острое начало и быстрые нарастания признаков с максимальной их выраженностью в первые дни (при остром цистите) или на ранее существовавший цистит (при хроническом цистите).
При исследовании мочи выявляются объективные признаки цистита в виде лейкоцитурии и гемматурии. Глубокая пальпация надлобковой области болезненна. При воспалении нижней стенки мочевого пузыря и при выраженном локальном воспалении его шейки пальпация со стороны прямой кишки и со стороны влагалища тоже резко болезненна.
В диагностике хронического цистита и выявлении причин, поддерживающих воспаление, важнейшее значение имеют цистоскопия и цистография. При этом определяют степень поражения мочевого пузыря, форму цистита, наличие опухоли, мочевого камня, инородного тела, дивертикула, свища, язв. В ряде случаев во время цистоскопии обнаруживают сопутствующие циститу признаки заболевания почек и мочеточников. Цистоскопию можно выполнить при условии удовлетворительной проходимости уретры, достаточной емкости мочевого пузыря – не менее 50 мл и прозрачности в нем среды. Для изучения конфигурации мочевого пузыря и выявления в нем патологических процессов применяют контрастную цистографию с помощью введения в него йодсодержащих препаратов, взвеси сульфата бария, кислорода или углекислого газа. Наиболее физиологичной является нисходящая цистография, которую получают через 20-30 минут после внутривенного введения рентгеноконтрастного препарата. Восходящая (ретроградная) цистография осуществляется путем введения в мочевой пузырь рентреноконтрастной жидкости по уретре или уретральному катетеру, или надлобковому дренажу.
Биопсия слизистой оболочки мочевого пузыря, как правило, проводится больным с хроническим циститом, а также с целью дифференциальной диагностики.
Лечение.
Лечение цистита чаще всего проводят в домашних условиях. Слизистая оболочка мочевого пузыря достаточно быстро восстанавливается и заболевание бесследно проходит.
Обязательно назначаются антибиотики (монурал или фторхинолоны). Всем больным циститом рекомендуется соблюдать постельный режим вплоть до полного исчезновения боли. Диета назначается с исключением острой, кислой, жирной и жареной пищи, крепкого кофе и алкогольных напитков. Необходимость соблюдения диеты при цистите объясняется тем, что любая агрессивная пища раздражает слизистую оболочку мочевого пузыря, провоцируя обострение заболевания. Больным рекомендуется молочная пища, фрукты и овощи.
Ниже при ведены рекомендации Европейской Ассоциации урологов по лечению острого цистита (2006 год).
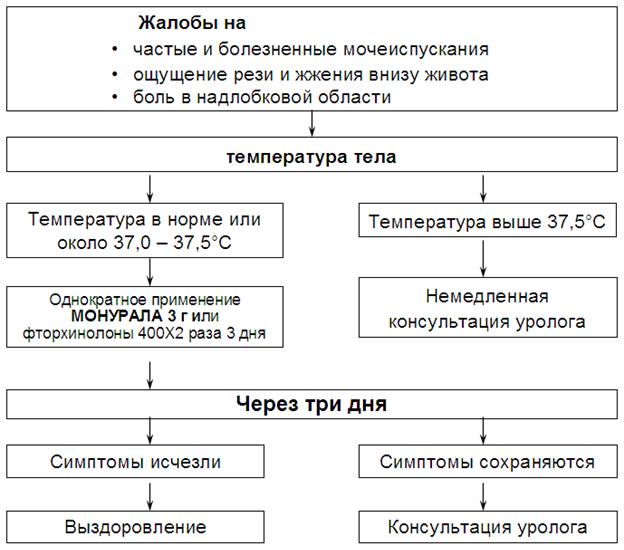
Лечение хронического цистита включает в себя не только терапию самого воспаления мочевого пузыря (аналогично лечению острого цистита), но и комплекс мер, направленных на устранение основного заболевания. Режим больного, и его диета в период обострения хронического цистита, такие же, как и при остром цистите. В современных условиях для лечения циститов применяют ионофорез, УВЧ, индуктотермию и другие физиотерапевтические процедуры. Больным хроническим циститом показано санаторно-курортное лечение в Боржоми, Ессентуках, Трускавце и Железноводске.
Для лечения цистита широко применяется фитотерапия - лечение отварами и настоями сборов лекарственных трав. Для лечения применяются различные сборы, включающие ромашку, зверобой, подорожник, полевой хвощ, аир болотный, толокнянку и другие. Фитотерапия в сочетании с диетой и согревающими процедурами часто оказывается достаточно эффективной как для лечения острого цистита, так и для ликвидации обострений при хроническом течении заболевания.
УРЕТРИТЫ
Уретрит – воспаление слизистой оболочки мочеиспускательного канала.
Это очень распространенное урологическое заболевание. Часто уретриты возникают после полового контакта с больным человеком. Довольно долго уретрит может протекать малосимптомно или бессимптомно, при этом больной продолжает заражать своих половых партнеров. При инфекционном уретрите инкубационный период и характер его течения во многом зависит от того, какими инфекциями он вызван. При гонорейном уретрите инкубационный период составляет до 7 дней (в редких случаях достигает нескольких недель), при прочих возбудителях инкубационный период значительно варьирует. В очень редких случаях уретрит может быть вызван внутренними повреждениями уретры в результате различных физических манипуляций.
Причин развития уретрита достаточно много, в зависимости от этого их классифицируют следующим образом (классификация по Тиктинскому О.Л.)
- Инфекционные уретриты
1. Бактериальный уретрит
2. Вирусный уретрит
3. Обусловленный микоплазмами уретрит
4. Уреаплазменный уретрит
5. Хламидийный уретрит
6. Обусловленный генитальным герпесом уретрит
7. Гарднереллезный уретрит
8. Смешанный уретрит
9. Микотический (кандидозный) уретрит
- Неспецифические уретриты
1. Гонорейный уретрит
2. Трихомонадный уретрит
3. Трихомонадный, сочетающийся с урогенитальной инфекцией уретрит
- Неинфекционные уретриты
1. Травматический (катетеризация) уретрит
2. Аллергический уретрит
3. Вызванный наличием заболеваний уретры уретрит
4. Обменный уретрит
5. Застойный (конгестивный) уретрит
Симптомы уретрита.Симптомами уретрита является в первую очередь жжение, боль и резь при мочеиспускании, и выделения из уретры. Достаточно обильные выделения из уретры, как правило, происходят по утрам и имеют серовато-желтый оттенок при гонорейном уретрите, светлыми и белесыми при трихомонадном уретрите, гнойными при бактериальном уретрите. У мужчин часто наблюдается раздражение, покраснение и слипание губок мочеиспускательного канала (уретры). Неприятные ощущения, как мы уже говорили выше, на первых этапах заболевания могут быть незначительными, но при этом воспалительные процессы в уретре протекают достаточно активно и могут иметь восходящий характер – воспаление может прейти на другие половые органы мужчин и женщин.
Все больные уретритами в обязательном порядке обследуются на заболевания, передающиеся половым путем.
Лечение может включать в себя следующие виды терапевтических действий:
- Медикаментозная терапия
- Физиотерапия
Методы лечения камней.
Все методы направлены на удаление камня из соответствующего отдела мочевой системы. Поскольку характеристики камней весьма разнообразны (размер, форма, состав, локализация), а клиническое течение МКБ обусловлено различными факторами: наличием метаболических нарушений и ассоциированных с камнеобразованием заболеваний, наличием или отсутствием инфекционных осложнений, наличием или отсутствием нарушений уродинамики и аномалий мочевых путей и других, то и методы лечения камней весьма разнообразны. Следует понимать, что удаление камня в подавляющем большинстве случаев означает лишь устранение симптома заболевания, но не излечение больного от мочекаменной болезни. Выделяют следующие методы:
Консервативные:
- купирование почечной колики
- камнеизгоняющая терапия (стимуляция литокинеза)
- пероральный литолиз камня (камнерастворяющая терапия)
- профилактика и метафилактика камнеобразования
Инструментальные (аппаратные):
-Экстракорпоральная (дистанционная) ударно-волновая литотрипсия
Эндоскопические:
-Контактная ударно-волновая литотрипсия
-Эндоскопическая уретеролитотрипсия и литоэкстракция
-механическая литотрипсия (цистолитотрипсия)
Консервативная терапия
Консервативная терапия не рассматривается как альтернатива удалению камня одним из современных методов оперативного лечения: перкутанная нефролитотрипсия, дистанционная литотрипсия, открытое оперативное лечение. Консервативная терапия, длительность которой определяется индивидуально, является одним из этапов в комплексном лечении больного.
Камнеизгоняющая терапия. При наличии камней, имеющих тенденцию к самостоятельному отхождению, применяют препараты группы терпенов (цистенал, артемизол, энатин, ависан, уролесан, олиметин, марелин, фитолит, цистон, фитолизин, ниерон, урофлюкс, роватинекс, кеджибеллинг и др.). Некоторые из них также повышают концентрацию защитных коллоидов в моче, препятствующих кристаллизации солей в условиях перенасыщения ими. Эти препараты обладают бактериостатическим, спазмолитическим и седативным действием. Цистенал и артемизол назначают по 4—5 капель на сахаре за 30—60 мин до еды 3 раза в день, энатин — по 1 г в капсулах, ависан — по 0,05 г в таблетках 3—4 раза в день. Очень эффективным бывает физиотерапевтическое лечение. Аппаратная физиотерапия, в основном, применяется для стимуляции уродинамики верхних мочевых путей, с целью ускорения самостоятельного отхождения мелких конкрементов, солей, слизи с мочой. Проведенные экспериментальные исследования показали, что физические факторы (синусоидальные модулированные токи (СМТ), ультразвук (УЗ) и импульсное низкочастотное магнитное поле (ИНЧМП)) стимулируют биоэлектрическую активность гладкой мускулатуры мочеточников при воздействии на область проекции почек и нижней трети мочеточников, а также при внутриполостном воздействии. При этом частота и амплитуда биопотенциалов гладкой мускулатуры мочеточников увеличивается в 1,5—3 раза при внутриполостном (ректальном) воздействии УЗ и СМТ по сравнению с их накожным применением. Использование вышеперечисленных физических факторов (СМТ, УЗ, ИНЧМП) в качестве монотерапии при мочекаменной болезни оказывает стимулирующее действие на уродинамику верхних мочевых путей, вызывает противовоспалительный эффект, улучшает функциональное состояние почек и мочевых путей. Аппаратная физиотерапия может применяется в комплексе с питьем минеральной воды, минеральными ваннами, лечебной физической культурой. Комплексное применение аппаратной физиотерапии, питья минеральной воды, минеральных ванн и ЛФК способствует суммации лечебного действия каждого физического фактора, что значительно повышает эффективность лечения больных мочекаменными диатезами и МКБ. Эффективность литокинетической терапии зависит от степени активности пиелонефрита и нарушения уродинамики верхних мочевых путей. Отхождение конкрементов усиливается в фазе ремиссии хронического пиелонефрита за счет лучшей возбудимости нервно-мышечного аппарата гладкой мускулатуры верхних мочевых путей, усиливающей их сократительную функцию.
Пероральный литолиз камня (камнерастворяющая терапия). Данный вид терапии применяется для растворения камней из мочевой кислоты. Мочевая кислота характеризуется ограниченной растворимостью и слабо-кислыми свойствами. Эффект растворения уратных камней в основном зависит от рН мочи, и оптимальные значения лежат в пределах 6.2-6.8. При таком рН мочи происходит растворение мочевой кислоты за счет замещения водорода гидроксильных групп во 2-м и 6-м положениях пуринового ядра на щелочные металлы, преимуществанно калий, с образованием легко растворимых солей мочевой кислоты. Такие значения легко достигаются при применении цитратных смесей. Цитратные смеси состоят из комбинации лимонной кислоты, гидрокарбоната калия, натриевой соли лимонной кислоты. Представителями данной группы являются блемарен, уралит, магурлит.
Показания.
Коррекция метаболических нарушений при почечнокаменной болезни показана больным, подвергшимся различным видам элиминации камня (дистанционная литотрипсия, эндоскопические или открытые операции), у которых диагностированы в сыворотке крови или моче нарушения обменных процессов, этиологически значимых в мочевом камнеобразовании. Особое внимание следует уделить больным МКБ с наличием факторов риска, к которым относятся:
- Начало мочекаменной болезни в детском или молодом возрасте. У 63% больных, у которых нефролитиаз диагностирован ранее 25 лет, обнаруживаются те или иные метаболические отклонения.
- Формирование камней из кальция гидроген фосфата (брушита). Данный тип конкрементов чаще образуется при дистальном почечно-канальцевом ацидозе (ПКА).
- Единственная функционирующая почка,
- Наличие болезней, ассоциирующихся с формированием мочевых камней: гиперпаратиреоз, гипертиреоз, почечно-канальцевый ацидоз (полный и неполный), синдром мальабсорбции (болезнь Крона, тонкокишечный обводной анастомоз и др.), саркоидоз, подагра.
- Длительный приём медикаментов, которые могут приводить к формированию мочевых камней: препараты кальция, витамин Д, аскорбиновая кислота в дозе более 4 грамм в сутки, ацетазоламид, сульфаниламиды, триамтерен, индинавир.
- Наличие анатомических аномалий, ассоциирующихся с нефролитиазом: дисплазия собирательных трубочек (губчатая почка), обструкция лоханочно-мочеточникового сегмента, дивертикул или киста чашечки, стриктура мочеточника, пузырно-мочеточниковый рефлюкс, подковообразная почка, уретероцеле. Нарушение уродинамики верхних мочевых путей выступает этиологическим фактором уролитиаза в 10% случаев. Эта группа больных требует хирургического лечения и восстановления нормального пассажа мочи.
Диагностика метаболических нарушений позволит выявить вероятные причины камнеобразования в почке (гиперкальциурия, гипероксалурия, гиперурикозурия, гиперцистинурия, гиперфосфатурия, гипоцитратурия, гипомагнийурия, ПКА) и применить дифференцированный подход по их коррекции с целью снижения частоты рецидивов.
При проведении метаболической диагностики у больных обнаруживаются различные типы метаболических нарушений этиологически значимых в мочевом камнеобразовании. В соответствии с типом метаболических нарушений назначаются различные методы коррекции, позволяющие снизить степень сатурации литогенных субстанций в моче и повысить в ней концентрацию ингибиторов кристаллизации и агрегации. Различают медикаментозные и немедикаментозные методы коррекции.
Учитывая многочисленность типов нарушений обменных процессов при нефролитиазе и разнообразие методов их терапии, предлагается следующая дифференцированная схема коррекции метаболических нарушений.
Гиперкальциурия - мочевая экскреция кальция более 300 мг в сутки у мужчин и 250 мг в сутки у женщин (4 мг/кг/сут).
Медикаментозная терапия. В зависимости от типа гиперкальциурии рекомендуются следующие лекарственные препараты:
Абсорбтивный тип гиперкальциурии.
1. Тиазидные диуретики. Гидрохлортиазид 0,025 по 1-2 таблетки в сутки в течение 2,5-3 месяцев каждые полгода. Тиазиды оказывают прямое действие на кальциевые каналы эпителия дистальных канальцев нефронов, что приводит к усилению реабсорбции кальция и секреции натрия. Кроме того, на фоне приёма тиазидов уменьшается всасывание кальция из кишечника, повышается мочевая экскреция магния и цинка, увеличивается суточный диурез.
2. Ортофосфаты. Данная группа препаратов используется как вторая линия терапии или при непереносимости тиазидов. Назначается нейтральный ортофосфат калия по 1 грамму в 150мл воды 3-4 раза в сутки. Он уменьшает продукцию 1,25-дигидроксикальциферола, что приводит к снижению всасывания кальция из кишечника.
3. Препараты магния. Магниевая соль аспарагиновой кислоты 0,158 («Панангин», «Аспаркам») по 1 таблетке 2 раза в сутки в течение 2,5-3 месяцев каждые полгода. Магний является ингибитором кристаллизации и агрегации оксалата кальция и комплексором оксалата в моче.
4. Алкализирующие цитратные смеси. Смеси, содержащие в разных пропорциях цитрат натрия, цитрат калия, цитрат магния («Блемарен» и др.), принимаются в индивидуально адаптированной дозе под контролем рН мочи в пределах 6,2-7,0 в течение 2,5-3 месяцев каждые полгода. Цитрат является комплексором кальция в моче, снижает сатурацию оксалата и фосфата кальция, мочевой кислоты, является ингибитором кристаллизации и агрегации.
Почечный тип гиперкальциурии.
1. Тиазидные диуретики. Гидрохлортиазид 0,025 по 1-2 таблетки в сутки в течение 2,5-3 месяцев каждые полгода.
2. Препараты этидроновой кислоты («Ксидифон») в суточной дозе 10мг на кг массы тела в течение 2,5-3 месяцев каждые полгода.
3. Препараты магния. Магниевая соль аспарагиновой кислоты 0,158 («Панангин», «Аспаркам») по 1 таблетке 2 раза в сутки в течение 2,5-3 месяцев каждые полгода.
4. Алкализирующие цитратные смеси. Смеси, содержащие в разных пропорциях цитрат натрия, цитрат калия, цитрат магния («Блемарен» и др.), принимаются в индивидуально адаптированной дозе под контролем рН мочи в пределах 6,2-7,0 в течение 2,5-3 месяцев каждые полгода.
Резорбтивный тип гиперкальциурии.
1. Препараты, содержащие кальцитонин («Миакальцик») 50МЕ подкожно или внутримышечно 3 раза в неделю в течение 1 месяца каждые полгода.
2. Препараты группы амино-бисфосфонатов. Алендронат натрия («Фосамакс») 0.01 по 1 таблетке в сутки в течение 2 недель каждые полгода. Препараты клодроновой кислоты («Бонефос») 0,4 по 1-2 капсулы 2 раза в сутки в течение 10 дней, препараты этидроновой кислоты («Ксидифон») в суточной дозе 10мг на кг массы тела в течение 2,5-3 месяцев каждые полгода. Эта группа препаратов эффективно снижает активность остеокластов и связывает гидроксиапатит в костной ткани.
Больным с МКБ, у которых диагностирован первичный гиперпаратиреоз, рекомендовано удаление аденомы паращитовидных желез. После оперативного лечения ремиссия по нефролитиазу наблюдается у 90-100% пациентов.
Гипероксалурия - экскреция щавелевой кислоты с мочой более 40 мг в сутки.
Медикаментозная терапия.
1. Препараты магния. Магниевая соль аспарагиновой кислоты 0,158 («Панангин», «Аспаркам») по 1 таблетке 2 раза в сутки в течение 2,5-3 месяцев каждые полгода.
2. Алкализирующие цитратные смеси. Смеси, содержащие в разных пропорциях цитрат натрия, цитрат калия, цитрат магния («Блемарен» и др.), принимаются в индивидуально адаптированной дозе под контролем рН мочи в пределах 6,2-7,0 в течение 2,5-3 месяцев каждые полгода.
3. Пиридоксин (витамин В6) в таблетках по 0,04г. По 1 таб. 2 раза в сутки в течение 2,5-3 месяцев каждые полгода. Пиридоксин выступает кофактором в трансаминировании глиоксиловой кислоты в глицин, что уменьшает синтез щавелевой кислоты.
Гиперурикозурия - при суточной экскреции мочевой кислоты более 800 мг у мужчин и 750 мг у женщин.
Медикаментозная терапия.
1. Ингибиторы ксантиноксидазы. Аллопуринол («Милурит») назначается в суточной дозе 100-300 мг в течение 2,5-3 месяцев каждые полгода. Снижая активность ксантиноксидазы, эта группа препаратов тормозит синтез мочевой кислоты из ксантина.
2. Алкализирующие цитратные смеси. Смеси, содержащие в разных пропорциях цитрат натрия, цитрат калия, цитрат магния («Блемарен» и др.), принимаются в индивидуально адаптированной дозе под контролем рН мочи в пределах 6,2-7,0 в течение 2,5-3 месяцев каждые полгода.
Гиперфосфатурия (при мочевой экскреции фосфата более 42 ммоль в сутки) и инфекционный нефролитиаз.
Медикаментозная терапия.
1. Антибактериальная терапия. Вид и доза антибиотика подбирается индивидуально согласно антибактериальной чувствительности выделенной из мочи микрофлоры. После элиминации инфекционного конкремента рекомендуется стандартный двухнедельный курс антибиотикотерапии с последующим бактериологическим исследованием через 1 месяц.
2. Метионин 0,5г в суточной дозе 1,5 грамма в течение 2,5-3 месяцев каждые полгода.
Почечно-канальцевый ацидоз (ПКА) I типа.
Для диагностики ПКА I типа используется тест с мониторированием рН мочи до и после приема хлорида аммония 0,1 г/кг веса однократно. У больных с почечно-канальцевым ацидозом рН мочи не опускается ниже 6,0 при полном ПКА и 5,5 при неполном ПКА I типа.
Медикаментозная терапия.
1. Алкализирующие цитратные смеси. Смеси, содержащие в разных пропорциях цитрат натрия, цитрат калия, цитрат магния («Блемарен» и др.), принимаются в индивидуально адаптированной дозе под контролем рН мочи в пределах 6,2-7,0 в течение 2,5-3 месяцев каждые полгода.
2. Препараты группы амино-бисфосфонатов. Алендронат натрия («Фосамакс») 0.01 по 1 таблетке в сутки в течение 2 недель каждые полгода. Препараты клодроновой кислоты («Бонефос») 0,4 по 1-2 капсулы 2 раза в сутки в течение 10 дней. Препараты этидроновой кислоты («Ксидифон») в суточной дозе 10мг на кг массы тела в течение 2,5-3 месяцев каждые полгода.
3. Бикарбонат натрия в суточной дозе 0,1г на кг веса пациента.
Гиперцистинурия - при мочевой экскреции цистина более 80 мг в сутки.
Медикаментозная терапия.
1. Алкализирующие цитратные смеси. Смеси, содержащие в разных пропорциях цитрат натрия, цитрат калия, цитрат магния («Блемарен» и др.), принимаются в индивидуально адаптированной дозе под контролем рН мочи более 7,5 в течение 2,5-3 месяцев каждые полгода.
2. При суточной экскреции цистина менее 3,5 ммоль назначается аскорбиновая кислота в дозе 3-5 грамм в сутки, при экскреции цистина более 3,5 ммоль – каптоприл в суточной дозе 75-150мг (в зависимости от степени цистинурии). Эти препараты образуют в моче с цистином хелатные комплексы, переводя цистин в растворимую дисульфидную форму.
3. Бикарбонат натрия в суточной дозе 0,1-0,2г на кг веса пациента.
Гипоцитратурия - при мочевой экскреции цитрата менее 350 мг в сутки.
Гипоцитратурия как возможный причинный фактор нефролитиаза была заподозрена в 15-63% случаев МКБ, причём, как изолированный фактор она диагностируется у 10% больных. У этих пациентов суточная экскреция цитрата составляет менее 220 мг. Под гипоцитратурией понимают экскрецию цитрата с мочой менее 0,6 ммоль в сутки у мужчин и менее 1,03 ммоль в сутки у женщин. По данным литературы основными причинными факторами гипоцитратурии являются: метаболический ацидоз, гипокалийемия, повышенная реабсорбция цитрата почечными канальцами, чрезмерная физическая нагрузка.
Медикаментозная терапия. Алкализирующие цитратные смеси. Смеси, содержащие в разных пропорциях цитрат натрия, цитрат калия, цитрат магния («Блемарен» и др.), принимаются в индивидуально адаптированной дозе под контролем рН мочи в пределах 6,2-7,0 в течение 2,5-3 месяцев каждые полгода.
Гипомагниурия - при мочевой экскреции магния менее 50 мг в сутки.
Нефролитиаз сопровождается гипомагниурией примерно у 30-50% больных МКБ. Магний является активатором многих ферментов, оказывает влияние на синтез щавелевой кислоты в печени, повышает растворимость фосфата кальция. Магний регулирует стабильность мочи как пересыщенного раствора, выступая ингибитором кристаллизации. Он также является комплексором для оксалата, образуя с ним в моче растворимые соединения.
Медикаментозная терапия. Препараты магния. Магниевая соль аспарагиновой кислоты 0,158 («Панангин», «Аспаркам») по 1 таблетке 2 раза в сутки в течение 2,5-3 месяцев каждые полгода.
Противопоказаний к проведению коррекции метаболических нарушений у больных с мочекаменной болезнью не существует. При возникновении непереносимости (побочных эффектов) к одному из лекарственных препаратов его исключают из схемы и используют другие виды немедикаментозной и медикаментозной коррекции, рекомендуемых для данного типа нарушений.
Средства, приводящие к активации уродинамики и стимулирующие литокинез (самостоятельное отхождение камней)
Применяются при конкрементах, которые могут самостоятельно отойти, в основном, когда они не нарушают отток мочи и не вызвали гидронефротической трансформации или не осложнились атакой острого пиелонефрита.
Экстрат марены красильной (в табл. по 0,25 г) по 2-3 таблетки 3-4 р. в сутки (оказывает диуретическое и спазмолитическое действие, способствует разрыхлению мочевых конкрементов, содержащих фосфаты кальция и магния). Марена окрашивает мочу в красноватый цвет, при резком окрашивании в буро-красный цвет — уменьшают дозу или временно прекращают прием препарата. Курс — 20-30 дней (при необходимости повторяют через 4-6 недель).
Цистенал — комплексный препарат, содержащий настойку корня марены, магния салицилата, масел эфирных, спирта этилового, масла оливкового. Оказывает спазмолитическое и умеренное мочегонное действие, расслабляет мускулатуру мочеточников и облегчает прохождение мелких конкрементов. Назначают внутрь по 4-5 капель на сахаре 3 р. в сутки за 12 — 1 ч до еды. При приступе колик — однократно 20 капель. Противопоказания: гломерулонефриты, МКБ с нарушением функции почек, язвенная болезнь желудка.
Олиметин — комплексный препарат, содержащий эфирные масла. Применяют для лечения (по 2 капсуле 3-5 раз в день) и профилактики МКБ и ЖКБ (по 1 капсуле в день в течение длительного времени). По составу и механизму действия олиметин сходен с зарубежными препаратами — Энатин, Роватин, Ровахол. Противопоказания: гломерулонефриты, язвенная болезнь желудка, гепатиты.
Ависан — растительный препарат, обладает избирательным спазмолитическим действием на гладкую мускулатуру мочеточников, предложен в качестве спазмолитика при почечной колике и спазмах мочеточника, при циститах уменьшает дизурические явления. Применяют внутрь по 1-2 таблетке 3-4 раза в день после еды. Курс лечения 1-3 недели.
Пинабин — раствор эфирных масел, полученных из хвои сосны или ели. Оказывает спазмолитическое действие на мускулатуру мочевыводящих путей, обладает некоторым бактериостатическим действием в отношении грамм положительных бактерий. При почечной колике и МКБ по 5 капель 3 раза в день на сахаре за 15-20 ' до еды. Курс лечения 4-5 недель.
Уролесан — растительный препарат. Применяют при ЖКБ и МКБ, калькулёзных пиелонефритах и холециститах, дискинезии желчевыводящих путей (оказывает спазмолитическое действие, способствует отхождению камней, уменьшает воспалительные явления в мочевых путях, усиливает желчеобразование и желчевыведение. Внутрь по 8-10 капель 3 раза в день перед едой. Курс от 5 дней до 1 месяца. При коликах по 20 капель на приём.
Фитолизин — растительная паста. Оказывает мочегонное, противовоспалительное, спазмолитическое действие, разрыхляет конкременты и удаляет их с мочой. Разрыхление конкрементов происходит медленно. Принимают по 1 чайной ложке в полстакане подслащённой воды 3 раза в день после еды.
Трава горца птичьего (спорыша) способствует отхождению конкрементов при МКБ, оказывает умеренное противовоспалительное действие. Внутрь в виде настоя по 2 столовых ложки 3 раза в день перед едой.
ОПУХОЛИ ПОЧЕК.
По данным Белорусского канцеррегистра (Злокачественные новообразования в Беларуси. Минск, 2003) заболеваемость злокачественными новообразованиями почки в Республике Беларусь составила 8,6 на 100 000 жителей в 1993 году и 13,8 – в 2002 году. В 1993 году было выявлено 877 новых случаев опухолей и 1375 – в 2002 году. Отмечается рост заболеваемости во многих странах. В 90-х годах абсолютное число впервые зарегистрированных случаев составляло ежегодно в США 24–28 тыс., России — 7,5–10 тыс., Украине — 3,5–4 тыс. В 2002 году отмечалось уже 31,8, 14,2 и 4,8 тыс. соответственно. Ежегодный темп прироста заболеваемости в 90-е годы составлял в США 2–3 %, в России и Украине — 6–10 %.
Рак почки – злокачественное образование почечной ткани (паренхимы), развивающееся из эпителия почечных канальцев. На его долю приходится до 97% опухолей почек. Наиболее употребительным термином его обозначения является «почечно-клеточный рак».
Эпидемиология рака почки. В структуре онкологической заболеваемости населения году рак почки составиляет около 4% и занимает 10 место по уровню заболеваемости у взрослых.
На опухоли почек приходится до 40% от всей онкологической патологии детского возраста.
В Гродненской области в 2005 году выявлен 181 больной, на учете -1092 человека
Для рака почки типично возрастание показателей заболеваемости с юга на север (наиболее высокие уровни традиционно характерны для Скандинавских стран и Северной Америки, а наиболее низкие — для Индии, Китая, стран Центральной и Южной Америки). Имеется положительная зависимость от уровня экономического развития страны, отмечена в 2–3 раза более высокая заболеваемость среди мужчин.
Этиологические факторы и факторы риска. Этиология опухолей почки достоверно неизвестна. Признанными факторами риска являются:
• Курение
• травма почки
• контакт с нитрозосоединениями, циклическими углеводородами и асбестом
• злоупотребление анальгетическими препаратами
• наследственные факторы (наследуется предрасположенность к его появлению опухоли, а не само новообразование).
• иммунодефицитные состояния
• ионизирующее излучение
Макроскопически почечно-клеточный рак представляет опухоль сферической формы, распологающуюся в корковом слое почки. Размер опухоли может быть от 1 до 30 и более сантиметров. На разрезе опухоль пестрого цвета, преобладающий цвет – желтый, что обусловлено накоплением внутриклеточных липидов.
Морфологически Выделяют следующие виды рака почки:
• Светлоклеточный рак 70-80%. Развивается из проксимального эпителия трубочек. Благодаря наличию гликогена в опухоли при окраски гематоксилин-эозином клетки приобретают светлую окраску. Для светлоклеточного рака почки характерно богатое кровоснабжение опухоли.
• Папиллярный рак 10-15%. В 8 раз чаще встречается у мужчин, чем у женщин. Папиллярный рак почки чаще бывает мультифокальным и двусторонним. Клетки окрашиваются по-разному от эозинофильных до базофильных или смешанных. Рост опухоли папиллярный.
• Хромофобный рак почки 5%. Рост хромофобного рака почки солидный и клетки окрашиваются преимущественно хромофобно, содержащиеся гранулы в цитоплазме - эозинофильно. Таким образом, цитоплазматическое окрашивание зависит от количества типичных для хромофобного рака почки везикул - большое количество гранул приводит к хромофобному цвету цитоплазмы.
• рак собирательных трубочек 1%. Опухоль исходит из медуллярных собирательных трубочек и обладает выраженным агрессивным поведением по сравнению с другими видами рака почки.
• неклассифицируемый рак почки 3-5%. Морфологичесие и генетические изменения не подходят ни для одной из категорий рака почки.
Кроме рака, в почке могут развиваться доброкачественные опухоли. Доброкачественные опухоли почки относят к редко встречающимся новообразованиям, составляющим до 7,2% от всех наблюдаемых опухолей почки. Выделяют следующие виды доброкачественных опухолей:
• 1) эпителиальные опухоли (аденома),
• 2) неэпителиальные опухоли (ангиомиолипома, фиброма, гемангиома)
• 3) другие типы (юкстагломерулярноклеточная опухоль).
•
Опухоли могут развиваться не только из почечной паренхимы, но и из почечной лоханки и мочеточника.
Опухоли почечной лоханки встречаются относительно редко и по статистике различных авторов составляют от 2 до 25% всех больных с опухолями почек. Опухоли мочеточника встречаются значительно реже, чем опухоли лоханки, и составляют 1-2% всех опухолей почки и верхних мочевых путей. Однако есть страны (Югославия, Болгария), где опухоли лоханки составляют 74% от новообразований почечной паренхимы.
Клинические проявления рака почки. Клиника может быть разнообразной и зависит от местного распостранения процесса, наличия метастазов и паранеопластических проявлений. В последние годы благодаря доступности методов медицинской визуализации значительное количество опухолей выявляется случайно, в доклинической стадии. Классическим проявлением рака почки является триада симптомов:
• Макрогематурия
• боль
• пальпируемая опухоль
Триаду наблюдают примерно у 15 % больных. Чаще проявляется не триада, а один или два симптома в том или ином coчетании.
Причинами гематурии являются деструкция сосудов в опухолевой ткани, прорастание опухоли в стенку чашечки или лоханки, венозная гипертензия в почке из-за сдавления почечной ткани опухолью. Тотальная безболевая макрогематурия может возникать внезапно и так же неожиданно прекращаться. При этом в моче появляются сгустки крови червеобразной формы, которые представляют собой слепки мочеточника. При появлении крови в моче показано обследование с целью определения источника кровотечения. Выделение крови из устья мочеточника, определяемое при цистоскопии может сориентировать врача в отношении стороны поражения. .
Боль характерна для далеко зашедшего опухолевого процесса и наблюдается не у всех больных. При опухоли почки на фоне тотальной безболевой макрогематурии может возникнуть почечная колика вследствие обтурации мочеточника сгустком крови. Важно помнить, что в отличие от друтих заболеваний почек, coпровождиощихся гематурией (мочекаменная болезнь, гидронефроз, нефроптоз и др.), колика при раке возникает после гематурии, а не предшествует ей.
Пальпируемое образование в подреберье свидетельствует о запущенности опухолевого процесса. Пораженную опухолью почку пальпируют обычно при значительных размерах новообразования. Этот симптом характерен для опухоли, однако встречается сравнительно редко и чаще в запущенных случаях. Иногда он может стать первым симптомом заболевания. При этом признаки, характерные для опухоли почки (плотность, бугристость), выявляются далеко не всегда. При локализации новообразования в верхнем сегменте почки и смещении ее книзу может пальпироваться неизмененный нижний сегмент. Величина и подвижность пораженной почки часто зависят не только от истинных размеров опухоли и распространенности процесса, но и от степени вовлечения в него околопочечной клетчатки. Поэтому неподвижность почки при пальпации еще не свидетельствует о неоперабельности опухоли.
Кроме классической триады встречаются и другие проявления:
Артериальная гипертензия - симптом вызываемый сдавлением сегментарных артерий, окклюзией мочеточника, метастазами в головной мозг, формированием артерио-венозных шунтов, или повышенной секрецией опухолью ренина наблюдается у 15% больных раком почки.
Синдром сдавления нижней полой вены (при опухолевом тромбозе или ее компрессии опухолью/увеличенными лимфатическими узлами):
• отеки ног;
• варикоцеле;
• расширение подкожных вен живота;
• тромбоз глубоких вен нижних конечностей;
• протеинурия.
Общие симптомы, такие, как анемия, высокая СОЭ, потеря аппетита, снижение массы тела, слабость являются признаками поздних стадий заболевания.
Около 5% пациентов на момент установления диагноза имеют отдаленные метастазы и симптомы, обусловленные метастазированием:
• кашель и кровохарканье (при поражении легких);
• боли в костях с развитием патологических переломов,
• появлением и нарастанием неврологической симптоматики (метастазы в головной мозг);
• желтуха и повышение температуры тела (при поражении печени).
При раке почки часто наблюдаются паранеопластические симптомы -разнообразные патологические проявления, обусловленные опосредованным влиянием опухолевого процесса на метаболизм, иммунитет и функциональную активность регуляторных систем организма. Последние могут опережать проявления основного заболевания, маскировать их, затрудняя диагностику. Это может вести к неоправданной терапии, задержке онкологического поиска и запоздалому распознаванию опухоли.
Описано свыше 60 паранеопластических синдромов, частота которых при различных опухолях варьирует. Паранеопластический синдром при раке почки наблюдаются более чем у половины больных. Это связано с тем, что почечная паренхима продуцирует биологически активные вещества (эритропоэтин, ренин, простагландины, простациклины, тромбоксаны, активную форму витамина D). Опухоль может приводить к повышенной секреции вышеуказанных субстанций и к продукции других гормонов: паратгормона, инсулина, глюкагона, человеческого хорионического гонадотропина. В результате у пациентов может отмечаться артериальная гипертензия, эритроцитоз, гиперкальциемия, гипертермия и др. Редкой формой паранеопластического синдрома является амилоидоз (1.7%). Непонятным остается возникновение в ряде случаев печеночной недостаточности при отсутствии ее метастатического поражения. При этом у больных раком почки отмечается гипоальбуминемия, повышение щелочной фосфатазы, лейкопения, лихорадка, возможно появление очагов некроза печеночной паренхимы (синдром Штафера).
Рак почки метастазирует гематогенным и лимфогенным путем. Наиболее частыми локализациями метастазов являются легкие 76%, лимфатические узлы 64%, кости 43%, печень 41%, надпочечник, контралатеральная почка, головной мозг. Солитарные метастазы или метастатическое поражение только одного органа имеет место только в 8-11% случаев. Приблизительно у 30-50% больных в различные сроки после нефрэктомии появляются метахронные метастазы.
Диагностика рака почки при наличии современных методов исследования, не представляет особых сложностей. Подозрение на рак почки предусматривает проведение следующих диагностических мероприятий:
• сбор анамнеза, стандартное физикальное обследование
• клинические анализы мочи и крови, биохимический анализ крови
• УЗИ органов брюшной полости и забрюшинного пространства;
• рентгенологическое исследование легких;
• экскреторная урография;
• КТ органов брюшной полости и забрюшинного пространства с внутривенным контрастированием или магнитно-резонансная томография
• ангиография, каваграфия (при подозрении на тромбоз почечной и нижней полой вены, а также при больших размерах опухоли сдавливающей магистральные сосуды).
• радиоизотопное исследование функции почек;
• остеосцинтиграфия.
Диагностика основывается, конечно же, на жалобах больного, а также на данных осмотра и общеклинических методов исследования (клинический анализ крови, клинический анализ мочи и др.). Но ведущая роль принадлежит методам визуализации: ультразвуковому исследованию, рентгеновской, компьютерной и магнитно-резонансной томографии.
Как правило, исследование почек начинается с ультразвукового исследования, которое устанавливает факт наличия опухоли. Кроме того, ультразвуковое исследование используется для диагностики метастазов в печень, парааортальные и паракавальные лимфатические узлы. Обязательным методом является экскреторная урография, которая позволяет получить представление о раздельной функции почек. Характерными признаками объемного образования на урограммах считается увеличение размеров, деформация контуров, наличие кальцификатов, деформация чашечно-лоханочной системы почки, ампутация одной или нескольких чашечек, медиальное смещение мочеточника. Если диагноз опухоли почки был установлен при УЗИ, или КТ, экскреторная урография не дает дополнительной информации для стадирования. Экскреторная урография показана больным с макрогематурией, так же для проведения дифференциального диагноза с папиллярными образованиями верхних мочевых путей. При опухолях лоханки рентгенологические изменения выражаются в дефектах наполнения, дефекты имеют неровные зазубренные очертания, изъеденные контуры. Такие своеобразные дефекты обусловлены наличием в лоханке сосочковой опухоли, ворсинки которой омываются по краям рентгеноконтрастной жидкостью. При папиллярных опухолях лоханки и мочеточника часто имеется гидронефроз, выражающийся в расширении лоханки и чашечек за счет нарушения оттока мочи полипообразными, ворсинчатыми опухолями.
На томограммах выявляют объем и контуры почки, взаимоотношение ее с окружающими органами и тканями. Одновременно можно установить степень распространения опухолевого процесса, т. е. выявить распространение опухоли на область ворот почки, наличие пораженных лимфатических узлов и тромба в нижней полой вене, метастазы в печени.
Ангиографию целесообразно производить только в том случае, если имеются сомнения в диагнозе или хирурга интересует кровоснабжение опухоли: количество почечных артерий, сосудистая архитектоника почки, а также при подозрении на заинтересованность магистральных сосудов. Показаниями к ангиографии являются:
• Планируемая резекция почки;
• Опухоль почки больших размеров;
• Опухолевый тромбоз НПВ;
• Планируемая эмболизация почечной артерии.
•
Каваграфию применяют для установления степени распространения опухолевого процесса, при этом выявляют тромбы в нижней полой вене, ее сдавление и смещение опухолью. При сдавлении нижней полой вены опухолью почки либо конгломератом увеличенных лимфатических узлов на венокавограмме выявляются округлые или овальные дефекты наполнения полой вены, деформация или смещение ее. Венокаваграфия хорошо выявляет коллатеральное кровообращение, развивающееся в результате тромбоза нижней полой вены. Нижняя полая вена может быть оттеснена в противоположную от опухоли сторону и сдавлена новообразованием.
Сцинциграфия скелета используется для диагностики костных метастазов, рентгенография или рентгеновская компьютерная томография – для диагностики метастазов в легкие.
Лабораторные методы имеют вспомогательное значение. Но наличие в моче эритроцитов всегда является поводом для обследования с целью исключения онкоурологических заболеваний.
Лечение больных и прогноз заболевания зависят от стадии опухоли. После установления наличия опухоли производится стадирование заболевания. Наиболее часто используется классификация TNM.
Объем наблюдения:
• общий анализ крови и биохимический анализ мочи;
• общий анализ мочи;
• УЗИ (КТ) органов брюшной полости и забрюшинного пространства;
• рентгенография (КТ) органов грудной клетки.
ОПУХОЛИ МОЧЕВОГО ПУЗЫРЯ
По данным Белорусского канцеррегистра заболеваемость злокачественными новообразованиями мочевого пузыря в Республике Беларусь составила 8,2 на 100 000 жителей в 1993 году и 10,5 – в 2002 году. В 1993 году было выявлено 849 новых случаев указанной патологии и 1041 – в 2002 году. В структуре онкологической заболеваемости всего населения в году рак мочевого пузыря составляет около 3%. В Гродненской области в 2005 году выявлено 95 случаев РМП, на учете состояло 546 больных. В мире ежегодно регистрируется более 150 тыс. новых случаев рака мочевого пузыря. Мужчины болеют в 4 раза чаще женщин.
Этиология рака мочевого пузыря неизвестна. Однако выявлен ряд факторов, способствующих развитию данного заболевания. Достоверно чаще рак мочевого пузыря поражает мужчин. Наиболее характерно развитие опухоли в возрасте старше 60 лет. Частота появления рака мочевого пузыря ниже у представителей негроидной расы. Рак мочевого пузыря является генетически детерминированным процессом, связанным с цепью хромосомных изменений. Многие исследователи считают, что значительную роль на начальных стадиях онкогенеза при раке мочевого пузыря играет делеция длинного плеча (или потеря всей) 9-й хромосомы. Также при опухолях данной локализации часто встречаются структурные изменения 1-й хромосомы. Трисомия 7-й хромосомы - частое явление при раке мочевого пузыря, чаще встречающееся в комбинации с другими изменениями генома. В клетках опухоли у мужчин может отсутствовать Y- хромосома.
Этиологически значимыми факторами являются:
• курение табака. С курением связывают более половины всех случаев РМП. У курильщиков риск заболеть РМП увеличивается в 4 раза по сравнению с некурящими. Нитрозамины, 2-нафтиламин, 4-аминобифенил содержатся в сигаретном дыме и являются причиной возникновения РМП.
• воздействие на организм химических канцерогенов - веществ, которые используются в резиновом, лакокрасочном, бумажном, анилиновым и химическом производстве. Более 200 лет назад было замечено, что рабочие, занятые в производстве красителей, чаще болели раком мочевого пузыря, чем население в целом. У рабочих на анилиновом производстве значительно чаще наблюдался рак мочевого пузыря, чем среди других групп населения, причем опухоли возникали через 10 лет и более после прекращения контакта с анилином.
• инвазия тропических паразитов (шистосома), проникающим в стенку мочевого пузыря. На африканском континенте шистосомоз является основной причиной возникновения рака мочевого пузыря.
• Применение лекарственных препаратов, например, анальгетиков, может спровоцировать рак мочевого пузыря.
• облучение малого таза или химиотерапия с использованием циклофосфамидов.
• употребление хлорированной воды на протяжении длительного периода времени способствует развитию этого заболевания.
Клинические проявления рака мочевого пузыря:
• Одним из первых признаков рака мочевого пузыря является гематурия, чаще тотальная. Однако при локализации опухоли в области шейки возможно наличие примеси крови только в терминальной порции мочи. Свертывание крови в полости мочевого пузыря может привести к развитию тампонады и острой задержки мочи. Гематурия может носить эпизодический характер, либо возникать единожды. Если кровь видно невооруженным глазом, то речь идет о макрогематурии. Если клетки крови выявляются в общем анализе мочи, то это - микрогематурия. Степень кровотечения не отражает величины опухоли. Многие пациенты не придают значения однократному появлению примеси крови в моче, поэтому зачастую РМП вовремя не диагностируется. Тем не менее, у 80% больных РМП хотя бы однажды имела место гематурия.
• Для рака мочевого пузыря характерны дизурические расстройства: боль (резь) при мочеиспускании или частые позывы к мочеиспусканию. Дизурические расстройства чаще наблюдаются при локализации опухоли в шейке мочевого пузыря и могут отсутствовать или появляться поздно при другой локализации. Надо помнить, что эти симптомы не всегда свидетельствуют о наличии РМП, и могут сопутствовать воспалительным заболеваниям мочеполовой системы. Но частое болезненное мочеиспускание при отсутствии признаков бактериального роста в моче должно настораживать в отношении рака мочевого пузыря.
• Боль над лоном может быть обусловлена инфекционными осложнениями, хронической задержкой мочи, а на поздних стадиях заболевания – инфильтрацией стенки мочевого пузыря опухолью. При дальнейшем росте новообразования появляются боли в области промежности, крестца.
Рак мочевого пузыря начинается с поверхностной опухоли, которая не вовлекает мышцы органа. В дальнейшем опухоль прорастает в стенку и распространяется на мышечный слой мочевого пузыря. В этом случае рак мочевого пузыря становится инвазивным. Если больного с инвазивным раком оставить без лечения то опухоль прорастает всю стенку мочевого пузыря и выходит в околопузырную клетчатку или даже прорастает в простату, матку, влагалище. При инвазивном раке часто наблюдается сдавление устьев мочеточников, что приводит к нарушению оттока мочи из верхних мочевыводящих путей, следствием чего является их дилатация, уростаз, развитие пиелонефрита, хронической почечной недостаточности. Полная обструкция устьев мочеточников приводит к анурии.
Для рака мочевого пузыря характерно лимфогенное метастазирование. Поражение регионарных лимфоузлов отмечается у 66%-75% больных инвазивным и у 5% пациентов с поверхностным раком мочевого пузыря. При carcinoma in situ частота лимфогенного метастазирования достигает 20%. В большинстве случаев поражаются тазовые лимфатические узлы. Наиболее часто выявляются метастазы в обтураторных, наружных подвздошных и паравезикальных лимфоузлах.
Отдаленные метастазы развиваются у 50% больных инвазивным раком мочевого пузыря и практически не встречаются при поверхностных опухолях. Наиболее часто поражаются печень, легкие, кости, надпочечник.
• Метастатическое поражение лимфатических узлов таза, как правило, вызывает появление клинических симптомов при больших размерах опухолевого конгломерата. При этом отмечается появление отеков нижних конечностей. Отдаленные метастазы рака мочевого пузыря вызывают развитие соответствующих симптомов.
Опухоли мочевого пузыря различаются по гистологическому строению, степени дифференциации клеточных элементов, размерам опухоли, степени ее прорастания в близлежащие и отдаленные ткани и органы. Эти характеристики опухолевого процесса чрезвычайно важны для определения тактики лечения. Международная гистологическая классификация рака мочевого пузыря включает в себя следующие формы:
• Рак in situ.
• Переходно-клеточный рак.
• Плоскоклеточный рак.
• Аденокарцинома.
• Недифференцированный рак.
Более 90% опухолей мочевого пузыря представлено переходно-клеточным раком. Оставшиеся 10% составляют плоскоклеточный рак и аденокарцинома.
Наиболее распространенной в настоящее время является классификация TNM, стадирование согласно которой наиболее адекватно отражает прогноз заболевания.
ЛЕКЦИЯ № 5.
Причины постренальной ОПН.
Острая обструкция (окклюзия) мочевых путей: двусторонняя обструкция мочеточников, а у больных с хроническими заболеваниями почек бывает достаточно односторонней обструкции мочеточника. Наиболее частой причиной является мочекаменная болезнь. Среди других причин - ретроперитонеальный фиброз и забрюшинные опухоли. Механизм развития постренальной ОПН связан с афферентной почечной вазоконстрикцией, развивающейся в ответ на резкое повышение внутриканальцевого давления с выбросом ангиотензина II и тромбоксана А2.
ДИАГНОСТИКА.
Факт установления ОПН обычно не вызывает затруднений. Основной симптом - прекращение выделения мочи и отсутствие позывов к мочеиспусканию. Общее состояние больных в первые часы и даже сутки с момента развития анурии может существенно не меняться (мнимое благополучие). Несмотря на отсутствие клинических проявлений ОПН, следует ввести в мочевой пузырь катетер и убедиться, что он не содержит мочи.
В диагностике «неолигоурической ОПН» первостепенное значение имеет контроль биохимических показателей крови.
В дифференциальной диагностике типов анурии большое значение приобретают тщательно собранные данные анамнеза.
ЛЕЧЕНИЕ
Характеристика лечебных мероприятий при ОПН:
Этиотропная терапия – лечебные мероприятия, направленные на устранение или снижение патогенного влияния причинных факторов.
Компоненты этиотропной терапии:
- прекращение поступления в организм токсических веществ, энтеросорбция, промывание желудка, очистительные клизмы, удаление токсических веществ с поверхности кожи, слизистых, введение антидотов, гемосорбция, плазмаферез.
- адекватное восполнение кровопотери, потерь жидкости.
- антимикробная терапия, оперативное лечение гнойных процессов, применение иммуномодуляторов
- оперативное устранение патологических образований, приведших к формированию обструкции мочевых путей, сосудов почек.
Патогенетическая терапия – лечебные мероприятия, позитивно, влияющие на патогенетические звенья развития ОПН.
Компоненты патогенетической терапии:
- стабилизация системной гемодинамики (нормализация АД, лечение острой и хронической сердечно-сосудистой недостаточности, перевязка кровоточащих сосудов, контроль за потерями и поступлением жидкости и поваренной соли в организм, постельный режим, введение диуретиков).
- стабилизация регионарной гемодинамики (антиагрегантная, антикоагулянтная терапия, терапия васкулита, ДВС-синдрома и т.д.).
- коррекция дизэлектролитемий, расстройств кислотно-щелочного равновесия, лечение анемии.
- Борьба с гипергидратицией – введение петлевых диуретиков (при постренальной ОПН только после устранения обструкции). Обычно начинают с дозы 60-100 мг лазикса (фуросемида) в/в струйно. При отсутствии диуретического эффекта повторяют фракционные введения фуросемида каждые 2-4 часа. Максимальная доза не должна в большинстве случаев превышать 1000 мг/сут.
- ограничение белкового питания.
- экстракорпоральные методы лечения.
Симптоматическая терапия – лечебные мероприятия, направленные на устранение отдельных симптомов заболевания. Это не приводит к существенному влиянию на патогенез ОПН, однако улучшает качество жизни больного.
Компоненты симптоматической терапии:
- терапия соматогенной астенизации, энцефалопатии.
- противорвотная терапия, применение витаминных препаратов, гастропротекторов.
- применение жаропонижающих препаратов.
- адекватное обезболивание.
Лечение ОПН зависит от причин и проявлений анурии:
Лечение в случаях преренальной или ренальной анурии заключается, главным образом, в нормализации водно-электролитных нарушений, восстановлении общей гемодинамики, устранении ишемии почек, ликвидации гиперазотемии. Дезинтоксикационная терапия включает переливание 10-20% раствора глюкозы до 500 мл с адекватным количеством инсулина, 200 мл 2-3% раствора натрия гидрокарбоната. Введение растворов следует сочетать с промыванием желудка и сифонными клизмами.
При обтурационной (субренальной) анурии ведущими являются меры, направленные на восстановление нарушенного пассажа мочи: катетеризация мочеточников, чрескожная пункционная нефростомия под контролем УЗИ, открытая нефростомия. Катетеризация мочеточников, как правило, является паллиативным вмешательством, позволяющим кратковременно ликвидировать ОПН, улучшить состояние больных и обеспечить необходимое обследование для уточнения характера и локализации обструкции.
ЭТИОЛОГИЯ
Причинами возникновения хронической почечной недостаточности могут стать различные заболевания, которые приводят к поражению почечных клубочков. Это:
Заболевания, протекающие с первичным поражением клубочков почек - хронический гломерулонефрит, быстропрогрессирующий гломерулонефрит.
Заболевания, протекающие первичным поражением канальцев и интерстиция почек - хронический пиелонефрит, интерстициальный нефрит.
Обструктивные нефропатии - мочекаменная болезнь, гидронефроз, опухоли мочевыделительной системы.
Первичные поражения сосудов - гипертоническая болезнь, стеноз почечных сосудов.
Диффузные заболевания соединительной ткани - системная красная волчанка, системная склеродермия, узелковый периартериит.
Болезни обмена веществ - сахарный диабет, амилоидоз.
Гистологические изменения в почках при выраженной ХПН однотипны - вследствие склеротических процессов значительно снижается масса действующих нефронов.
КЛАССИФИКАЦИЯ
Выделяют четыре стадии хронической почечной недостаточности (Н.А.Лопаткин, И.Н.Кучинский)
Латентная стадия. В этой стадии пациент может не предъявлять жалоб или же возникают утомляемость при физической нагрузке, слабость, появляющаяся к вечеру, сухость во рту. При биохимическом исследовании крови выявляют небольшие нарушения электролитного состава крови, иногда белок в моче. В этой стадии скорость клубочковой фильтрации снижается до 60-50 мл/мин.
Компенсированная стадия. В этой стадии жалобы больных те же, но возникают они чаще. Сопровождается это увеличением выделения мочи до 2,5 литров в сутки из-за нарушения канальциевой реабсорбции. Осмолярность мочи снижена. Обнаруживаются изменения в биохимических показателях крови и в анализах мочи. В этой стадии скорость клубочковой фильтрации снижается до 49-30 мл/мин.
Интермитирующая стадия. Работа почек еще сильнее уменьшается. Возникает стойкое повышение в крови продуктов азотистого обмена (обмена белка) – повышение уровня мочевины, креатинина. У пациента возникает общая слабость, быстрая утомляемость, жажда, сухость во рту, аппетит резко снижается. Кожа приобретает желтоватый оттенок, становится сухой. У больного могут значительно тяжелее протекать обычные респираторные заболевания, ангины, фарингиты. В эту стадию могут быть выражены периоды улучшения и ухудшения в состоянии пациента. В этой стадии скорость клубочковой фильтрации снижается до 29-15 мл/мин.
Терминальная (конечная) стадия. Фильтрационная способность почек падает до минимума. Больной может чувствовать себя удовлетворительно на протяжении нескольких лет, но в эту стадию в крови постоянно повышено количество мочевины, креатинина, мочевой кислоты, нарушен электролитный состав крови. Все это вызывает уремическую интоксикацию или уремию (уремия – моча в крови). Количество выделяемой мочи в сутки уменьшается до полного ее отсутствия. Поражаются другие органы. Возникает дистрофия сердечной мышцы, перикардит, недостаточность кровообращения, отек легких. Нарушения со стороны нервной системы проявляются симптомами энцефалопатии (нарушение сна, памяти, настроения, возникновением депрессивных состояний). Нарушается выработка гормонов, возникают изменения в свертывающей системе крови, нарушается иммунитет. Все эти изменения носят необратимый характер. В этой стадии скорость клубочковой фильтрации снижается ниже 14 мл/мин.
Диагностика
Диагностика ХПН не вызывает трудностей. Облигатными критериями являются снижение скорости клубочковой фильтрации (СКФ), азотвыделительной функции почек. Клинические проявления ХПН могут некоторое время отсутствовать, создавая впечатление «доброкачественности» и «безвредности» ХПН. Не опасных для жизни ХПН не бывает. Постепенно появляются клинические признаки ХПН, которые обусловлены вовлечением в патологический процесс всех органов и систем. К ним относятся:
1 Интоксикационный синдром
2 Анемия
3 Уремическая остеодистрофия
4 Асептическое воспаление органов детоксикации (гастроэнтероколит, дерматит, бронхит, пневмонит)
5 Полисерозиты
6 Эндокринные расстройства (гиперпаратиреоидизм, гиперкортицизм, гиперальдостеронизм, гиперпролактинемия, гиперинсулинемия, гиперэстрогенемия)
7 Расстройства гемореологии
8 Дистрофические изменения паренхиматозных органов (энцефалопатия, гепатодистрофия, пневмопатия, спленомегалия)
9 Нарушение жирового, углеводного, белкового, водно-электролитного обмена
Ниже приводится основной метод определения скорости клубочковой фильтрации, используемый в клинической практике - проба Реберга-Тареева. В 1926 г. Реберг предложил определять скорость клубочковой фильтрации по экзогенному креатинину. Однако этот метод представлял определенные трудности, связанные с необходимостью внутривенного введения экзогенного креатинина. В 1936 г. Е. М. Тареев предложил исследовать скорость клубочковой фильтрации по клиренсу эндогенного креатинина. Было установлено, что концентрация креатинина в плазме крови не подвергается существенным колебаниям и практически постоянна. Поэтому отпала необходимость внутривенного введения экзогенного креатинина, что значительно упростило методику исследования клубочковой фильтрации. Определение скорости клубочковой фильтрации по клиренсу эндогенного креатинина называют также пробой Реберга-Тареева.
Чтобы определить скорость клубочковой фильтрации F по клиренсу эндогенного креатинина, необходимо знать концентрацию креатинина в плазме крови, в моче и минутный диурез: F = (U/P)V.
Методика определения скорости клубочковой фильтрации.
Утром, сразу после сна, больной выпивает 300-400мл (1,5-2 стакана) воды или некрепкого чая (для получения достаточного минутного диуреза) и спустя 10-15 мин мочится в унитаз. Точно отмечает время окончания мочеиспускания, ложится в постель и строго через час мочится в отдельную посуду (I порция мочи). Снова точно замечает время окончания мочеиспускания и через час собирает вторую порцию мочи в отдельную посуду. В середине сбора мочи из вены берут 6-8 мл крови. В лаборатории в каждой часовой порции определяют объем мочи и вычисляют минутный диурез. Кроме того, в каждой из двух часовых порций мочи и в плазме крови определяют концентрацию креатинина. Затем по формуле для каждой порции мочи вычисляют клиренс эндогенного креатинина:
F1 = (U1/P)V1,
где FI - клубочковая фильтрация; U1 - концентрация креатинина в моче; VI - минутный диурез в первой порции мочи; Р - концентрация креатинина в плазме крови.
Аналогично определяют скорость клубочковой фильтрации по второй порции мочи:
F2 = (U2/P)V2.
Показатели клубочковой фильтрации, определяемые по первой и второй порциям мочи, обычно неидентичны
Определение скорости клубочковой фильтрации имеет большую практическую ценность, так как снижение этого показателя является наиболее ранним признаком начинающейся хронической почечной недостаточности
Каналъцевую реабсорбцию, которая отражает суммарную концентрационную функцию (проксимальных и дистальных отделов канальцев), можно определить по следующей формуле:
R = (F - V)/F • 100 %,
где R - канальцевая реабсорбция; F - клубочковая фильтрация; V - минутный диурез.
В норме канальцевая реабсорбция составляет 98-99 %, однако при большой водной нагрузке даже у здоровых людей может уменьшаться до 94-92 %. Снижение канальцевой реабсорбции рано наступает при пиелонефрите, гидронефрозе, поликистозе.
В практической работе часто используется классификация С.И.Рябова и Б.Б.Бондаренко, близкая международным классификациям. Достоинство указанной классификации в том, что она дает возможность ставить прогноз ХПН и намечать методы терапии. Разделение стадий проводится по клинико-биохимическим и функциональным критериям, в частности по содержанию креатинина и величине клубочковой фильтрации (см. таблицу).
I стадия называется латентной, клинически ХПН ничем не проявляется, но уже можно с помощью нагрузочных проб выявить нарушение функций почек.
II стадия называется азотемической, клинические признаки ХПН постепенно нарастают.
III стадия уремическая, здесь наблюдаются развернутые признаки уремии.
К концу ПБ стадии больным показана активная терапия гемодиализом или трансплантация почки. До этого проводится консервативное лечение.
| Стадия ХПН | Креатинин в ммоль/л | Клубочковая фильтрация в %% от нормы |
| ЛАТЕНТНАЯ I A I Б | до 0,13 до 0,2 | Норма (80-120 мл/мин) до 50 |
| АЗОТЕМИЧЕСКАЯ IIA II Б | 0,2 -0,4 0,4 – 0,7 | 20 -50 10 -20 |
| УРЕМИЧЕСКАЯ IIIA IIIБ | 0,7 - 1,0 больше 1,0 | 5 -10 ниже 5 |
Для правильного выбора адекватных методов лечения чрезвычайно важно учитывать классификацию ХПН.
КОНСЕРВАТИВНАЯ ТЕРАПИЯ ХПН.
При сохранении клубочковой фильтрации 40-15 мл/мин имеется возможность консервативного лечения. При падении клубочковой фильтрации ниже 15 мл/мин показана почечнозамещающая терапия (гемодиализ, перитонеальный диализ или пересадка почки).
Консервативное лечение ХПН включает:
1. Лечение основного заболевания, приведшего к уремии.
2. Режим.
3. Лечебное питание.
4. Адекватный прием жидкости (коррекция нарушений водного баланса).
5. Коррекция нарушений электролитного обмена.
6. Уменьшение задержки конечных продуктов белкового обмена (борьба с азотемией).
7. Коррекция ацидоза.
8. Лечение артериальной гипертензии.
9. Лечение анемии.
10. Лечение уремической остеодистрофии.
11. Лечение инфекционных осложнений.
Лечение основного заболевания
Лечение основного заболевания, приведшего к развитию ХПН, может оказать положительное влияние и даже уменьшить выраженность почечной недостаточности. Особенно это относится к хроническому пиелонефриту с начальными или умеренно выраженными явлениями ХПН. Купирование обострения воспалительного процесса в почках уменьшает выраженность явлений почечной недостаточности.
Режим
Больному следует избегать переохлаждений, больших физических и эмоциональных нагрузок. Больной нуждается в оптимальных условиях работы и быта. Он должен быть окружен вниманием и заботой, ему необходимо предоставлять дополнительный отдых во время работы, целесообразен также более продолжительный отпуск.
Лечебное питание
Диета при ХПН основывается на следующих принципах:
- ограничение поступления с пищей белка до 60-40-20 г в сутки в зависимости от выраженности почечной недостаточности;
- обеспечение достаточной калорийности рациона, соответствующей энергетическим потребностям организма, за счет жиров, углеводов, полное обеспечение организма микроэлементами и витаминами;
- ограничение поступления фосфатов с пищей;
- контроль за поступлением натрия хлорида, воды и калия.
Выполнение этих принципов, особенно ограничение в диете белка и фосфатов, уменьшает дополнительную нагрузку на функционирующие нефроны, способствуют более длительному сохранению удовлетворительной функции почек, уменьшению азотемии, замедляют прогрессирование ХПН. Ограничение белка в пище уменьшает образование и задержку в организме азотистых шлаков, снижает содержание азотистых шлаков в сыворотке крови из-за уменьшения образования мочевины (при распаде 100 г белка образуется 30 г мочевины) и за счет ее реутилизации.
Широкое распространение получили картофельная и картофельно-яичная диета при лечении больных ХПН. Эти диеты высококалорийны за счет безбелковых продуктов - углеводов и жиров. Высокая калорийность пищи снижает катаболизм, уменьшает распад собственного белка. В качестве высококалорийных продуктов можно рекомендовать также мед, сладкие фрукты (бедные белком и калием), растительное масло, сало (в случае отсутствия отеков и гипертензии).
Лечение препаратами железа
Препараты железа принимаются обычно внутрь и лишь при плохой переносимости и желудочно-кишечных расстройствах их вводят внутривенно или внутримышечно. Наиболее часто назначаются ферроплекс по 2 таблетки 3 раза в день после еды; ферроцерон по 2 таблетки 3 раза в день; конферон по 2 таблетки 3 раза в день; ферроградумент, тардиферон (препараты железа продленного действия) по 1-2 таблетки 1-2 раза в день
Лечение андрогенами
Андрогены активируют эритропоэз. Назначают их мужчинам в сравнительно больших дозах - тестостерон внутримышечно по 400-600 мг 5% раствора 1 раз в неделю; сустанон, тестэнат внутримышечно по 100-150 мг 10% раствора 3 раза в неделю.
Лечение рекормоном
Рекомбинантный эритропоэтин - рекормон применяется для лечения недостатка эритропоэтина у больных с ХПН. Одна ампула препарата для инъекций содержит 1000 МЕ. Препарат вводится только подкожно, начальная доза составляет 20 МЕ/кг 3 раза в неделю, в дальнейшем при отсутствии эффекта число инъекций увеличивается на 3 каждый месяц. Максимальная доза составляет 720 ЕД/кг в неделю. После повышения гематокрита на 30-35% назначают поддерживающую дозу, которая равна половине той дозы, на которой произошло увеличение гематокрита, препарат вводится с 1-2-недельными перерывами. Лечение эритропоэтином является на сегодняшний день наиболее эффективным методом лечения анемии у больных ХПН. Установлено также, что лечение эритропоэтином оказывает положительное влияние на функцию многих эндокринных органов: подавляется активность ренина, снижается уровень альдостерона в крови, увеличивается содержание в крови предсердного натрийуретического фактора, снижаются также уровни СТГ, кортизола, пролактина, АКТГ, панкреатического полипептида, глюкагона, гастрина, повышается секреция тестостерона, что наряду со снижением пролактина оказывает положительное влияние на половую функцию мужчин.
Поливитаминотерапия
Целесообразно применение сбалансированных поливитаминных комплексов (ундевит, олиговит, дуовит, декамевит, фортевит и др.).
Лечение инфекционных осложнений. Появление инфекционных осложнений у больных с ХПН приводит к резкому снижению функции почек. При внезапном падении клубочковой фильтрации у нефрологического больного надо в первую очередь исключить возможность инфекции. При проведении антибактериальной терапии следует помнить о необходимости понижать дозы препаратов, учитывая нарушение выделительной функции почек, а также о нефротоксичности ряда антибактериальных средств. Наиболее нефротоксичны антибиотики аминогликозиды (гентамицин, канамицин, стрептомицин, тобрамицин, бруламицин). Сочетание этих антибиотиков с диуретиками усиливает возможность токсического действия. Умеренно нефротоксичны тетрациклины.
Не являются нефротоксичными следующие антибиотики: левомицетин, макролиды (эритромицин, олеандомицин), оксациллин, метициллин, пенициллин и другие препараты группы пенициллина. Эти антибиотики могут назначаться в обычных дозах. При инфекции мочевыводящих путей предпочтение также отдается цефалоспоринам и пенициллинам, секретирующимся канальцами, что обеспечивает их достаточную концентрацию даже при снижении клубочковой фильтрации.
Принципы лечения ХПН в терминальной стадии.
Режим. Режим больных с терминальной стадией ХПН должен быть максимально щадящим.
Лечебное питание. В терминальной стадии ХПН при клубочковой фильтрации 10 мл/мин и ниже и при уровне мочевины в крови более 16.7 ммоль/л с выраженными симптомами интоксикации назначается диета № 7 с ограничением белка до 0.25-0.3 г/кг, всего 20-25 г белка в сутки, причем 15 г белка должно быть полноценным. Желателен также прием незаменимых аминокислот (особенно гистидина, тирозина), их кетоаналогов, витаминов.
Принцип лечебного эффекта малобелковой диеты заключается прежде всего в том, что при уремии, низком содержании аминокислот в плазме и малом поступлении белка с пищей азот мочевины используется в организме для синтеза незаменимых аминокислот и белка. Диету, содержащую 20-25 г белка, назначают больным с ХПН лишь в течение ограниченного времени - на 20-25 дней.
По мере снижения концентрации в крови мочевины, креатинина, уменьшения интоксикации и диспептических явлений у больных нарастает чувство голода, они начинают терять массу тела. В этот период больных переводят на диету с содержанием белка 40 г в сутки.
Перспективным дополнением к малобелковой диете является использование сорбентов: оксицеллюлоза в начальной дозе 40 г с последующим повышением дозы до 100 г в сутки; крахмал по 35 г ежедневно в течение 3 недель; полиальдегид "полиакромен" 40-60 г в сутки; карболен 30 г в сутки; энтеродез; угольные энтеросорбенты.
Предлагаются и полностью безбелковые диеты (на 4-6 недель) с введением из азотистых веществ только незаменимых кислот или их кетоаналогов (кетостерил, кетоперлен). При применении таких диет вначале снижается содержание мочевины, а затем мочевой кислоты, метилгуанидина и в меньшей степени креатинина, может повыситься уровень гемоглобина в крови.
Сложность соблюдения малобелковой диеты состоит прежде всего в необходимости исключать или резко ограничивать продукты, содержащие растительный белок: хлеб, картофель, каши. Поэтому следует принимать малобелковый хлеб, приготовленный из пшеничного или кукурузного крахмала (100 г такого хлеба содержит 0.78 г белка) и искусственное саго (0.68 г белка на 100 г продукта). Саго используется вместо различных круп.
Контроль за введением жидкостей. В терминальной стадии ХПН при величине клубочковой фильтрации менее 10 мл/мин (когда больной не может выделить более 1 л мочи в день) прием жидкости необходимо регулировать по диурезу (к количеству выделенной мочи за предыдущие сутки добавляют 300-500 мл).
В поздних стадиях ХПН консервативные методы лечения малоэффективны, поэтому в терминальной стадии ХПН проводятся активные методы лечения: постоянный перитонеальный диализ, программный гемодиализ, пересадка почки.
Гемодиализ
Гемодиализ (haemodialysis; греч. haima кровь + dialysis разложение, отделение) — метод внепочечного очищения крови от веществ с малой и средней молекулярной массой путем диффузии через искусственную полупроницаемую мембрану.
Гемодиализ - основной метод лечения больных с ОПН и ХПН. Под воздействием концентрационного градиента через полупроницаемую мембрану проходят низко- и среднемолекулярные вещества. Из 90 уремическиx токсинов более 2/3 - "малые" молекулы. Мембрана не пропускает высокомолекулярные вещества - белки.
Гемодиализ проводится с помощью аппарата "искусственная почка", представляющего гемодиализатор и устройство, с помощью которого готовится и подается в гемодиализатор диализирующий раствор. В гемодиализаторе происходит процесс диффузии из крови в диализирующий раствор через синтетическую полупроницаемую мембрану различных веществ. В современных аппаратах «искусственная почка» используется так же гемофильтрация. "Очищение" крови при гемофильтрации происходит преимущественно методом конвекции - перемещение растворенных в плазме веществ через полупроницаемую мембрану под действием трансмембранного давления Конвекция и диффузия одинаково эффективны в удалении "малых" молекул. Метод конвекции более эффективно удаляет "средние" молекулы. Кроме того, с помощью гемофильтрации могут быть удалены так называемые маленькие белки (например, бета2-микроглобулин, миоглобин), некоторые ферменты, бактериальные эндотоксины. При гемофильтрации эффективнее удаляются вещества, распределяющиеся преимущественно во внеклеточной жидкости и хорошо проходящие через мембрану, в меньшей степени нарушается осмотический баланс, поэтому гемофильтрация реже сопровождается опасными осложнениями со стороны органов кровообращения и центральной нервной системы. Сочетание диализа с гемофильтрацией называется гемодиафильтрацией. При этом одновременно происходит два процесса: диффузия веществ через полупроницаемую мембрану диализатора между кровью пациента и диализирующей жидкостью и конвективный транспорт воды и растворённых в ней веществ через полупроницаемую мембрану.
Перемещение воды из крови в диализат называется ультрафильтрацией. Скорость ультрафильтрации определяется изменением давления в полости диализатора за счет создания вакуума с одной стороны диализирующей мембраны. Скорость ультрафильтрации при гиперволемии и анурии подбирается индивидуально и может составлять от 100 до 300 мл/ч при расходе диализата до 300-500 мл/мин.
Диализирующий раствор подбирается индивидуально в зависимости от содержания электролитов в крови больного. Основные ингредиенты диализирующего раствора следующие: натрий 130-132 ммоль/л, калий - 2.5-3 ммоль/л, кальций - 1.75-1.87 ммоль/л, хлор - 1.3-1.5 ммоль/л. Для проведения гемодиализа на протяжении значительного периода времени необходим постоянный надежный доступ к артериальным и венозным сосудам. С этой целью Скрибнер предложил артериовенозный шунт - способ соединения лучевой артерии и одной из вен предплечья с помощью тефлоносиластика. Перед гемодиализом наружные концы шунта соединяют с гемодиализатором. Разработан также метод Врешиа - создание подкожной артериовенозной фистулы.
Сеанс гемодиализа обычно продолжается 4-6 ч, его повторяют 2-3 раза в неделю (программный, перманентный диализ). Показания к более частому гемодиализу возникают при усилении уремической интоксикации. Применяя гемодиализ, можно продлить жизнь больного ХПН более чем на 15 лет.
Сеансы хронического гемодиализа начинаются при следующих клинико-лабораторных показателях:
- скорость клубочковой фильтрации менее 5 мл/мин;
- скорость эффективного почечного кровотока менее 200 мл/мин;
- содержание мочевины в плазме крови более 35 ммоль/л;
- содержание креатинина в плазме крови более 1 ммоль/л;
- содержание "средних молекул" в плазме крови более 1 ЕД;
- содержание калия в плазме крови более 6 ммоль/л;
- снижение стандартного бикарбоната крови ниже 20 ммоль/л;
- дефицит буферных оснований более 15 ммоль/л;
- развитие стойкой олигоанурии (менее 500 мл в сутки);
- начинающийся отек легких на фоне гипергидратации;
- фибринозный или реже экссудативный перикардит;
- признаки нарастающей периферической нейропатии.
Абсолютными противопоказаниями к хроническому гемодиализу являются:
- сердечная декомпенсация с застойными явлениями в большом и малом кругах кровообращения независимо от заболевания почек;
- инфекционные заболевания любой локализации с активным воспалительным процессом;
- онкологические заболевания любой локализации;
- туберкулез внутренних органов;
- язва ЖКТ в фазе обострения;
- тяжелые поражения печени;
- психические заболевания с негативным отношением к гемодиализу;
- геморрагический синдром любого генеза;
- злокачественная артериальная гипертензия и ее последствия.
В процессе хронического гемодиализа диета больных должна содержать 0.8-1 г белка на 1 кг массы тела, 1.5 г поваренной соли, не более 2.5 г калия в сутки.
При хроническом гемодиализе возможны следующие осложнения: прогрессирование уремической остеодистрофии, эпизоды гипотензии вследствие чрезмерной ультрафильтрации, инфицирование вирусным гепатитом, нагноения в области шунта.
Перитонеальный диализ
Этот метод лечения больных с ХПН заключается во введении в брюшную полость специального диализирующего раствора, в который благодаря концентрационному градиенту через мезотелиальные клетки брюшины диффундируют различные вещества, содержащиеся в крови и жидкостях организма. При перитонеальном диализе брюшина играет роль полупроницаемой мембраны. Эффективность перитонеального диализа не ниже эффективности гемодиализа. В отличие от гемодиализа перитонеальный диализ способен уменьшить также содержание в крови среднемолекулярных пептидов, поскольку они диффундируют через брюшину.
Методика перитонеального диализа заключается в следующем. Производится нижняя лапаротомия и устанавливается катетер Тенкхоффа. Перфорированный на протяжении 7 см конец катетера помещается в полости малого таза, другой конец выводится из передней брюшной стенки через контрапертуру, в наружный конец катетера вводится адаптер, который соединяется с контейнером с диализирующим раствором. Для проведения перитонеального диализа используются диализирующие растворы, упакованные в двухлитровые полиэтиленовые мешки и содержащие ионы натрия, кальция, магния, лакгата в процентном соотношении, равнозначном содержанию их в нормальной крови.
Смену раствора производят 4 раза в сутки - в 7, 13, 18, 24 ч. Техническая простота смены раствора позволяет больным делать это самостоятельно через 10-15 дней обучения. Больные легко переносят процедуру перитонеального диализа, быстро наступает улучшение самочувствия, лечение можно проводить в домашних условиях. Типичный диализирующий раствор готовится на 1.5-4.35% растворе глюкозы и содержит натрия 132 ммоль/л, хлора 102 ммоль/л, магния 0.75 ммоль/л, кальция 1.75 ммоль/л.
Эффективность перитонеального диализа, проводимого 3 раза в неделю, продолжительностью по 9 ч в отношении удаления мочевины, креатинина, коррекции электролитного и кислотно-щелочного состояния сравнима с гемодиализом, проводимым трижды в неделю по 5 ч.
Абсолютных противопоказаний к перитонеальному диализу нет. Относительные противопоказания: инфекция в области передней брюшной стенки, неспособность больных соблюдать диету с большим содержанием белка (такая диета необходима в связи со значительными потерями альбумина с диализирующим раствором - до 70 г в неделю).
Гемодиализ и перитонеальный диализ являются альтернативными методами заместительной почечной терапии. Каждый из этих методов имеет свои достоинства и недостатки.
| Гемодиализ | Перитонеальный диализ |
| Метод требует хирургического вмешательства: формирования артерио-венозной фистулы; | Метод требует хирургического вмешательства: введения в брюшную полость катетера; |
| Цикличность метода (сеансы диализа 3 раза в неделю по 4 часа). Возможны перепады в объеме крови со значительными колебаниями уровня артериального давления; | Выведение жидкости и продуктов обмена происходит постоянно, что позволяет избежать резких перепадов в объеме крови и значительных колебаний артериального давления; |
| Посещение центра диализа 3 раза в неделю; | Проводится дома и требует около 2-2,5 часов ежедневно (4-5 обменов диализной жидкости по 20-30 мин.); Посещение центра диализа 1 раз в месяц для исследования крови и осмотра врача; Процедура замены диализной жидкости, как правило, безболезненна; |
| Ниже риск инфекционных осложнений; | Выше риск инфекционных осложнений |
| Необходимость соблюдения диеты и водного режима; | Меньше ограничений в диете и водном режиме; |
| Кровопотери и разрушение эритроцитов во время диализа. | Диализ происходит без непосредственного контакта с кровью, не требует введения гепарина; Анемия менее выражена; |
Пересадка ночки -оптимальный метод лечения ХПН, заключающийся в замене пораженной необратимым патологическим процессом почки неизмененной почкой. Технические представления необходимые для выполнения пересадки почек, сложились к началу века, когда была разработана техника сосудистого шва. Пересадка почек сегодня является методом выбора для лечения многих больных с почечной недостаточностью, хотя гемодиализ и перитонеальный диализ служат адекватной заменой этой операции для большинства пациентов. Однако пересадка почек, при ее успешном осуществлении, сопровождается значительно большим реабилитационным эффектом у больных с уремией, чем гемодиализ или перитонеальный диализ. Показания к пересадке почки: I и П-а периоды терминальной фазы ХПН, когда нет необратимых уремических осложнений. Ортотопическую трансплантацию (на прежнее место) не используют, так как она сложнее технически и может вызвать различные осложнения. Тансплантируется почка гетеротопически, причем из-за анатомических особенностей левую почку лучше пересаживать в правую, а правую — в левую подвздошную ямку. Операцию проводят под интратрахеальным наркозом, разрез кожи косой или параректальный. Выделяют внутреннюю и наружную подвздошные артерии, наружную и общую подвздошные вены. При соответствии диаметров почечной артерии донора и внутренней подвздошной артерии производится анастомоз «конец в конец». Конец почечной вены вшивается в бок общей подвздошной вены. Анастомозирование мочеточника с мочевым пузырем производят после восстановления кровотока в почке. Пузырно-мочеточниковое соустье создают по антирефлюксной методике.
Выбор донора.
В целом, чем значительнее генетические отличия между трансплантатом и реципиентом, тем выраженнее реакция отторжения. Трансплантаты от однояйцевых близнецов (изотрансплантаты, изогенные, или сингенные, трансплантаты) или трансплантаты, пересаживаемые внутри одного и того же организма, приживаются без осложнений после восстановления их нормального кровоснабжения. Реакция отторжения трансплантата вызывается чужеродными антигенами гистосовместимости на поверхности клеток трансплантата.
Гены основного комплекса гистосовместимости (ОКГ) подразделяются на три класса: класс I, класс II, класс III. Молекулы I и II классов играют существенную роль при трансплантации. Известно, что они играют ключевую роль в активации Т- и В-лимфоцитов в дополнение к обеспечению распознавания гистосовместимости. Молекулы класса I человеческого лейкоцитарного антигена (HLA) могут быть обнаружены на поверхности почти всех содержащих ядра клеток. Молекулы класса II HLA обнаруживаются только на поверхности клеток иммунной системы — макрофагов, дендритических клеток, В-лимфоцитов и активированных Т-лимфоцитов
Для демонстрации антигенного сходства тканей донора и реципиента перед трансплантацией были разработаны различные методы, чтобы можно было подобрать относительно гистосовместимые пары — донора и реципиента. Наилучший из современных методов называется серологическим, или лейкоцитарным, типированием. Антигены системы HLA, экспрессируемые циркулирующими лимфоцитами, могут быть определены с помощью сывороток, полученных от пациентов, перенесших множественные гемотрансфузии, или от женщин, имевших множественные беременности. Используя лейкоциты пациента и ряд стандартных сывороток, можно охарактеризовать большинство сильных антигенов как у донора, так и у реципиента.
Предотвращение отторжения трансплантата
Разработка иммуносупрессивных препаратов сделала революцию в трансплантологии. В большинстве случаев, если прекращается прием этих препаратов, возникает реакция отторжения трансплантата.
Имеется следующие пути подавления реакции отторжения: 1) разрушить иммунокомпетентные клетки перед трансплантацией; 2) сделать реактивные лимфоцитарные клетки неспособными распознавать антигены или даже выработать токсическую реакцию против них; 3) повлиять на реакцию клеток реципиентов с антигенами; 4) ингибировать трансформацию и пролиферацию лимфоцитов; 5) ограничить дифференцировку лимфоцитов до Т-киллеров или до синтезирующих антитела плазматических клеток; 6) активировать достаточное количество лимфоцитов-супрессоров; 7) подавить разрушение клеток трансплантата Т-киллерами; 8) повлиять на взаимодействие иммуноглобулинов с антигенами-мишенями; 9) предотвратить повреждение ткани неспецифическими клетками или иммунными комплексами; 10) вызвать истинную специфическую иммунологическую толерантность к антигенам трансплантата.
Стандартная иммуносупрессия сегодня состоит в применении циклоспорина, азатиоприна и преднизолона. Из-за нефротоксических свойств циклоспорина антилимфоцитарные глобулины (АЛГ) или азатиоприн, или оба вместе используются до тех пор, пока функция почки не приблизится к нормальной. Когда эта функция стабилизируется, АЛГ отменяются, а циклоспорин назначается. В большинстве, центров в настоящее время сочетание этих препаратов применяется у каждого больного индивидуально. Комплексная терапия препаратами разнонаправленного действия позволяет достичь максимальной иммуносупрессии при минимальных побочных эффектах, сопровождающих применение каждого из препаратов в отдельности в высоких концентрациях. При эпизодах отторжения применяют более высокие дозы преднизолона или метилпреднизона. В большинстве центров применение моноклональных антилимфоцитарных антител используется для борьбы с реакцией отторжения в случаях резистентности к стероидам. Время, в течение которого будет работать пересаженная почка, зависит от совместимости пациента и донорской почки. Если, несмотря на прием лекарств, произойдет отторжение, больной возвращается на лечение диализом, и его вновь заносят в лист ожидания.
Применение активных методов лечения - гемодиализа, перитонеального диализа, трансплантации почки улучшило прогноз при терминальной ХПН и продлило сроки жизни больных на 10-12 и даже 20 лет.
Сорбционные методы детоксикации основаны на способности многих вредных продуктов, имеющих электрический заряд их молекул, фиксироваться на поверхности сорбентов. Фиксация химических агентов происходит за счет образования ковалентных или ионных связей вещества с активными группами поглотителя. Те патологические вещества, которые имеют замкнутую структуру и поэтому электрически нейтральны (например, иммунные комплексы, некоторые виды аллергенов, холестерин и др.) не способны задерживаться сорбентом.
Для гемосорбции используются сорбенты двух классов: неселективные, поглощающие из крови несколько веществ, и селективные, извлекающие вещества определенной структуры. К первой группе относятся активированные угли, на поверхности которых собираются индолы, скатолы, гуанидиновые основания, жирные кислоты, билирубин, органические кислоты и т.д. К селективным сорбентам относятся ионообменные смолы, способные удалять из организма ионы калия, аммоний, гаптоглобин, билирубин.
Пропускание крови через колонку с сорбентом (активный уголь, ионообменные смолы) называется гемосорбцией. Гемосорбция позволяет выводить токсические вещества (в том числе вещества средней и высокой молекулярной массы) непосредственно из кровотока. Процедура гемосорбции предусматривает возвращение больному очищенной крови, в то время как токсины, вызвавшие патологический процесс, остаются в сорбционной коробке. При хронических заболеваниях почек сочетание гемодиализа и гемосорбции дает не суммарный, а усиленный лечебный эффект. Этому способствует разработка и использование различных типов биоспецифичных гемосорбентов, позволяющих удалять широкий спектр имеющихся токсинов.
После первой процедуры наблюдается значительное снижение концентрации патологических продуктов, но спустя несколько часов их концентрация в крови повышается и приближается к исходной. Объясняется это тем, что в сосудистое русло активно поступают вещества, растворенные в тканевой и клеточной жидкости. Удалить эти вещества могут последующие эфферентные процедуры, что приводит, в конечном счете, к снижению концентрации патогенных веществ в организме и длительной ремиссии (отсутствии проявлений болезни) или даже выздоровлению. Поэтому для достижения стойкого положительного эффекта рекомендуется проведение не менее 3-х процедур.
Одной из разновидностей гемосорбции является очищение организма путём введения сорбента внутрь через рот. Обычно это активированный уголь в виде водной взвеси до 15 г, назначают 3 раза в день в течение 7 суток. Приём пищи и медикаментов осуществляется за 1,5 часа до и после приёма сорбента. По клиническим показаниям курсы повторяют с 5-ти дневным перерывом. Метод прост и удобен в амбулаторной практике.
В.А.ФИЛИППОВИЧ
Почечная колика – наиболее частое патологическое состояние в неотложной урологии.
Почечной коликой называется внезапно возникающая сильная, приступообразная, как правило, односторонняя боль в поясничной области с иррадиацией в низ живота, пах, наружные половые органы, бедро.
Наиболее частой (но не единственной) причиной почечной колики является остро наступившая обтурация мочеточника камнем. Другими причинами могут являться тампонада лоханки и мочеточника сгустками крови при опухолях, окклюзия мочеточника казеозными массами при туберкулезе почек, перевязка мочеточника во время гинекологических операций. При почечной колике нарушается пассаж мочи по верхним мочевым путям (чашечно-лоханочная система и мочеточник), возникает внутренняя окклюзия или внешнее сдавление верхних мочевых путей, что приводит к резкому повышению давления в чашечно-лоханочной системе, отеку паренхимы и растяжению фиброзной капсулы почки.
Клиническая картина почечной колики характеризуется:
-беспокойным поведением пациента с беспрерывным перемещением тела в поисках позы, снижающей силу боли. Болью внезапной, постоянной и схваткообразной, длительной (до 10–12 ч)
-чувством страха
-тошнотой и рвотой, возникающей на высоте приступа почечной колики.
-вздутием живота и парезом кишечника
-характерной иррадиацией по ходу мочеточника в подвздошную, паховую области, мошонку и ее органы, половой член, влагалище и половые губы. Иррадиация боли снижается с перемещением камня
Непосредственной причиной болевого синдрома при почечной колике является резкое повышение внутрилоханочного давления. Боль при ПК является следствием гиперактивации барорецепторов чашечнолоханочной системы и рецепторов фиброзной капсулы, которая по ThXILI сегментам спинного мозга передается в виде афферентных импульсов в кору головного мозга, где трансформируется как боль. При почечной колике происходит экстравазация мочи за счет возникновения лоханочно-почечных рефлюксов.
Существуют два основных вида лоханочно-почечных рефлюксов. Они отличаются друг от друга различным местом проникновения содержимого лоханки в почечную паренхиму и различной морфологической и рентгенологической картиной.
1. затекание лоханочного содержимого в канальцы сосочка без надрыва слизистой чашечки с последующим проникновением далее из канальцев в межуточную почечную ткань называется тубулярным рефлюксом.
2. Явление проникновения содержимого лоханки в почечную интерстициальную ткань и ее сосуды в результате нарушения целости слизистой чашечки в области форникса называется форникальным рефлюксом.
Среди всех видов рефлюксов форникальные наблюдаются в 76,2%., а тубулярные в 23,8%.
При наличии в лоханке инфекции последняя во время приступа почечной колики может внедряться более глубоко в паренхиму почки, увеличивая зону присоединившегося пиелонефрита. Течение такого приступа обычно осложняется высокой лихорадкой, развитием септического состояния, причем болевые ощущения могут значительно уменьшаться вследствие гибели рецепторных образований лоханки вплоть до исчезновения.
Возможные осложнения почечной колики:
- острый обструктивный пиелонефрит;
- бактериемический шок;
- уросепсис;
- снижение функции почки;
- формирование стриктуры мочеточника.
Диагноз почечной колики ставят на основании характерной локализации и иррадиации боли, усиливающейся при пальпации и поколачивании в области почки, на основании изменений мочи, данных ультразвукового исследования, хромоцистоскопии и внутривенной урографии, ренорадиографии.
Анализ мочи. Для почечной колики характерно наличие эритроцитов в моче (микро и макрогематурия). При МКБ макрогематурия наблюдается после приступа боли, тогда как при опухоли почки предшествует болевому приступу.
Ультразвуковое исследование. Для почечной колики характерно наличие расширения чашечно-лоханочной системы почки (гидронефроз, уретерогидронефроз). На этом фоне могут определяться камни почки и мочеточника.
Хромоцистоскопия. При почечной колике определяется отсутствие выделения индигокармина из соответствующего устья (с той стороны, где болит).
Экскреторная урография. Определяется расширение чашечно-лоханочной системы либо отсутствие функции почки (если исследование выполнено на высоте приступа). Могут определяться тени камней.
Ренорадиография. На стороне поражения при почечной колике отмечается кривая обструктивного типа.
Почечную колику дифференцируют со следующими состояниями:
- «острым животом» (аппендицит, печеночная колика, холецистит, панкреатит, прободная язва желудка или двенадцатиперстной кишки, кишечная непроходимость, расслоение аорты, тромбоз мезентериальных сосудов, аднексит, внематочная беременность, перекрут кисты яичника);
- грыжей межпозвонкового диска;
- межреберной невралгией (боль не схваткообразная, зависит от положения тела);
- опоясывающим лишаем (Herpes zoster).
Принцип дифдиагностики почечной колики с другими заболеваниями очень простой. Поскольку почечная колика всегда возникает в результате нарушения оттока мочи, то используются методы, позволяющие его определить. Если мы видим нарушение оттока мочи – мы говорим о почечной колике, если нет – о другом заболевании.
Основная задача лечения почечной колики состоит в восстановлении проходимости мочеточника, что ведет к снижению давления в лоханке и прекращению болей. Выделяют три группы лечебных мероприятий при почечной колике:
1.Лекарственная терапия, имеющая целью добиться расслабления мочеточника и восстановления пассажа мочи. Сюда относят применение анальгетиков, влияющих на болевую импульсацию, спазмолитиков, устраняющих патологический спазм мочеточника и нейролептиков.
Анальгетики. Ведущая роль в регуляции боли принадлежит эндогенным антиноцицептивным системам – опиоидным и неопиоидным. Основное значение имеет опиоидная система регуляции боли. Имеется несколько типов опиоидных рецепторов, локализующихся в областях ЦНС, учавствующих в интеграции болевой чувствительности и установлены взаимодействующие с ними эндо- и экзогенные опиоидные вещества.
Назначение анальгетиков рекомендуется осуществлять по следующему принципу:
- при болевом синдроме средней степени – ненаркотические анальгетики или слабые опиоиды в сочетании с адьювантными средствами (спазмолитиками, антигистаминными препаратами и нейролептиками)
- при сильном болевом синдроме или повторной почечной колике – сильные опиоиды группы морфина или синтетические опиоидные препараты в сочетании с адьювантными средствами (спазмолитиками , антигистаминными препаратами и нейролептиками).
Спазмолитики делятся на три группы.
Нейротропные спазмолитики – блокируют холинергическую передачу импульсов на переферийные окончания парасимпатических нервов гладких мышц (атропин, платифилин).
Мускулотропные спазмолитики – напрямую действуют на клетки гладкой мускулатуры независимо от иннервации (папаверин, галидор, но-шпа).
Нервомускулотропные спазмолитики – обладают обоими вышеуказанными эффектами (баралгин- комбинация спазмолитиков с нейротропным и мускулотропным эффектом и сильнодействующего центрального анальгетика).
Нейролептики – препараты, затрудняющие поступление афферентной импульсации в ретикулярную формацию ствола мозга. Этим объясняется усиление нейролептиками действия анальгетиков (аминазин, левомеразин, дроперидол).
Антигистаминные препараты блокируют в кровяном русле биогенные амины (гистамин, серотонин), обладают седативным и противовоспалительным действием (димедрол, дипразин, супрастин). Спазмолитическим действием препараты данной группы не обладают.
2.Рефлекторные воздействия на соответствующие зоны путем тепловых процедур (грелки, горячая ванна), а так же блокады (хлорэтиловые, семенного канатика или круглой связки матки по М.И.Лорин-эпштейну.
3.Внутрипузырные манипуляции, направленные не восстановление нарушенного пассажа мочи – разгрузочная катетеризация лоханки, дренаж лоханки при помощи стента, новокаиновая блокада устья мочеточника, удаление камня петлей. Применяются, если облегчения боли невозможно достичь терапевтическими средствами.
После купирования приступа или самостоятельного его стихания больному необходимо провести обследование для выяснения причины почечной колики. Никогда не следует забывать, что почечная колика — это только синдром, а не болезнь, что она может быть вызвана самыми различными заболеваниями мочеполовой системы и лечебная тактика зависит от характера этого заболевания.
ГЕМАТУРИЯ.
Гематурия— наличие крови в моче. В тех случаях, когда присутствие крови в моче определяется на глаз, говорят о макрогематурии, а когда эритроциты выявляются с помощью микроскопа — микрогематурии.
Этиология. Причины гематурии достаточно разнообразны и многочисленны. Большинство урологических заболеваний могут быть причиной гематурии. Однако чаще всего она наблюдается при опухолях почки, мочеточника и мочевого пузыря, мочекаменной болезни, воспалении и повреждении мочевых органов. Чтобы появилась кровь в моче, необходимо нарушение целости кровеносного сосуда или сосудов сообщающихся с мочевыми путями. Это может произойти в любом органе мочевой системы. Определение крови в моче важно, во-первых, потому, что такие больные часто нуждаются в неотложной помощи, а во-вторых, потому, что гематурия является нередко первым признаком онкоурологических заболеваний.
Клиника. Моча очень чувствительна к окрашиванию кровью. Даже одной капли крови на 150 мл мочи достаточно, чтобы изменить ее цвет и вызвать предположение о примеси крови.
Примесь крови к моче может происходить в различных фазах мочеиспускания — в начале, конце или на протяжении всего акта.Если моча окрашивается кровью только в начале мочеиспускания (в 1-й порции), а последующие ее порции без видимой крови, то говорят о начальной, или инициальной, гематурии. Окрашивание кровью только последних порций мочи называют конечной, или терминальной, гематурией, если же кровь равномерно окрашивает всю струю мочи, т. е. все ее порции, то речь идет о полной, или тотальной, гематурии. Важную роль в определении вида гематурии имеет трехстаканная проба.
Вид гематурии позволяет ориентировочно определить отдел мочевых путей, откуда происходит кровотечение. Инициальная (начальная) форма гематурии свидетельствует о локализации патологического процесса в периферической части мочеиспускательного канала. Однако локализация патологического процесса в тех же отделах может вызвать и терминальную гематурию. В таких случаях кровь в мочу поступает потому, что в конце мочеиспускания происходит значительное сокращение мышц промежности и мочевого пузыря. Нередко при инициальной гематурии происходит и самостоятельное выделение крови из наружного отверстия мочеиспускательного канала. Это бывает при повреждениях уретры, при полипах и папилломах висячей части уретры, при карункулах (мелких сосудистых доброкачественных новообразованиях в уретре) у женщин.
Терминальная гематурия является одним из основных симптомов заболевания шейки мочевого пузыря, заболевания предстательной железы, семенного бугорка, при камнях и опухолях мочевого пузыря. Она возникает тогда, когда в конце акта мочеиспускания резко сокращается детрузор. В результате этого при поражении шейки мочевого пузыря или заднего отдела уретры возникает травма этих отделов, что и приводит к выделению крови. Эта форма гематурии одинаково часто наблюдается как у мужчин, так и у женщин.
Тотальная гематурия представляет серьезную проблему в отношении правильного распознавания основных причин ее возникновения. Она может быть при выделении крови из мочевого пузыря, мочеточников, почечных лоханок или самих почек. Интенсивность окрашивания мочи кровью может быть различной.
Таблица. Виды гематурии в зависимости от источника и причин. (В. Ю. Лелюк, В. И. Вощула, В. С. Пилотович, Т. Е. Билейчик , 2006)
| Вид гематурии | Локализация | Возможные причины |
| Инициальная | Уретра | Стриктуры уретры, уретрит, стеноз наружного отверстия уретры, рак уретры |
| Тотальная | Мочевой пузырь, мочеточник, почка | Гидронефроз, кисты почек, камни почек и мочеточников, гломерулонефрит, физическая нагрузка, геморрагический цистит, травмы, опухоли почек, мочеточника и мочевого пузыря, камни мочевого пузыря, туберкулез, серповидно-клеточная анемия |
| Терминальная | Шейка мочевого пузыря, простата | Доброкачественная гиперплазия простаты, полип шейки мочевого пузыря, рак простаты |
Очень важно знать, предшествуют ли кровотечению боли в поясничной области или эти болевые ощущения возникают вслед за кровотечением. Гематурия, возникшая после приступа болей в пояснице, как правило говорит о мочекаменной болезни, тотальная безболевая гематурия – как правило встречается при онкологических заболеваниях мочевых органов.
Довольно часто примесь крови к моче наблюдается при мочекаменной болезни. Интенсивная гематурия может встречаться при новообразовании в мочевой системе. В этих случаях она чаще возникает как бы среди полного здоровья, внезапно, при отсутствии других видимых признаков болезни. Ее называют бессимптомной. При опухолях почек и мочевого пузыря гематурия является одним из ведущих признаков заболевания.
Гематурия опухолевого происхождения может быть значительной, в этих случаях наблюдается образование большого количества сгустков крови. Они могут переполнять мочевой пузырь, вызывая его тампонаду. Прохождение сгустков по мочеточнику нередко приводит к возникновению почечной колики. Нередко причиной гематурии являются и опухоли мочевого пузыря. Гематурия при этом может появляться неожиданно, «среди полного здоровья», как и при опухолях почек.
Воспалительные процессы почек и мочевого пузыря сами по себе редко вызывают значительные кровотечения. Однако умеренные «подкравливания» с незначительным подкрашиванием мочи встречаются часто.
Диагноз. Цель диагностики – определение источника кровотечения. Для точного установления источника кровотечения необходимо детальное обследование больного.
Как правило, обследование начинается с ультразвукового исследования почек, мочевого пузыря, предстательной железы. В ряде случаев этого достаточно, что бы определить патологию. Однако нередки случаи, когда при ультразвуковом исследовании источник кровотечения не определяется. В таких ситуациях обязательным исследованием является цистоскопия.
Цистоскопия позволяет определить источник кровотечения, если он локализуется в мочевом пузыре, а также выделение крови из устьев мочеточников, если причина кровотечения находится в почке или мочеточнике. Увидев, из какого устья выделяется кровь, можно узнать, на какой стороне должно быть сосредоточено внимание при дальнейшем обследовании. Поэтому любая гематурия, в том числе и так называемая бессимптомная, является прямым показанием для немедленной цистоскопии, особенно в случаях, когда невозможно выполнить УЗИ или оно неинформативно.
В обследовании больных с гематурией широко используются рентгенологические, радиоизотопные методы исследования, компьютерная и магнитнорезонансная томография, трансуретральная уретеропиелоэндоскопия.
ОСТРАЯ ЗАДЕРЖКА МОЧЕИСПУСКАНИЯ — невозможность самостоятельного акта мочеиспускания при переполненном мочевом пузыре. Задержку мочи следует отличать от анурии, при которой мочеиспускание не происходит из-за отсутствия мочи в мочевом пузыре.
Этиология. К острой задержке мочеиспускания приводят:
· Наиболее часто острая задержка мочи развивается при заболеваниях и повреждениях мочеполовых органов. К ним относятся заболевания предстательной железы (аденома, рак, абсцесс, острый простатит), мочевого пузыря (камни, опухоли, травмы, тампонада мочевого пузыря), уретры (стриктуры, камни, травмы), полового члена (гангрена).
· нарушения иннервации мочевого пузыря, его сфинктеров и уретры;
· последствия механических препятствий к мочеиспусканию, обусловленных различными заболеваниями мочевого пузыря, предстательной железы и уретры;
· травматические повреждения мочевого пузыря и уретры;
· психогенно обусловленная острая задержка мочи.
· Причинами задержки мочи могут быть заболевания центральной нервной системы (органического и функционального характера) и заболевания мочеполовых органов. К заболеваниям центральной нервной системы относятся опухоли головного и спинного мозга, спинная сухотка, травматические повреждения со сдавлением или разрушением спинного мозга, истерия.
· Нередко острая задержка мочи наблюдается в ослеоперационном периоде, в том числе и у лиц молодого возраста. Такая задержка мочи носит рефлекторный характер и, как правило, после нескольких катетеризации полностью ликвидируется.
Клиника острой задержки мочи довольно характерна. Больные жалуются на сильные боли в нижней половине живота (надлобковой области), частые мучительные, бесплодные позывы на мочеиспускание, чувство переполнения и распирания мочевого пузыря. Сила императивных позывов на мочеиспускание нарастает, быстро делается непереносимой больными. Поведение их беспокойное. Страдая от перерастяжения мочевого пузыря и бесплодных попыток опорожнить его, больные стонут, принимают самые различные положения, чтобы помочиться (становятся на колени, садятся на корточки), давят на область мочевого пузыря, сжимают половой член. При осмотре надлобковой области отчетливо выступает припухлость в форме шаровидного тела, которое называют «пузырным шаром». Пальпация, как правило, вызывает мучительный позыв на мочеиспускание.
Диагностика причин острой задержки мочи основывается в первую очередь на достаточно характерных жалобах и клинической картине. Чаще всего, особенно у мужчин пожилого возраста, причиной острой задержки мочи является аденома предстательной железы. В диагностике аденомы предстательной железы важное место принадлежит исследованию предстательной железы через прямую кишку. Для аденомы характерно увеличение железы с сохранением плотноэластической консистенции и гладкой поверхности.
Лечение. Неотложные лечебные мероприятия при острой задержке мочи заключаются в срочном опорожнении мочевого пузыря. Задержка мочи опасна для больных не только тем, что вызывает мучительные боли, болезненные позывы, неприятные ощущения, но и тем, что может привести к тяжелым осложнениям — воспалению мочевого пузыря, почек, резкому изменению состояния пузырной стенки, ее истончению.
Опорожнение мочевого пузыря возможно тремя методами: катетеризацией мочевого пузыря, надлобковой (капиллярной) пункцией и наложением эпицистостомы. Наиболее частым и практически безопасным методом является катетеризация мочевого пузыря мягкими резиновыми катетерами. В значительном числе случаев острая задержка мочи может быть ликвидирована уже одной только катетеризацией мочевого пузыря. Наличие гнойного воспаления мочеиспускательного канала (уретрит), воспаления придатка яичка (эпидидимит), самого яичка (орхит), а также абсцесса предстательной железы служит противопоказанием для катетеризации. Она не показана и при травме уретры. Очень важно при катетеризации проводить профилактику мочевой инфекции. Все предметы, соприкасающиеся с мочевыми путями больного, — инструменты, белье, перевязочный материал, растворы, которые вводятся в мочевой пузырь и уретру, должны быть стерильными. Насильственное введение катетера недопустимо, так как при этом наносится травма мочеиспускательному каналу и после такой катетеризации возможны кровотечения из уретры (уретроррагия) или повышение температуры тела до 39-40°С с ознобами (уретральная лихорадка). Для предупреждения уретральной лихорадки перед катетеризацией и в течение одного-двух дней после нее с профилактической и лечебной целью назначают антибиотики и уроантисептики. Металлический катетер для катетеризации мочевого пузыря может быть применен при наличии опыта. Всякое грубое и насильственное введение металлического катетера может привести к повреждению уретры, иногда с образованием ложных ходов.
Техника катетеризации мочевого пузыря мягким катетером.
Процедуру проводят в асептических условиях. Руки моют и обрабатывают антисептиком. Наружное отверстие мочеиспускательного канала обрабатывают раствором фурацилина. У мужчин процедуру выполняют в положении больного на спине со слегка разведенными ногами. Катетер предварительно смазывают стерильным глицерином или вазелиновым маслом. Половой член берут левой рукой вблизи головки так, чтобы было удобно раскрыть наружное отверстие мочеиспускательного канала. Катетер вводят правой рукой при помощи пинцета очень плавно, половой член при этом как бы натягивают на катетер. Больному предлагают сделать несколько глубоких вдохов, на высоте вдоха, когда расслабляются мышцы, закрывающие вход в мочеспускательный канал, продолжая оказывать мягкое давление, вводят катетер. О его нахождении в мочевом пузыре свидетельствует выделение мочи. Если катетер ввести не удается, то при ощущении сопротивления не следует применять усилий, т.к. это может привести к серьезным травмам. В этом случае следует прибегнуть к катетеризации мочевого пузыря металлическим катетером.
ПРИАПИЗМ
Приапизмом называют длительную (свыше 4—6 ч) эрекцию полового члена, не сопровождающуюся половым возбуждением. Это заболевание названо по имени Приапа, сына Дионисия и Афродиты, бога плодородия и покровителя чувственных наслаждений в древнегреческой мифологии.
Известно более 50 этиологических факторов приапизма. Наиболее часто к его развитию приводят заболевания нервной системы (рассеянный склероз, опухоли, травмы головного и спинного мозга); неопластические процессы (рак мочевого пузыря, предстательной железы, почки); гематологические заболевания (серповидно-клеточная анемия, лейкозы); фармакологические факторы (интракавернозное введение вазоактивных препаратов, особенно папаверина), использование ряда психотропных препаратов; гипотензивных средств (празозин); промежностная травма и травма полового члена с повреждением кавернозной артерии. Когда не удается выяснить причину патологической эрекции, приапизм именуют как идиопатический.
Патогенез приапизма определяется неадекватностью притока и оттока крови в кавернозные тела. Различают два типа патологической эрекции: артериальный (неишемический, или high-flow) и веноокклюзивный (ишемический, или low-flow). Веноокклюзивный приапизм — наиболее частая форма заболевания. Он развивается вследствие снижения венозного кровотока и стаза крови, сопровождается выраженной болью ишемического характера. Артериальный приапизм развивается в связи с избыточным притоком крови в кавернозные тела при нормальном венозном оттоке. При этом виде приапизма ишемические процессы в половом члене не развиваются, больные не испытывают болевых ощущений.
Диагноз приапизма выставляется при эрекции более 4-6 ч, не связанной с сексуальным желанием и не исчезающей после эякуляции.
Лечение приапизма.
В течение первых 6 часов проводится стандартная консервативная терапия, включающая применение холода, транквилизаторов, средств, улучшающих реологические свойства крови.
Если это оказалось неэффективным и приапизм длится свыше 6 часов, то проводится аспирация крови из кавернозных тел, промывание с фенилэфрином. Однако при лечении приапизма (ишемического и неишемического) сроками более 24 ч адреномиметики использовать нежелательно, т.к. они могут усилить ишемию. Показаниями к продолжающейся консервативной терапии при ишемическом приапизме являются снижение интракавернозного давления менее 40 мм рт. ст. при рН крови 7,35-7,45.
При персистировании приапизма с превышением интракавернозного давления более 40 мм рт.ст. показано выполнение шунтирующих операций.
Операции при приапизме.
1. Дистальное шунтирование - выполнение анастомоза между эрегированными кавернозными телами и головкой полового члена по методу Winter, Al-Ghorab, Sacher, в разных модификациях.
Проксимальное шунтирование:
-между губчатым телом уретры и кавернозным телом — спонгиокавернозпый шунт (метод R. Quackcls; Barry);
-между кавернозным телом и подкожной веной бедра (метод J. Graychach). Последний метод является предпочтительным.
Прогноз. При длительности заболевания заболевании более суток и отсутствии адекватного лечения начинают развиваться некротические процессы в кавернозной ткани. Снижение внутрикавернозного давления ниже 40 мм рт. ст., сдвиг рН крови в сторону резкого ацидоза расценивается как свидетельство гибели кавернозной ткани и наступление дегенеративных изменений, исходом которых будет кавернозный фиброз с полной утратой эректильной функции, лечение которого требует фаллопротезирования.
Своевременно выполненное хирургическое лечение (наложение сафенокавернозного анастомоза) позволяет надеяться на восстановление эректильной функции.
ПАРАФИМОЗ
Парафимоз - это ущемление головки полового члена узкой крайней плотью. При этом суженная крайняя плоть с усилием сдвигается за головку полового члена и приводит к циркулярному её сдавлению. Появляется сильная боль, затрудняется мочеиспускание и нарастает отёк головки полового члена и крайней плоти, головка увеличивается в объёме, что ещё в большей степени нарушает гемодинамику.
Возникает порочный круг: сдавление усиливает отёк, а отёк, в свою очередь, усиливает сдавление.
Если своевременно не вернуть крайнюю плоть на место, при длительном ущемлении может развиться некроз ущемляющего кольца и частично головки полового члена.
Лечение парафимоза.
При возникновении парафимоза в первую очередь предпринимается попытка вправления полового члена в ущемляющее кольцо. Для этого, смазав головку полового члена вазелином, средним и указательным пальцем обоих кистей плотно охватывают половой член ниже ущемляющего кольца. В то же время большим пальцем стараются продвинуть головку члена в ущемляющее кольцо, одновременно натягивая на неё крайнюю плоть. Если эта манипуляция оказывается безуспешной, то необходимо рассечь ущемляющее кольцо и сдвинуть крайнюю плоть за головку полового члена.
Профилактика парафимоза. Как правило причина возникшего ущемления связана с фимозом. Поэтому, если у пациента возникает повторное ущемление головки узкой крайней плотью, то приходится прибегать к хирургическому лечению – круговому иссечению крайней плоти.
Клиническая классификация.
Ведущей клинической классификацией ДГПЖ является классификация Гюйона (1899), основанная на характеристиках функционального состояния мочевого пузыря и как следствие изменении количества остаточной мочи. В настоящее время предлагаются попытки создания более совершенных классификаций, в которых независимо учитывались бы ведущие клинические характеристики заболевания: симптомы, показатель качества жизни, максимальная скорость потока мочи, объем остаточной мочи, объем предстательной железы и степень обструкции, установленная по результатам комбинированного уродинамического исследования.
Согласно классификации Гюйона в клиническом течении ДГПЖ различают три стадии: I - компенсации, II - субкомпенсации и III - декомпенсации.
В I стадии заболевания возникают расстройства мочеиспускания при полном опорожнении мочевого пузыря. Больные отмечают изменение акта мочеиспускания, которое становится менее интенсивным и более частым. Появляется никтурия до двух и более раз. Днем мочеиспускание может быть не учащено, однако оно наступает не сразу, а после некоторого периода ожидания, особенно утром. В дальнейшем наблюдается увеличение частоты дневных мочеиспусканий, на фоне уменьшения объема однократно выделяемой мочи. Характерное появление императивных (повелительных) позывов, при которых больной не может отсрочить начало мочеиспускания вплоть до неудержания мочи. Моча выделяется вялой струей, иногда падает почти вертикально, а не образует, как ранее, кривую характерно параболической формы. При этом для облегчения опорожнения мочевого пузыря больным нередко в начале или в конце мочеиспускания приходится напрягать переднюю брюшную стенку. В этой стадии состояние больного может оставаться стабильным без прогрессирования в течение долгих лет за счет резервных возможностей мочевого пузыря, верхних мочевых путей (ВМП) и почек.
Во II стадии значительно нарушается функция мочевого пузыря и появляется остаточная моча. Мочевой пузырь при мочеиспускании опорожняется не полностью, появляется остаточная моча в количестве 100-200 мл и более. Для опорожнения мочевого пузыря больные вынуждены напрягать мышцы живота на протяжении всего акта мочеиспускания. Мочеиспускание осуществляется волнообразно, прерывисто, многообразно с периодами отдыха, достигающими несколько минут. Нарастающее снижение функций почек проявляется жаждой, сухостью, горечью во рту, полиурией и другими характерными симптомами.
В III стадии развивается полная декомпенсация функции мочевого пузыря и наблюдается парадоксальная ишурия. В этой стадии опорожнение мочевого пузыря не эффективно даже при участии экстравезикальных сил. Стенка мочевого пузыря растянута, он переполнен мочой и может быть определен визуально или при пальпации внизу живота, верхний его край доходит до уровня пупка и выше. Для полной декомпенсации мочевого пузыря характерны потеря тонуса как детрузора, так и внутреннего сфинктера мочевого пузыря. При этом наблюдается парадоксальное сочетание задержки и недержания мочи — непроизвольное выделение мочи по каплям при переполненном мочевом пузыре (ischuria paradoxa). Нарушение функции почек и верхних мочевых путей приводит к хронической почечной недостаточности. Без оказания лечебной помощи больной погибает при клинических явлениях уремии.
Осложнения. Во всех стадиях заболевания возможны случаи острой задержки мочеиспускания, которой способствуют прием алкоголя, переохлаждение, так называемое ситуационное передержание мочи. Острая задержка мочеиспускания требует катетеризации мочевого пузыря, после чего иногда может восстановиться самостоятельное мочеиспускание. Большая вероятность восстановления мочеиспускания в тех случаях, когда одновременно с катетеризацией назначается медикаментозная терапия a1-адреноблокаторами. Если консервативная терапия безуспешна, то такие больные будут требовать неотложной хирургической помоши.
У ряда больных имеет место расширение вен шейки мочевого пузыря, в результате повреждения которых может возникать макрогематурия. При интенсивном кровотечении возможно образование сгустков крови и тампонада ими полости мочевого пузыря, что требует экстренного хирургического вмешательства. Наиболее часто кровотечения наблюдаются после катетеризации мочевого пузыря.
Длительный уростаз и присоединившаяся инфекция нередко способствуют образованию камней мочевого пузыря. В этих случаях характерны учащение мочеиспускания, особенно при активных движениях, тряской езде; боли, иррадиирующие в головку полового члена. Повышение внутрипузырного давления передается верхним мочевым путям, что приводит к уретерогидронефрозу и возникновению хронической почечной недостаточности.
Гиперплазия предрасполагает к возникновению воспалительного процесса в мочеполовой системе. Наиболее грозным является пиелонефрит, который протекает остро и хронически, способствует прогрессированию почечной недостаточности. Кроме того, часто у больных развивается орхоэпидидимит, простатит, уретрит.
Почти всегда
5
5
5
5
5
5
Или более раз
5
Т - первичная опухоль.
ТХ - недостаточно данных для оценки первичной опухоли.
Т0 - первичная опухоль не определяется.
Т1 - опухоль клинически не проявляется, не пальпируется и не визуализируется специальными методами.
Т1а - опухоль случайно обнаруживается при гистологическом исследовании и составляет менее 5% резецированной ткани.
Т1b - опухоль случайно обнаруживается при гистологическом исследовании и составляет более 5% резецированной ткани.
Т1с - опухоль диагностируется с помощью игольной биопсии (производимой в связи с высоким уровнем простатспецифического антигена).
Т2 - опухоль ограничена предстательной железой или распространяется в капсулу.
Т2а - опухоль поражает половину одной доли или меньше.
Т2b - опухоль поражает более половины одной доли, но не обе доли.
T2c - опухоль поражает обе доли.
Т3 - опухоль распространяется за пределы капсулы предстательной железы.
Т3а - опухоль распространяется за пределы капсулы (одно- или двустороннее).
Т3b - опухоль распространяется на семенной пузырек.
Т4 - несмещаемая опухоль или опухоль, распространяющаяся на соседние структуры (но не на семенные пузырьки): шейку мочевого пузыря, наружный сфинктер, прямую кишку, мышцу, поднимающую задний проход, и/или тазовую стенку.
М - отдаленные метастазы.
МX - определить наличие отдаленных метастазов не представляется возможным.
М0 - признаки отдаленных метастазов отсутствуют.
М1 - отдаленные метастазы.
M1a - поражение нерегионарных лимфоузлов.
M1b - поражение костей.
M1c - другие локализации отдаленных метастазов.
Лечение.
При лечении РПЖ в настоящее время используются практически все методы специфического воздействия, применяемые в онкологии — хирургический, лучевой, гормональный, лекарственный. Выбор метода лечения определяется клинической стадией опухоли на момент постановки диагноза, возрастом больного, общим состоянием его здоровья, а также пожеланием пациента относительно предстоящей терапии. Необходимо принимать во внимание степень дифференцировки опухоли, уровень простатического специфического антигена (ПСА) до лечения и его динамику после. Поскольку РПЖ, особенно в начальных стадиях — медленно протекающее заболевание, во многом выбор метода оказания помощи определяет предполагаемая продолжительность жизни больного. Например, при локализованном РПЖ у пациента, который из-за возраста или сопутствующих заболеваний может прожить менее 10 лет, желательно избегать активного вмешательства, поскольку в течение данного отрезка времени болезнь не успеет прогрессировать.
Существует 4 основных метода лечения первичного РПЖ: выжидательная тактика (динамическое наблюдение), хирургическое, лучевое и гормональное.
Лечение локализованного рака предстательной железы. При локализованном РПЖ (Т1—2) применяются:
· выжидательная тактика
· лучевая терапия
· хирургическое лечение.
Выжидательная тактика чаще используется при стадии Т1 (опухоль, не определяемая клинически, обнаруженная случайно при гистологическом исследовании), у больных пожилого возраста с высокодифференцированными формами опухолей. Применяется при обнаружении очень маленьких фокусов высокодифференцированного рака в предстательной железе, что может представлять собой т.н. «гистологический РПЖ», который почти никогда не развивается в «клинический»; при бессимптомном раке — у очень пожилого либо страдающего тяжелой болезнью пациента, а также у любого больного, который отказывается от активного вмешательства из-за нежелания подвергаться риску побочных эффектов.
В таких случаях после постановки диагноза лечение не проводится до развития симптомов рака либо признаков, говорящих о прогрессировании РПЖ (например, рост ПСА). Подход получил распространение после анализа результатов наблюдения за пожилыми мужчинами с локализованными высокодифференцированными опухолями в скандинавских странах: активации РПЖ не происходило в течение длительного времени, и большинство больных умирали от других, преимущественно сердечно-сосудистых заболеваний. Основная проблема — точность оценки предполагаемой продолжительности жизни конкретного пациента и риска прогрессирования РПЖ за этот период. Однако при локализованной форме рака простаты более распространенным является активный лечебный подход, включающий применение лучевой терапии или операцию.
Хирургическое лечение. По мнению большинства урологов, лучшим методом лечения ограниченного РПЖ является радикальная простатэктомия. Данная операция целесообразна в тех случаях, когда предполагаемая продолжительность жизни больного составляет не менее 10 лет. Эта операция, выполняемая, как правило, позадилобковым доступом, что позволяет выполнить тазовую лимфаденэктомию, подразумевает удаление предстательной железы вместе с капсулой, семенными пузырьками, простатической частью уретры, шейкой мочевого пузыря, регионарными лимфатическими узлами. Наиболее исчерпывающее описание позадилобковой простатэктомии сделано Walsh (1983). Преимуществами радикальной простатэктомии являются полное удаление опухоли, точное определение стадии заболевания, излечение сопутствующей аденомы предстательной железы, надежное подавление уровней ПСА ниже предела чувствительности качественного анализа. К недостаткам следует отнести послеоперационную летальность (до 0,5%) и такие осложнения, как импотенция (50—90%), стриктура пузырно-уретрального анастомоза (5—17%), недержание мочи (3—36%).
Лучевая терапия. При лечении локализованного и местно-распространенного РПЖ могут использоваться дистанционное облучение и интерстициальная лучевая терапия (брахитерапия). Дистанционное облучение предстательной железы и окружающей клетчатки проводится с четырех полей. Разовая доза — 1,8–2,0 Гр, суммарная — 65–70 Гр.
Совершенствование методов планирования и технического обеспечения лучевой терапии привело к внедрению т.н. конформного облучения, которое обеспечивает точное соответствие объема облучения пораженному органу. Для его проведения необходимо получить трехмерное изображение предстательной железы и соседних органов при помощи реконструкции КТ-сканов. Затем производится планирование полей облучения с использованием специальных компьютерных программ, целью которого является обеспечение доставки возможно большей дозы к предстательной железе при возможно меньшей дозе облучения, приходящейся на мочевой пузырь и прямую кишку. Эти технологические достижения дают возможность использовать бльшие дозы облучения (около 70 Гр) без увеличения осложнений. Поскольку считается, что эффект лучевой терапии дозозависим, одним из направлений улучшения ее результатов является эскаляция дозы. Ряд исследователей продемонстрировали возможность подведения дозы свыше 80 Гр без существенной токсичности и с лучшими результатами, преимущественно среди больных с местно-распространенным РПЖ. Близость прямой кишки, мочевого пузыря, кавернозных нервов и полового члена к предстательной железе обусловливает спектр осложнений лучевой терапии: постлучевые ректиты, циститы, эректильная дисфункция. Проктиты и циститы, встречаются в 5—20% случаев, недержание мочи, импотенция — в 30% случаев.
Внутритканевая лучевая терапия (брахитерапия) получила распространение в последние годы благодаря техническому обеспечению и использованию новых радиоактивных источников. Преимущество — возможность подведения очень большой дозы к железе (до 160 Гр) без существенных побочных эффектов из-за быстрого поглощения энергии облучения окружающими тканями. Применяются две методики — высоко- и низкодозного облучения.
При высокодозном используется кратковременное воздействие изотопом иридия-92. Часто сочетается с дистанционной лучевой терапией.
Низкодозная брахитерапия — это перманентная имплантация изотопов палладия-103 или йода-125 в предстательную железу. Период полураспада 103Pd — 17 дней, 125I — 60. Таким образом, предстательная железа облучается в течение 3 или 10 месяцев — в зависимости от используемого изотопа. Зерна с изотопом имплантируются в простату по специальным иглам, которые под контролем ТрУЗИ вводятся в простату через кожу промежности. Кроме обычных осложнений лучевой терапии, при таком лечении часто развивается острая задержка мочи, что требует длительной катетеризации мочевого пузыря.
Лечение диссеминированного рака предстательной железы. В связи с особенностями клинического течения заболевания и несовершенством ранней диагностики в нашей стране 60—80% больных РПЖ при первичном обращении уже имеют метастазы. Выбор методов лечения и их последовательность зависят от стадии заболевания, общего состояния пациента и чувствительности опухоли к тому или иному лечебному воздействию. Рак простаты – гормонозависимая опухоль, гормонотерапия является первичным методом лечения больных, у которых невозможно провести радикальное лечение, то есть радикальную простатэктомию. Нормальные и малигнизированные клетки простаты чувствительны к андрогенам. Еще в 1941 году Huggius and Hodges впервые показали, что кастрация и введение эстрогенов способны воздействовать на эти клетки. Существуют два основных источника андрогенов в организме: клетки Лейдига яичек, которые продуцируют тестостерон (до 95% всех андрогенов) и надпочечники, продуцирующие дегидроандростерон, дегидроандростерона сульфат и андростендион. Функционирование клеток Лейдига яичек регулируется лютеинизирующим гормоном (ЛГ) гипофиза, продукция которого, в свою очередь, стимулируется рилизинг-гормоном лютеинизирующего гормона (ЛГРГ), вырабатываемым в гипоталамусе. Существует механизм отрицательной обратной связи, когда низкие уровни тестостерона в крови стимулируют выработку ЛГРГ, что приводит к усилению выработки ЛГ и повышению уровня тестостерона. Секреция андрогенов надпочечниками регулируется адренокортикотропным гормоном. Синтез самого активного андрогена — 5a-дигидротестостерона — происходит путем трансформации тестостерона при участии фермента 5a-редуктазы, содержащегося в ткани предстательной железы. Свое действие андрогены реализуют путем связывания с внутриклеточным рецептором, после чего комплекс рецептор-гормон взаимодействует с определенными участками ДНК, стимулируя ее транскрипцию.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УЧЕРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«ГРОДНЕНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ»
КАФЕДРА ХИРУРГИЧЕСКИХ БОЛЕЗНЕЙ №2 С
КУРСОМ УРОЛОГИИ.
В.А.Филиппович
ЛЕКЦИИ ПО УРОЛОГИИ ДЛЯ СТУДЕНТОВ IV КУРСА ГРОДНЕНСКОГО ГОСУДАРСТВЕННОГО МЕДИЦИНСКОГО УНИВЕРСИТЕТА.
пособие для студентов
Гродно, 2008 год
Дата: 2019-02-02, просмотров: 332.