Переболевшие острым и подострым бруцеллёзом находятся под наблюдением на протяжении 2 лет с момента заболевания, если отсутствуют клинико-иммунологические признаки хронизации процесса.
Переболевших обследует врач КИЗа в первый год через 1–3, 6, 9, 12 мес, а в течение второго года — ежеквартально. В это время они подлежат тщательному клиническому и серологическому обследованию (реакции Райта, РПГА, Хеддлсона).
В период диспансерного наблюдения проводят профилактическое противорецидивное лечение в первый год при каждом обследовании, в течение второго года — два раза (весной и осенью).
Переболевших острым и подострым бруцеллёзом с диспансерного учёта снимает комиссия в составе врача-инфекциониста, терапевта и эпидемиолога в том случае, если на протяжении последних 2 лет наблюдения не отмечали признаков хронизации процесса.
Больным хроническим бруцеллёзом ежеквартально проводят тщательное клиническое обследование с обязательной термометрией и серологическим исследованием (реакции Райта и РПГА). В периоды, наиболее неблагоприятные для течения заболевания (весной и осенью), необходимо противорецидивное лечение.
Переболевших хроническим бруцеллёзом снимают с диспансерного учёта так же, как и лиц с острым и подострым бруцеллёзом.
Пациентов с резидуальным бруцеллёзом направляют на лечение к соответствующим специалистам в зависимости от преимущественного поражения органов и систем.
Чабаны, доярки, ветеринарные работники, работники мясокомбинатов и другие профессиональные группы подлежат постоянному диспансерному наблюдению в течение всего периода работы.
Лица, взятые на учёт как подозрительные на заболевание бруцеллёзом (с положительными серологическими реакциями или аллергической пробой Бюрне) без явных клинических проявлений, должны обследоваться не реже одного раза в квартал. Если титр серологических реакций нарастает, больных повторно обследуют не реже одного раза в 2 мес, при необходимости назначают лечение.
Профилактика бруцеллеза
Основное направление — профилактика бруцеллёза у сельскохозяйственных животных: предупреждение заноса в благополучные хозяйства, систематические обследования и выбраковка больных животных в неблагополучных хозяйствах, вакцинация животных, гигиеническое содержание и дезинфекция помещений, в которых находятся животные. Лица, ухаживающие за ними, должны носить спецодежду, систематически обследоваться на бруцеллёз. Обязательны пастеризация молока, выдерживание брынзы не менее 2 мес, а твёрдых сыров — 3 мес. Работникам животноводства (а по показаниям — населению неблагополучных районов) вводят бруцеллёзную сухую живую вакцину (надкожно в объёме 2 капель или подкожно — 5 мл). Ревакцинацию проводят в половинной дозе через 10–12 мес.
Лептоспироз
Лептоспироз (болезнь Васильева–Вейля, инфекционная желтуха, японская 7-дневная лихорадка,, водная лихорадка, иктерогеморрагическая лихорадка и др.) — острая зоонозная природно-очаговая инфекционная болезнь с преимущественно водным путём передачи возбудителя, характеризующаяся общей интоксикацией, лихорадкой, поражением почек, печени, ЦНС, геморрагическим диатезом и высокой летальностью.
Коды по МКБ -10
А27.0. Лептоспироз желтушно-геморрагический.
А27.8. Другие формы лептоспироза.
А27.9. Лептоспироз неуточнённый.
Этиология лептоспироза
Род Leptospira (лептоспира) семейства Leptospiraceae представлен двумя видами: паразитическим — L. interrogans и сапрофитным — L. biflexa. Оба вида подразделяют на многочисленные серотипы. В основу классификации лептоспир положено постоянство их антигенной структуры. На сегодняшний день известно 25 серо- групп, объединяющих около 200 патогенных серотипов лептоспир.
Возбудитель лептоспироза человека и животных относят к виду L. interrogans. Наибольшую роль в структуре заболеваемости имеют серогруппы L. interrogans icterohaemorragiae, поражающая серых крыс, L. interrogans pomona, поражающая свиней, L. interrogans canicola — собак, а также L. interrogans grippotyphosa, L. interrogans hebdomadis.
Лептоспиры — тонкие, подвижные микроорганизмы спиралевидной формы длиной от нескольких до 40 нм и более и диаметром от 0,3 до 0,5 нм.
Лептоспиры грамотрицательны. Это строгие аэробы. Факторы патогенности лептоспир — экзотоксиноподобные вещества, эндотоксин, ферменты (фибринолизин, коагулаза, липаза и др.), а также инвазивная и адгезивная способность.
Лептоспиры чувствительны к воздействию высоких температур: кипячение их убивает мгновенно, нагревание до 56–60 °С — в течение 20 мин. К действию низких температур лептоспиры более устойчивы. Так, при –30–70 °С и в замороженных органах они сохраняют жизнеспособность и вирулентность (способность к заражению) в течение многих месяцев. Жёлчь, желудочный сок и кислая моча человека губительно действуют на лептоспиры, а в слабощелочной моче травоядных они остаются жизнеспособными в течение нескольких суток. В воде открытых водоёмов при слабощелочной или нейтральной её реакции лептоспиры сохраняются в течение 1 мес, а в сырой и переувлажнённой почве они не теряют патогенность до 9 мес. На пищевых продуктах лептоспиры сохраняются до 1–2 сут, а под воздействием ультрафиолета и при высушивании погибают в течение 2 ч. Лептоспиры чувствительны к препаратам пенициллина, хлорамфениколу, тетрациклину и чрезвычайно чувствительны к действию обычных дезинфицирующих средств, кипячению, солению и маринованию. При этом низкие температуры не оказывают губительного воздействия на лептоспиры. Этим объясняют их способность зимовать в открытых водоёмах и влажной почве, полностью сохраняя вирулентность.
Эпидемиология лептоспироза
Лептоспироз — одна из самых распространённых природно-очаговых инфекционных болезней.
Источник возбудителя инфекции — дикие, сельскохозяйственные и домашние животные. Роль отдельных видов животных как источника лептоспироза далеко не одинакова в связи с различной степенью чувствительности их к этим микроорганизмам и с характером ответной реакции на заражение. Животные, у которых в результате инфицирования возникает хронический лептоспироз, а в ряде случаев и бессимптомный процесс, сопровождаемый длительным выделением лептоспир с мочой, имеют наибольшее эпидемиологическое и эпизоотологическое значение. Именно эти животные обеспечивают сохранение лептоспир как биологического вида. Наибольшее значение в природных очагах лептоспироза отводят представителям отряда грызунов, а также насекомоядным (ежи, землеройки). Носительство лептоспир доказано почти у 60 видов грызунов, из которых 53 относят к семейству мышеобразных и хомякообразных.
Биологическая пластичность лептоспир обусловливает возможность адаптации их к сельскохозяйственным и домашним животным (крупный рогатый скот, свиньи, лошади, собаки), а также к синантропным грызунам (серые крысы, мыши), которые формируют антропургические очаги инфекции, представляющие основную опасность для человека.
С эпидемиологической точки зрения важна заболеваемость крупного и мелкого рогатого скота, а также свиней. Болеют животные любого возраста, но у взрослых лептоспироз протекает чаще в скрытой форме, а у молодняка — с более выраженными симптомами.
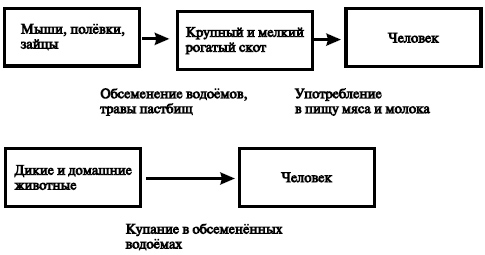
Человек не имеет значения в качестве источника инфекции.
Основной фактор передачи возбудителя лептоспироза — вода, загрязнённая выделениями (мочой) инфицированных животных. Непосредственными причинами заражения людей оказывается употребление сырой воды для питья, умывание из открытых водоёмов, купание в небольших слабопроточных прудах или переход их вброд.
Некоторое значение в передаче инфекции имеют и пищевые продукты, загрязнённые выделениями грызунов. Передача инфекции чаще всего происходит контактным путём, однако возможен и пищевой путь. Факторами передачи бывают и влажная почва, трава пастбищ, загрязнённые выделениями больных животных. Заражение может происходить при забое скота, разделке туш, а также при употреблении в пищу молока и термически не обработанного мяса. Зачастую лептоспирозом заболевают лица, имеющие профессиональный контакт с больными животными: ветеринары, дератизаторы и сельскохозяйственные работники. Для проникновения лептоспир достаточно малейших нарушений целостности кожного покрова.
Эпидемические вспышки лептоспироза происходят, как правило, в летне-осенний период. Пик заболеваемости приходится на август. Различают три основных типа вспышек: водный, сельскохозяйственный и животноводческий. Лептоспироз встречают и в виде спорадических случаев, которые могут регистрироваться в течение всего года.
Лептоспиры гидрофильны, поэтому для лептоспироза характерна высокая распространённость в областях, где много болотистых и сильно увлажнённых низменностей.
Естественная восприимчивость людей к лептоспирозной инфекции значительна. Постинфекционный иммунитет прочный, но типоспецифический, поэтому возможны повторные заболевания, вызванные другими сероварами возбудителя.
Патогенез лептоспироза
Возбудитель проникает в организм человека благодаря своей подвижности. Входными воротами служат микроповреждения кожных покровов и слизистых оболочек полости рта, пищевода, конъюнктивы глаз и др. Известны случаи лабораторного заражения лептоспирозом через повреждённую кожу. При внутрикожном проникновении в эксперименте на лабораторных животных лептоспиры проникают в кровь уже через 5–60 мин, очевидно, минуя лимфатические узлы, которые не выполняют барьерной функции при лептоспирозе. На месте внедрения возбудителя не возникает первичного аффекта. Дальнейшее распространение лептоспир происходит гематогенным путём, при этом лимфатические сосуды и регионарные лимфатические узлы также остаются интактными. С током крови лептоспиры попадают в различные органы и ткани: печень, селезёнку, почки, лёгкие, ЦНС, где происходят их размножение и накопление. Развивается первая фаза инфекции продолжительностью от 3 до 8 дней, что соответствует инкубационному периоду.
Вторая фаза патогенеза лептоспироза — вторичная бактериемия, когда количество лептоспир в крови достигает максимума и они ещё продолжают размножаться в печени и селезёнке, надпочечниках, обусловливая клиническое начало болезни. С током крови лептоспиры снова разносятся по всему организму, преодолевая даже ГЭБ. В этот период наряду с размножением лептоспир начинается их разрушение как следствие появления антител, агглютинирующих к четвёртому дню болезни и лизирующих лептоспиры. Накопление в организме продуктов метаболизма и распада лептоспир сопровождается лихорадкой и интоксикацией, что повышает сенсибилизацию организма и вызывает гиперергические реакции.
Эта фаза продолжается в течение 1 недели, однако может укорачиваться до нескольких дней. Максимальную концентрацию лептоспир к концу фазы лептоспиремии наблюдают в печени. Лептоспиры продуцируют гемолизин, который, оказывая влияние на мембрану эритроцитов, вызывает их гемолиз и высвобождение свободного билирубина. Кроме того, в печени развиваются деструктивные изменения с формированием воспаления и отёка ткани. При тяжёлом течении болезни основной фактор патологического процесса в печени — поражение мембран кровеносных капилляров, чем и объясняют наличие кровоизлияний и серозного отёка.
Патогенез желтухи при лептоспирозе носит двоякий характер: с одной стороны, распад эритроцитов вследствие токсического воздействия на мембраны гемолизина и гемолитического антигена, а также в результате эритрофагии клетками ретикулоэндотелиальной системы в селезёнке, печени и других органах, с другой — вследствие развивающегося паренхиматозного воспаления с нарушением желчеобразующей и выделительной функции печени.
Третья фаза патогенеза лептоспироза — токсическая. Лептоспиры гибнут вследствие бактерицидного действия крови и накопления антител, исчезают из крови и накапливаются в извитых канальцах почек. Накопленный вследствие гибели лептоспир токсин оказывает токсическое влияние на различные органы и системы. У части больных лептоспиры размножаются в извитых канальцах и выделяются из организма с мочой. В этом случае на первый план выступает поражение почек. Наиболее характерное поражение почек при лептоспирозе — дегенеративный процесс в эпителии канальцевого аппарата, поэтому их правильнее рассматривать как диффузный дистальный тубулярный нефроз. У больных появляются признаки ОПН с олигоанурией и уремической комой. Тяжёлое поражение почек — одна из наиболее частых причин смерти при лептоспирозе.
В фазе токсемии повреждение органов и тканей обусловлено действием не только токсина и продуктов жизнедеятельности лептоспир, но и аутоантител, образующихся в результате распада поражённых тканей и клеток макроорганизма. Этот период совпадает со второй неделей болезни, но может несколько затягиваться. Токсин оказывает повреждающее действие на эндотелий капилляров, что повышает их проницаемость с формированием тромбов и развитием ДВС-синдрома.
Центральная нервная система поражается вследствие преодоления ГЭБ лептоспирами. У части больных лептоспирозом развивается серозный или гнойный менингит, реже менингоэнцефалит. В отдельных случаях возникает специфический лептоспирозный миокардит. Патогномоничный симптом лептоспироза — развитие миозита с поражением скелетных, особенно икроножных мышц. Часто поражаются лёгкие (лептоспирозная пневмония), глаза (ириты, иридоциклиты), реже другие органы.
Дата: 2019-02-02, просмотров: 410.