| Мессенджер | Мессенджер-продуцирующий фермент |
| Циклический аденозинмонофосфат (цАМФ) | Аденилатциклаза |
| Циклический гуанозинмонофосфат (цГМФ) | Гуанилатциклаза |
| Инозитолтрифосфат (ИФ3) | Фосфолипаза С |
| Диацилглицерол (ДАГ) | Фосфолипаза С |
| Ионы кальция (Са2+) | Кальциевый канал |
| Монооксид азота (NO) | NO-синтаза |
| Монооксид углерода (CO) | Гем-оксигеназа |
Мембранный механизм действия гормонов характеризуется не только каскадностью (многоэтапностью), но и способностью на каждом этапе передачи усиливать сигнал. Например, одна молекула гормона связывается с одним рецептором, который взаимодействует с несколькими G-белками, от каждого из которых диссоциируют α-субъединицы. Активированная ими аденилатциклаза синтезирует множество молекул цАМФ. Каждая молекула цАМФ аллостерически активирует несколько молекул протеинкиназ, каждая из которых, в свою очередь, фосфорилирует несколько молекул белка (рис. 6).
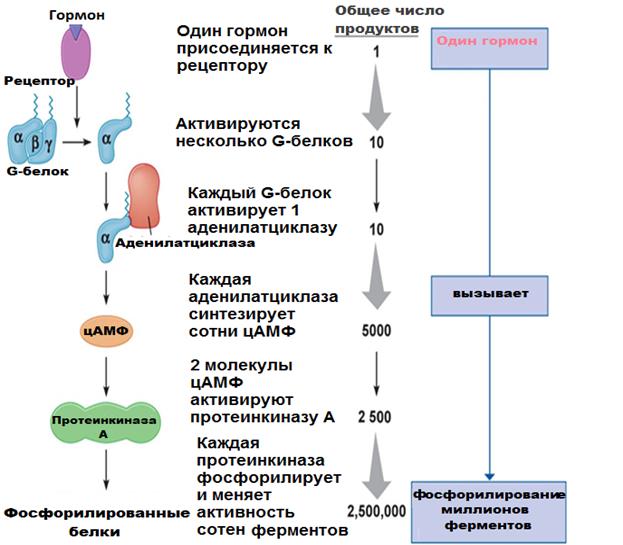
Рис. 6. Каскадный механизм передачи гормонального сигнала в клетку (https://megalektsii.ru/s9460t7.html).
Так, с помощью своеобразных «транзисторов» исходный слабый сигнал гормона усиливается примерно 103-108 раз. Например, концентрация гормонов, регулирующих содержание глюкозы в крови здорового человека, колеблется в пределах 10-6-10-11 ммоль/л, а концентрация глюкозы – может изменяться под влиянием гормонов на несколько миллимолей (10-3 М). Т.е. с помощью каскадного механизма регуляторный эффект этих гормонов усиливается в 1000 – 100 000 раз (рис. 6).
Для аденилатциклазной системы характерна представленная на рис. 7 последовательность событий при передаче гормонального сигнала.
Гормон связывается с рецептором и образуется ГР-комплекс, что вызывает конформационные изменения всего рецептора. Цитоплазматический участок рецептора связан с особыми мембранными белками-трансдукторами (G-белками). G-белок является олигомерным и состоит из α-, β- и γ-субъединиц. Β- и γ- субъединицы заякорены на мембране. А α-субъединица является поверхностым белком и может диссоциировать от всего комплекса. В отсутствии гормона α-субъединица связана с молекулой ГДФ. При присоединении гормона к рецептору в G-белке развивается кооперативный эффект, что повышает сродство α-субъединицы к ГТФ. Присоединение ГТФ способствует диссоциации α-субъединицы от G-белка. Отделившаяся α-субъединица комплементарна аденилатциклазе и, связываясь с ней, переводит ее в активное состояние. Аденилатциклаза является погруженным в мембрану белком и катализирует реакцию образования цАМФ из АТФ. Активный центр аденилатциклазы открыт в цитозоль, поэтому образовавшаяся цАМФ, оказавшись в цитозоле, связывается с цАМФ-зависимой протеинкиназой (протеинкиназой А).
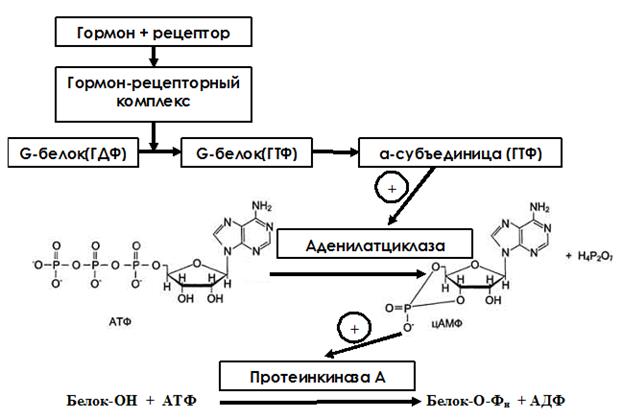
Рис. 7. Схема аденилатцикалазного механизма передачи гормонального сигнала в клетку.
В неактивном состоянии протеинкиназа А – олигомерный белок, состоящий из 4 субъединиц: двух регуляторных и двух каталитических. Присоединение цАМФ к регуляторным субъединицам ведет к конформационным изменениям всего белка. Каталитические субъединицы становятся некомплементарными регуляторным и отделяются (диссоциируют) от них. В диссоциированной форме каталитические субъединицы протеинкиназы А активны и катализируют реакции фосфорилирования белков по серину и треонину. Каталитические субъединицы специфичны к белкам-субстратам. Присоединение остатка фосфорной кислоты от АТФ к уже имеющемуся в клетке белку ведет к изменению его конформации, а, следовательно, и активности, если этот белок является ферментом. Напомним, что такая регуляция каталитической активности у ферментов называется регуляцией путем фосфорилирования и дефосфорилирования.
30 гормонов через 45R увеличивают концентрацию цАМФ (кортикотропин, глюкагон, паратирин, кальцитонин, катехоламины (β-рецепторы), гистамин (Н2-рецепторы) и др.).
31 гормон снижают концентрацию цАМФ (соматостатин, мелатонин, опиоиды, хемокины, катехоламины (α2-рецепторы), γ-аминомасляная кислота и др.).
цАМФ также регулирует геномные процессы, участвует в патогенезе холеры, коклюша и муковисцидоза.
После выполнения гормоном его регуляторной функции необходимо прекратить передачу гормонального сигнала. Для этого на каждом этапе существует система остановки передачи. Так, фермент фосфодиэстераза дециклизует цАМФ (рис. 8), а фосфопротеинфосфатазы дефосфорилируют фосфорилированные белки.
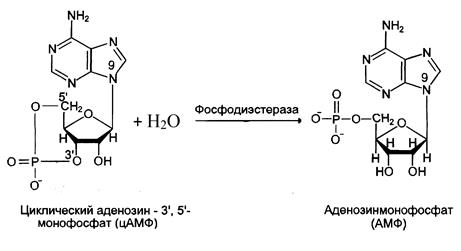
Рис. 8. Дециклизация цАМФ.
Гуанилатциклазный механизм включает в себя активацию мембранного фермента гуанилатциклазы различными гормонами или цитокинами. Появление в цитозоле клеток-мишеней циклического гуанозинмонофосфата (цГМФ) стимулирует активность протеинкиназы G (цГМФ-зависимой протеинкиназы), которая, в свою очередь, фосфорилирует специфические клеточные белки. Например, предсердный натрийуретический гормон, действуя подобным образом, способствует фосфорилированию белков ионных каналов почечных канальцев, результатом чего является повышение экскреции ионов Na+. Некоторые вазодилататоры, например оксид азота ( NO), лекарственные нитраты (нитроглицерин) и др. используют гуанилатциклазный механизм для расслабления гладкой мускулатуры сосудов, результатом чего является расширение просвета сосудов и улучшение кровотока через орган (например, миокард). Гуанилатциклазный механизм используют также гормоны задней доли гипофиза (окситоцин) и щитовидной железы (кальцитонин). Регуляторные эффекты этих гормонов указаны в табл 2.
При использовании инозитол-3-фосфатной системы передачи гормонального сигнала в клетку происходят следующие события:
Образование ГР-комплекса вызывает конформационные изменения, передающиеся на G-белок, при этом α-субъединица G-белка становится некомплементарна ГДФ и увеличивает комплементарность к ГТФ. Она диссоциирует от белка и активирует фосфолипазу С. Фосфолипаза С – поверхностный белок. Она катализирует гидролиз фосфотидилинозитол-4,5-дифосфата до диацилглицерола (ДАГ) и инозитол-1,4,5-трифосфта (ИФ3), которые являются промежуточными посредниками передачи гормонального сигнала в клетку. ИФ3 - водорастворимое вещество, стимулирующее высвобождение ионов Са2+ из эндоплазматического ретикулума. Са2+ связывается с белком кальмодулином, комплекс Са2+-кальмодулин активирует Са2+-кальмодулин-зависимую протеинкиназу. Ионы Са2+ также могут связываться с другой протеинкиназой – протеинкиназой С – и активировать ее. Кроме того, регуляторный домен этого фермента имеет участок связывания с ДАГ. ДАГ – гидрофобное вещество и всегда находится в составе липидного бислоя мембраны. При контакте с ДАГ протеинкиназа С повышает свое сродство к ионам Са. Активная каталитическая субъединица осуществляет реакцию фосфорилирования белков по серину и треонину, что ведет к изменению их конформации и активности. В результате меняется метаболизм клетки-мишени и формируется специфический клеточный ответ на регуляторное действие гормона (рис. 9).
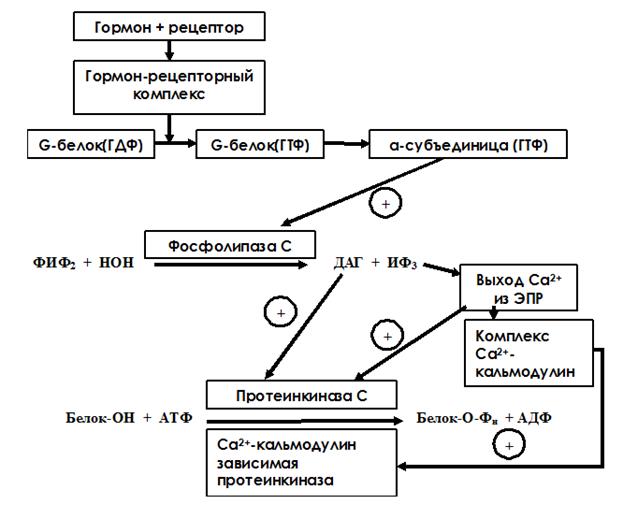
Рис. 9. Схема инозитол-3-фосфатного механизма передачи гормонального сигнала в клетку.
Такой тип передачи гормонального сигнала в клетку характерен для вазопрессина (рецептор V1) и адреналина (рецептор α1).
Подавление сигнала осуществляется за счет закачивания Ca2+ в ЭПР и образования фосфатидилинозитолдифосфата из ДАГ и ИФ3. Фосфопротеины дефосфорилируются фосфопротеинфосфатазой.
Еще одним примером мембранного механизма передачи гормонального сигнала в клетку является механизм действия инсулина. Рецептор инсулина состоит из четырех субъединиц:
- 2 α-субъединицы лежат на внешней стороне мембраны, образуют центр связывания с инсулином;
- 2 β-субъединицы – интегральные белки, пронизывают бислой, на внутриклеточных доменах имеют активный центр, способны катализировать реакцию фосфорилирования белков по тирозину, то есть обладают каталитической активностью (рис. 10).
Присоединение инсулина к α-субъединицам ведет в конечном итоге к изменению конформации всего рецептора и активных центров на β-субъединицах, происходит их активация. Сначала β-субъединица фосфорилирует по остатку тирозина соседнюю β-субъединицу (аутофосфорилирование). Это приводит к конформационным изменениям активных центров и изменению их субстратной специфичности. Субстратами становятся внутриклеточные белки – субстраты инсулинового рецептора – IRS (от англ. insulin receptor substrate). Фосфорилированные по тирозину IRS-белки активируют фосфопротеинфосфатазу.
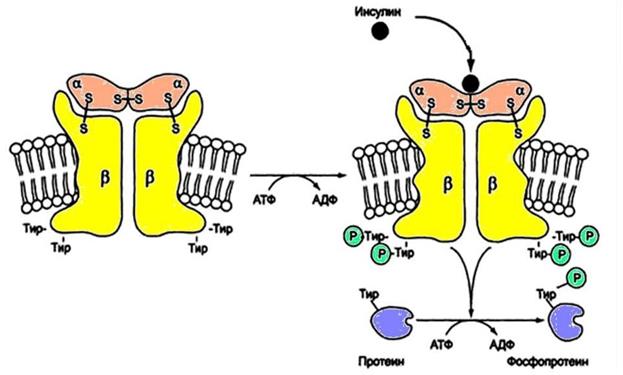
Рис. 10. Инсулиновый рецептор. Тирозинкиназный механизм передачи сигнала в клетку-мишень (https://en.ppt-online.org).
Фосфопротеинфосфатаза осуществляет гидролитическое отщепление остатка фосфорной кислоты от фосфорилированных по серину и треонину белков, участвующих в регуляции клеточного метаболизма:
Белок-О-Фн + Н2О → Белок-ОН + Фн.
Кроме того, IRS-белки активируют фосфодиэстеразу, которая дециклизует цАМФ.
Таким образом, инсулин действует как антагонист глюкагона и адреналина, выполняя функцию снижения концентрации глюкозы в крови.
Дефосфорилирование рецептора тирозиновой фосфопротеинфосфатазой возвращает его в неактивное состояние.
Для инсулинового рецептора известны и другие варианты передачи гормонального сигнала в клетку. Например, ГР-комплекс вместе с участком мембраны способен проникать (интернализация) в цитоплазму и в ядро, связываться с ДНК и изменять активность синтеза некоторых белков, что демонстрирует возможность мембранных гормонов действовать аналогично цитоплазматическим.
Дата: 2018-12-21, просмотров: 510.