Химическая кинетика - это учение о скорости химических реакций, основная ее задача - управление химическими процессами с целью обеспечения большей скорости реакции и максимального выхода продукта.
Одним из основных понятий в химической кинетике является скорость реакции. Скоростью химической реакции ύ называют изменение количества реагирующего вещества за единицу времени в единице реакционного пространства.
Реакции могут протекать с различными скоростями. Одни из них проходят почти мгновенно, другие - очень медленно. Скорость реакции определяется прежде всего природой реагирующих веществ. Но реакция, имеющая практически нулевую скорость при комнатной температуре, может протекать быстро при нагревании. Можно ускорить взаимодействие и при помощи катализатора. Скорость химической реакции зависит от условий протекания процесса. Итак, скорость гомогенной химической реакции измеряется изменением концентрации одного из веществ, участвующих в процессе, за единицу времени, концентрация С выражается обычно в моль/л, а время t - в минутах или секундах; поэтому размерность скорости реакции моль/л·мин или моль/л·с.
Изменение концентрации исходных веществ и продуктов реакции во времени представлена графиком:

 C
C
 2
2
1
 |
t
Здесь 1 - изменение концентрации исходного вещества, 2 -изменение концентрации продукта реакции.
При химической реакции концентрации исходных веществ уменьшаются во времени, а продуктов реакции - возрастает. Истинная скорость реакции определяется пределом, к которому стремится отношение ΔС/t при Δt—»0, то есть производной концентрации по времени: 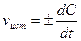 . Если измеряется скорость образования продуктов реакции, то скорость реакции положительна; если измеряется скорость расходования исходных веществ -скорость реакции отрицательна.
. Если измеряется скорость образования продуктов реакции, то скорость реакции положительна; если измеряется скорость расходования исходных веществ -скорость реакции отрицательна.
Необходимым условием осуществления химического взаимодействия между двумя молекулами должно их столкновение. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходит тем чаще, чем больше этих молекул. Поэтому скорость химической реакции зависит от концентрации реагирующих веществ. По мере уменьшения концентрации исходных веществ во времени скорость реакции падает.
Закон действия масс
Закон действия масс открыт в 1867 году двумя учеными К. Гульдбергом и П. Ваге. При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции m А+ n В = С этот закон выражается соотношением ύ= k [ A ] m [ B ] n
Здесь [А], [В] - концентрации реагирующих веществ в моль/л, m, n - стехиометрические коэффициенты, k - константа скорости реакции, л/моль·с. При [А]=[В]=1 моль/л ύ = k.
Следовательно, константа скорости выражает собой скорость данной реакции при условии, что концентрации реагирующих веществ равны 1 моль/л. Чем выше величина k, тем быстрее протекает данная реакция. Константа скорости зависит от температуры и природы реагирующих веществ.
Дата: 2018-12-21, просмотров: 632.