
 2. Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи:
2. Индукционное взаимодействие. При воздействии диполей на неполярные молекулы возникают наведенные диполи:





 3. Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования:
3. Дисперсионное притяжение возникает за счет возникновения мгновенных диполей и их суммирования:
 |  | ||||||
 | |||||||
 | |||||||
Энергия вандерваальсовых взаимодействий невелика и выражается уравнением: 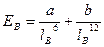 , где a и b - константы, lB - расстояние между молекулами, Ев - энергия.
, где a и b - константы, lB - расстояние между молекулами, Ев - энергия.
Водородная связь - это химическая связь, образованная положительно поляризованным водородом, химически связанным в одной молекуле, и отрицательно поляризованным атомом фтора, кислорода и азота (реже хлора, серы и др.), принадлежащих другой молекуле. Водородная связь может быть внутримолекулярной, если она образуется между двумя группами одной и той же молекулы, и межмолекулярной, если она образуется между разными молекулами (А-Н + В-К = А-Н...В-К).
Энергия и длина водородной связи. Энергия возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов. Водородная связь более прочная, чем вандерваальсово взаимодействие, но менее прочная, чем ковалентная связь. Аналогичную зависимость имеет и длина связи.

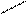


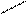
 Н 0,036 О Н 0,177 О
Н 0,036 О Н 0,177 О
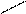
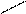 О + Н Н = О......Н Н
О + Н Н = О......Н Н
Н Н
F–H + F- = [ F–H…H ]–
0.092 0.126
Водородные связи очень распространены, так как многие соединения содержат ковалентные полярные связи Н-О и Н-N, например, вода, кристаллогидраты, белки. Многие физические свойства веществ с водородной связью выпадают из общего хода их изменения в ряду атомов. Так, летучесть ассоциированных аномальна мала, а вязкость, диэлектрическая постоянная, теплота парообразования, температура кипения аномально повышенные. В ряду H2O – Н2S - Н2Se – H2Te свойства воды резко отличаются от свойств других веществ. Если бы вода не обладала водородными связями, она имела бы температуру плавления не 0°С, а (-100°С), и температуру кипения не 100°С, а -80°С. Водородная связь влияет и на химические свойства веществ. Так, HF - слабая кислота, тогда как НС1 - сильная. Причина в том, что HF образует с помощью водородной связи дифторид-ионы и другие более сложные ассоциаты.
Комплексные соединения
Комплексные соединения образуются за счет донорно- акцепторных связей (по другому они называются также координационными соединениями). Так, атом азота в аммиаке (донор) отдает на связь пару электронов, а атом бора (акцептор) -вакантную орбиталь. В результате образуется ковалентная связь:
H F H F
׀ ׀ ׀ ׀
H-N: + B-F = H-N-B-F
׀ ׀ ׀ ׀
H F H F
По координационной теории Вернера комплексные соединения состоят из двух сфер: внешней и внутренней, например: [Сu(NН3)4]SО4; SО42- - внешняя сфера, [Сu(NН3)4]+2 - внутренняя, которая включает центральный ион - комплексообразователь Сu2+ и лиганды NНз. Лигандами могут быть молекулы аммиака или гидроксил-анионы: [Zn(ОН)4]2-. Число лигандов, координируемых комплексообразователем, называется координационным числом, в данных примерах оно равно 4. В зависимости от заряда различают анионные [РF6]- , [Zn(СN)4]2- и катионные [Сu(NН3)4]2+, [Ni(Н2О)4]2+. Заряд комплекса равен алгебраической сумме заряда центрального иона и заряда лигандов.
Дата: 2018-12-21, просмотров: 719.