HCl - хлороводород
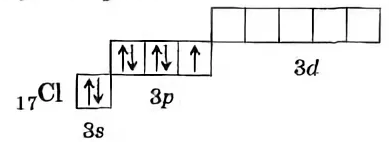
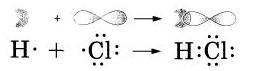
Связь в молекуле HCl ковалентная полярная, образуется за счет перекрывания двух электронных облаков: одно s- электронное облако атома Н, другое - р-электронное облако атома хлора.
Физические свойства HCl .
HCl - бесцветный газ с резким запахом, дымящий во влажном воздухе, хорошо растворим в воде (в 1 объеме Н2О - 500 объемов HCl) с образованием соляной кислоты.
Физические свойства HCl (соляной килоты).
HCl - соляная кислота - раствор хлороводорода (HCl) в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, "дымящаяся" на воздухе. Техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около ω = 0,5% присутствует в желудке человека, что соответствует рН ̴ 0,86.
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода.
Химические свойства HCl (соляной килоты).
Как сильный электролит, HCl в растворе полностью диссоциирована:
HCl ↔ H+ + Cl-
1. Взаимодействие с металлами , стоящими в ряду электрохимических потенциалов до водорода , с образованием соли и выделением газообразного водорода :
2Na + 2HCl = 2NaCl + H2↑
Mg + 2HCl = MgCl2 + H2↑
2Al + 6HCl = 2AlCl3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
HCl не является кислотой-окислителем, поэтому она не будет окислять металлы до их высшей степени окисления.
2. Взаимодействие с оксидами металлов с образованием растворимой соли и воды :
Na2O + 2HCl = 2NaCl + H2O
MgO + 2HCl = MgCl2 + H2O
Al2O3 + 2HCl = 2AlCl3 + H2O
3. Взаимодействие с растворимыми гидроксидами с образованием соли и воды - реакция нейтрализации.
NaOH + 2HCl = NaCl + H2O
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
4. Взаимодействие с нерастворимыми гидроксидами с образованием соли и воды.
Cu(OH)2↓ + 2HCl = CuCl2 + 2H2O
Al(OH)3↓ + 3HCl = AlCl3 + 3H2O
5. Взаимодействие с солями металлов , образованных более слабыми кислотами , например угольной :
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
6. Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония :
NH3 + HCl = NH4Cl (опыт "дым без огня")
7. Взаимодействие с сильными окислителями ( перманганат калия , диоксид марганца ) с выделением газообразного хлора :
2KMnO4 + 16HCl = 5Cl2↑ + 2KCl + 2MnCl2 + 8H2O
Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра , при котором образуется белый творожистый осадок хлорида серебра , нерастворимый в азотной кислоте .
HCl + AgNO3 = AgCl↓ + HNO3
белый творожистый
Получение соляной кислоты.
1. Промышленный способ - синтез хлора и водорода.
Cl2 + H2 = 2HCl↑
Соляную кислоту получают растворением газообразного хлороводорода в воде.
Лабораторные способы.
1) Используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
| 150°C |
| 550°C |
2NaCl + H2SO4 = Na2SO4 + 2HCl
| t |
| t |
AlCl3∙6H2O = Al(OH)3 + 3HCl + 3H2O
Особенности обращения.
Высококонцентрированная HCl - едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
Применение соляной кислоты.
1. В гидрометаллургии и гальванопластике (травление, декапирование).
2. Для очистки поверхности металлов при пайке и лужении.
3. Для получения хлоридов цинка, марганца, железа и др. металлов.
4. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий.
5. В медицине. Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Применение солей хлоридов.
NaCl - 1. Пищевой продукт
2. Для получения чистого Na и Cl2.
KCl - калийное удобрение.
С aCl 2 - для осушки многих газов, в медицине.
BaCl 2 - ядохимикат, используется в сельском хозяйстве.
ZnCl 2 - пропитывают шпалы телеграфных столбов.
Дата: 2018-12-21, просмотров: 733.