I . Общая характеристика элементов галогенов.
Галогены – элементы главной подгруппы VII группы. "Галогены" - "рождающие соли".

Астат мало изучен в связи с его радиоактивностью.

| В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5. Это значит, что галогены имеют 7 валентных электронов, кроме фтора. |
| признак, по которому элементы располагаются в главной подгруппе |

Галогены – ярко выраженные неметаллы. Лишь йод в редких случаях обнаруживает некоторые свойства, схожие с металлами.
Простые вещества, образованные атомами галогенов, состоят из двух атомов:
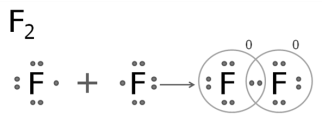 F2, Cl2, Br2, I2.
F2, Cl2, Br2, I2.
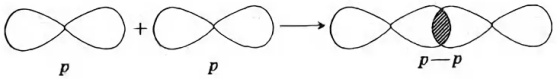
II . Физические свойства галогенов.
F2 – бесцветный, трудно сжижающийся газ
Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом
Br2 – жидкость красно-бурого цвета
I2 – кристаллическое вещество фиолетового цвета.
Присоединяя водород, галогены образуют летучие водородные соединения: HF, HCl, HBr, HI.
| Ø увеличивается межъядерное расстояние Ø уменьшается и прочность молекулы Н-Gal Ø энергия связи Н-Gal сверху уменьшается Ø сила кислот возрастает (HF является самой слабой в ряду галогеново-дородных кислот, а HI – самой сильной). |
НF – фтороводородная (плавиковая)
НCl – хлороводородная (соляная)
НBr – бромоводородная
НI – йодоводородная.
Растворимость малорастворимых солей в воде уменьшается:
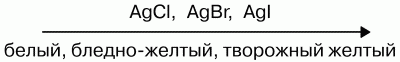
Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде.
III . Химические свойства галогенов.
Галогены - очень сильные окислители.
Фтор проявляет только окислительные свойства, для него характерна только степень окисления -1 в соединениях.
Остальные галогены проявляют и восстановительные свойства при взаимодействии с более э.о. элементами - фтором, кислородом, азотом. Их степени окисления могут принимать значения +1, +3, +5, +7.
1. Взаимодействие с металлами (образуются соли):
2K + Cl2 → 2KCl
2Fe + 3Cl2 → 2FeCl3
2Al + 3Br2 → 2AlBr3
2Al + 3I2 → 2AlBr3
2. Взаимодействие с неметаллами:
а) с водородом
H2 + F2 → 2HF
H2 + Cl2 → 2HCl
H2 + Br2 → 2HBr
H2 + I2 → 2HI
| t |
2P + 5Cl2 → 2PCl5
Хлор. Хлороводород. Соляная кислота.
I . Строение атома хлора.
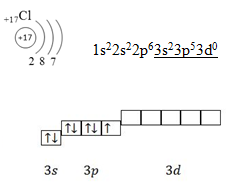
II. Образование молекулы хлора.
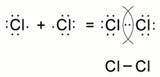

Взаимодействие с металлами.
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
2Na + Cl2 = 2NaCl
2Sb + 3Cl2 = 2SbCl3
2Fe + 3Cl2 = 2 FeCl 3
Металлы с переменной степенью окисления хлор окисляет до высшей степени окисления.
V . Получение хлора.
1) Промышленный способ - электролиз расплавов и растворов солей хлоридов..
NaCl ↔ Na+ + Cl-
H2O ↔ 2H+ + OH-
| Анод (+) | Катод (-) |
| Cl-, OH- | Na+ , H+ |
| 2Cl- - 2ē → Cl2↑ OH- - в растворе | 2H+ + 2ē → H2↑ Na+ - в растворе |

|
NaCl + H2O → NaOH + Cl2↑ + H2↑
Лабораторные методы.
а) Окисление хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия, диоксидом свинца, бертолетовой солью и т. п.)
MnO2 + 4HCl = Cl2↑ + MnCl2 + 2H2O
2KMnO4 + 16HCl = 5Cl2↑ + 2KCl + 2MnCl2 + 8H2O
K2Cr2O7 + 14HCl = 3Cl2↑ + 2CrCl3 + 2KCl + 7H2O
PbO2 + 4HCl = Cl2↑ + PbCl2 + 2H2O
KClO3 + 8HCl = 3Cl2↑ + 2KCl + 3H2O
б) Современные лабораторные методы получения хлора.
Действием кислоты на гипохлорит натрия:
4NaOCl + 4CH3COOH = 4NaCH3COO + 2Cl2↑ + O2↑ + 2H2O
При этом также выделяется кислород. Если использовать соляную кислоту, то реакция выглядит по-другому:
NaOCl + 2HCl = NaCl + Cl2↑ + 2H2O
Физические свойства HCl .
HCl - бесцветный газ с резким запахом, дымящий во влажном воздухе, хорошо растворим в воде (в 1 объеме Н2О - 500 объемов HCl) с образованием соляной кислоты.
Получение соляной кислоты.
1. Промышленный способ - синтез хлора и водорода.
Cl2 + H2 = 2HCl↑
Соляную кислоту получают растворением газообразного хлороводорода в воде.
Лабораторные способы.
1) Используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
| 150°C |
| 550°C |
2NaCl + H2SO4 = Na2SO4 + 2HCl
| t |
| t |
AlCl3∙6H2O = Al(OH)3 + 3HCl + 3H2O
Особенности обращения.
Высококонцентрированная HCl - едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
Применение соляной кислоты.
1. В гидрометаллургии и гальванопластике (травление, декапирование).
2. Для очистки поверхности металлов при пайке и лужении.
3. Для получения хлоридов цинка, марганца, железа и др. металлов.
4. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий.
5. В медицине. Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Применение солей хлоридов.
NaCl - 1. Пищевой продукт
2. Для получения чистого Na и Cl2.
KCl - калийное удобрение.
С aCl 2 - для осушки многих газов, в медицине.
BaCl 2 - ядохимикат, используется в сельском хозяйстве.
ZnCl 2 - пропитывают шпалы телеграфных столбов.
Химические свойства кислот.
1) HCl+1O - хлорноватистая кислота
HClO - желтоватая жидкость. Существует только в растворах. Cамая неустойчивая кислота. Получается при взаимодействии хлора с водой (без нагревания):
Cl2 + H2O = HCl + HClO
| hν |
HClO = HCl + O↑ (атомарный)
Разложение в темноте.
3HClO = 2HCl + HClO3
Химические свойства фтора.
Самый активный неметалл, бурно взаимодействует почти со всеми веществами, кроме фторидов в высших степенях окисления и редких исключений — фторопластов, и с большинством из них — с горением и взрывом. Образует соединения со всеми химическими элементами, кроме гелия, неона, аргона. Ко фтору при комнатной температуре устойчивы некоторые металлы за счёт образования плотной плёнки фторида, тормозящей реакцию со фтором — Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252°C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
Бромистый водород HBr.
Физические свойства HBr.
HBr - бесцветный газ, хорошо растворим в воде; tкип. = -67°С; tпл. = - 87°С.
Получение HBr.
1 ) 2NaBr + H3PO4 → Na2HPO4 + 2HBr↑
2) PBr3 + 3H2O → H3PO3 + 3HBr↑
Химические свойства HBr.
Водный раствор бромистого водорода - бромистоводородная кислота еще более сильная, чем соляная. Она вступает в те же реакции, что и HCl.
1) Диссоциация: HBr ↔ H+ + Br -
2) Взаимодействие с металлами, стоящими в ряду напряжения до водорода:
Mg + 2HBr → MgBr2 + H2↑
3) Взаимодействие с оксидами металлов:
CaO + 2HBr → CaBr2 + H2O
4) Взаимодействие с основаниями и аммиаком:
NaOH + HBr → NaBr + H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
NH3 + HBr → NH4Br
5) Взаимодействие с солями:
MgCO3 + 2HBr → MgBr2 + H2O + CO2↑
AgNO3 + HBr → AgBr↓ + HNO3
желтый
Качественая реакция на Br -:
AgNO3 + HBr → AgBr↓ + HNO3
Образование нерастворимого в кислотах желтого осадка бромида серебра служит для обнаружения аниона Br - в растворе.
6) HBr - сильный восстановитель:
2HBr + H2SO4(конц.) → Br2 + SO2↑ + 2H2O
2HBr + Cl2 → 2HCl + Br2
Из кислородных кислот брома известны:
- слабая бромноватистая HBr+1O и
- сильная бромноватая HBr+5O3.
Йод I2 - открыт Б. Куртуа в 1811 г.
Физические свойства I2.
I2 - кристаллическое вещество темно-фиолетового цвета с металлическим блеском, ρ= 4,9 г/см3; tкип.= 185°C, tпл.= 114°C. Хорошо растворим в органических растворителях (спирте, CCl4).
Получение I2 - окисление ионов I- сильными окислителями:
Cl2 + 2KI → 2KCl + I2
2KI + MnO2 + 2H2SO4 → I2 + K2SO4 + MnSO4 + 2H2O
Химические свойства I2.
Йод - самый неактивный из всех галогенов.
1) Взаимодействие c металлами:
2Al + 3I2 → 2AlI3 (Кат - H2O)
| t |
H2 + I2 ↔ 2HI
3) Взаимодействие с сильными восстановителями:
I2 + SO2 + 2H2O → H2SO4 + 2HI
I2 + H2S → S + 2HI
4) Взаимодействие со щелочами :
3I2 + 6NaOH → 5NaI + NaIO3 + 3H2O
Физические свойства HI.
HI - бесцветный газ с резким запахом, хорошо растворим в воде, tкип. = -35°С; tпл. = -51°С.
Получение HI.
1) I2 + H2S = S + 2HI
2) 2P + 3I2 + 6H2O = 2H3PO3 + 6HI↑
Химические свойства HI.
1) Раствор HI в воде - сильная йодистоводородная кислота:
HI ↔ H+ + I-
2HI + Ba(OH)2 = BaI2 + 2H2O
Соли йодистоводородной кислоты - йодиды.
2) HI - очень сильный восстановитель:
2HI + Cl2 = 2HCl + I2
8HI + H2SO4(конц.) = 4I2 + H2S + 4H2O
5HI + 6KMnO4 + 9H2SO4 = 5HIO3 + 6MnSO4 + 3K2SO4 + 9H2O
3) Качественая реакция на I-:
Образование нерастворимого в кислотах темно-желтый осадка йодида серебра, служит для обнаружения аниона йода в растворе.
NaI + AgNO3 = AgI↓ + NaNO3
темно-желтый
HI + AgNO3 = AgI↓ + HNO3
темно-желтый
Кислородные кислоты йода (йодаты).
1) Йодноватая кислота HI+5O3
HIO3 - бесцветное кристаллическое вещество, t°пл.= 110°С, хорошо растворимое в воде.
Получают:
3I2 + 10HNO3 → 6HIO3 + 10NO↑ + 2H2O
HIO3 - сильная кислота (соли - йодаты) и сильный окислитель.
2) Йодная кислота H5I+7O6
H5IO6 - кристаллическое гигроскопичное вещество, хорошо растворимое в воде, tпл = 130°С. Слабая кислота (соли - перйодаты); сильный окислитель.
I . Общая характеристика элементов галогенов.
Галогены – элементы главной подгруппы VII группы. "Галогены" - "рождающие соли".

Астат мало изучен в связи с его радиоактивностью.

| В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5. Это значит, что галогены имеют 7 валентных электронов, кроме фтора. |
| признак, по которому элементы располагаются в главной подгруппе |

Галогены – ярко выраженные неметаллы. Лишь йод в редких случаях обнаруживает некоторые свойства, схожие с металлами.
Простые вещества, образованные атомами галогенов, состоят из двух атомов:
 F2, Cl2, Br2, I2.
F2, Cl2, Br2, I2.

Дата: 2018-12-21, просмотров: 1085.