САНКТ-ПЕТЕРБУРГСКИЙ
ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ПЕТРА ВЕЛИКОГО
________________________________________________________
Елизарова Е.П.
ФИЗИКО – ХИМИЯ
ПОВЕРХНОСТИ И ГРАНИЦ РАЗДЕЛА ФАЗ
Часть 1. «Поверхностные явления и адсорбция»
Учебное пособие
Санкт-Петербург
Издательство Политехнического университета
2016
Министерство образования и науки Российской Федерации
________________
САНКТ-ПЕТЕРБУРГСКИЙ
ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ПЕТРА ВЕЛИКОГО
________________________________________________________
Елизарова Е.П.
ФИЗИКО – ХИМИЯ
ПОВЕРХНОСТИ И ГРАНИЦ РАЗДЕЛА ФАЗ
Часть 1. «Поверхностные явления и адсорбция»
Учебное пособие
Санкт-Петербург
Издательство Политехнического университета
2016
УДК 543.06:539:620.3(076.5)
М31
Е л и з а р о в а Е. П. Физико-химия поверхности и границ раздела фаз. Часть 1. «Поверхностные явления и адсорбция»: учеб. пособие. / Е. П. Елизарова. – СПб. : Изд-во Политехн. ун-та, 2016. – 60 с.
Соответствует содержанию дисциплины Б2. В.3. «Физико-химия поверхности и границ раздела фаз» федерального государственного образовательного стандарта по направлению подготовки 22.03.01 «Материаловедение и технологии материалов» (уровень бакалавриата).
Учебное пособие содержит основные теоретические аспекты и методические указания к лабораторным работам по двум темам дисциплины Поверхностные явления и адсорбция.
Предназначено для студентов III курса СПбПУ, обучающихся по направлению подготовки «Материаловедение и технологии материалов», профиль «Материаловедение и технологии наноматериалов и наносистем», может быть полезно всем, кто интересуется вопросами, связанными с поверхностными явлениями и адсорбцией.
Табл. 12. Ил. 10. Библиогр. 15 назв.
Печатается по решению
Совета по издательской деятельности Ученого совета
Санкт-Петербургского политехнического университета Петра Великого.
Ó Елизарова Е.П., 2016
Ó Санкт-Петербургский политехнический
Университет Петра Великого, 2016
ВВЕДЕНИЕ
Поверхностные явления – важный раздел дисциплины «Физико-химия поверхности и границ раздела фаз». Они происходят потому, что на границе раздела фаз имеется переходная зона – поверхностный слой, свойства которого отличаются от свойств объемных фаз. Этот слой обладает избыточной поверхностной энергией. Изменение величины поверхностной энергии и приводит к возникновению поверхностных явлений. В учебном пособии уделено внимание таким вопросам, как граница раздела фаз, фундаментальное уравнение Гиббса для межфазной поверхности, поверхностное натяжение, смачивание, угол смачивания, уравнение Юнга, адгезия, когезия, коэффициент растекания и др.
Значительное место при изучении этой дисциплины отводится адсорбции. Адсорбция - самопроизвольный процесс, приводящий к различию в концентрациях компонентов в поверхностном слое и в объемной фазе. Основные понятия этого раздела: виды адсорбции, фундаментальное уравнение адсорбции Гиббса, изотерма Гиббса, мономолекулярная теория адсорбции Ленгмюра, адсорбция на твердом адсорбенте, ПАВ и ПИВ и др.
В пособии приведены методические указания к лабораторным работам по темам «Поверхностные явления и адсорбция».
Для описания поверхностных явлений используются законы термодинамики и химической кинетики.
1. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Термодинамическое описание поверхностного слоя
В гетерогенных системах.
Поверхностное натяжение
Уже упоминалось, что поверхностное натяжение - это частная производная любого термодинамического потенциала по площади межфазной поверхности при постоянстве соответствующих параметров (1.1.3).
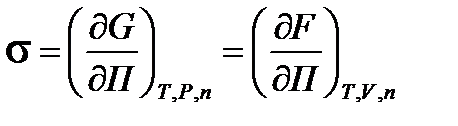
(1.2.1.)
Таким образом, получается, что поверхностное натяжение (σ) - это мера поверхностной энергии. Оно характеризует избыток поверхностной энергии, приходящийся на 1 м2 межфазной поверхности.
По системе СИ, единицей измерения поверхностного натяжения является Дж/м2 или (Н·м)/м2, то есть Н/м.
Поверхностное натяжение является важнейшей термодинамической характеристикой поверхностного слоя. Физический смысл может иметь разное толкование. Поверхностное натяжение жидкости на границе с газом - это работа переноса молекул жидкости из объема на поверхность. Можно дать и другое определение поверхностному натяжению - это сила, действующую на единицу длины граничной поверхности.
Поверхностное натяжение зависит от температуры . Для чистых однокомпонентных систем на границе с газом оно понижается с повышением температуры, то есть 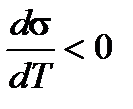 , причем температурный коэффициент
, причем температурный коэффициент 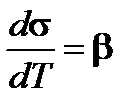 имеет почти всегда отрицательное значение вплоть до температур, близких к критической:
имеет почти всегда отрицательное значение вплоть до температур, близких к критической:
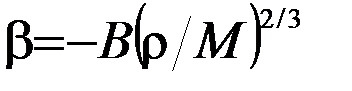 , (1.2.2)
, (1.2.2)
где В – коэффициент, постоянный для всех жидкостей; 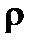 − плотность жидкости; М – молярная масса.
− плотность жидкости; М – молярная масса.
Уменьшение поверхностного натяжения с ростом температуры происходит из-за увеличения энтропии поверхностного слоя чистой жидкости по сравнению с энтропией внутри жидкости. Для расчета используют уравнение Гиббса – Гельмгольца для единицы поверхности:
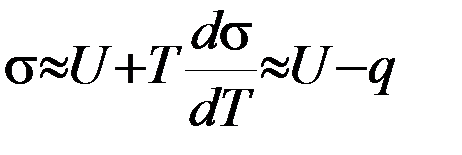 , (1.2.3)
, (1.2.3)
где U – внутренняя энергия единицы поверхности, а q – связанная энергия единицы поверхности.
При линейном изменении поверхностного натяжения с температурой Т внутренняя энергия поверхностного слоя является температурным инвариантом, то есть не зависит от температуры. Это происходит потому, что при увеличении температуры свободная поверхностная энергия уменьшается на величину 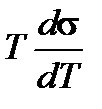 , а связанная энергия на ту же величину возрастает.
, а связанная энергия на ту же величину возрастает.
При критической температуре исчезает различие между граничащими фазами, и поверхностное натяжение становится равным нулю. Для большинства неполярных жидкостей температурная зависимость поверхностного натяжения линейная и в первом приближении может быть представлена соотношением:
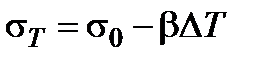 , (1.2.4)
, (1.2.4)
где 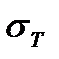 и
и 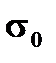 − поверхностное натяжение при температуре Т и стандартной температуре;
− поверхностное натяжение при температуре Т и стандартной температуре; 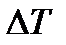 − разность между данной и стандартной температурами;
− разность между данной и стандартной температурами; 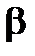 – постоянная, равная температурному коэффициенту поверхностного натяжения, взятому с обратным знаком.
– постоянная, равная температурному коэффициенту поверхностного натяжения, взятому с обратным знаком.
Другие вещества в меньшей степени соответствуют зависимости (1.2.4), но часто при проведении исследований этими отклонениями можно пренебречь.
В двухкомпонентных системах изменение поверхностного натяжения зависит от второго компонента. Вещества, уменьшающие σ, называются поверхностно-активными веществами (ПАВ). К ним относятся спирты, альдегиды, органические кислоты и их соли, амины и другие соединения. Особенностью строения их молекул является дифильность, то есть двойственность, характеризующаяся наличием неполярного (углеводородного) радикала и полярных групп −ОН; −СОН; −СООН; −NH2 и др. (рис.1.3).

Рис.1.3. Схема ПАВ
Вещества, увеличивающие σ, называются поверхностно-инактивными веществами (ПИВ). К ним относятся электролиты.
Зависимость поверхностного натяжения от концентрации 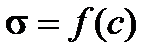 при постоянной температуре называется изотермой поверхностного натяжения (рис.1.4).
при постоянной температуре называется изотермой поверхностного натяжения (рис.1.4).
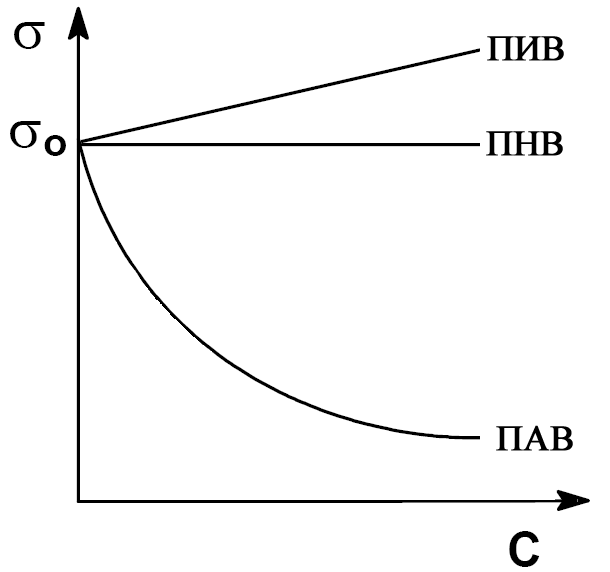
Рис.1.4. Изотермы поверхностного натяжения
Производная 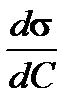 называется поверхностной активностью и определяется из графика как тангенс угла наклона касательной с положительным направлением оси абсциссα, то есть как тангенс смежного угла
называется поверхностной активностью и определяется из графика как тангенс угла наклона касательной с положительным направлением оси абсциссα, то есть как тангенс смежного угла 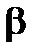 , но с противоположным знаком (см. рис.1.5).
, но с противоположным знаком (см. рис.1.5).
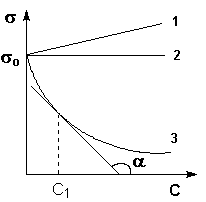
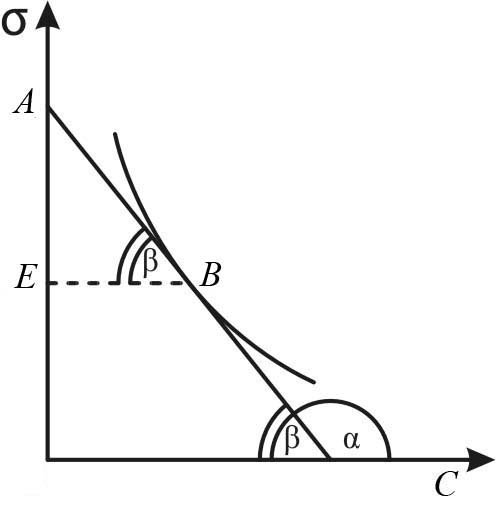
Рис.1.5. Графическое определение поверхностной активности
Поверхностная активность вещества, или его способность понижать поверхностное натяжение, увеличивается при переходе к каждому высшему гомологу в среднем в 3,5 раза. Эта зависимость была установлена и сформулирована как эмпирическое правило Дюкло - Траубе. Чем длиннее углеводородная цепь, тем меньшее сродство с водой имеют молекулы, и тем сильнее они стремятся собраться на границе раздела фаз, образуя насыщенный слой даже при самых маленьких концентрациях ПАВ в растворе.
Метод сталагмометрии
Цель работы: определить поверхностное натяжение методом сталагмометрии (метод счета капель).
Приборы: сталагмометр, закрепленный на штативе, 2 химических стакана на 100 мл, груша.
Реактивы: органические жидкости (по заданию преподавателя), дистиллированная вода.
Поверхностное натяжение определяется методом счета капель; для этого используют прибор – сталагмометр (рис.Л.1.1). По форме он напоминает пипетку, имеет две кольцевые метки 1 и 2, ограничивающие объем.
Нижняя часть прибора представляет собой толстостенный капилляр коленчатой формы с плоскоотшлифованным концом. Для заполнения сталагмометра к его верхнему концу присоединяют грушу.
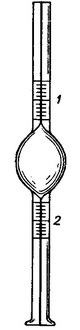 Рис.Л.1.1 Сталагмометр
Рис.Л.1.1 Сталагмометр
|
Силу поверхностного натяжения можно определить по формуле:
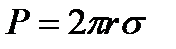
Выразим вес капли через ее массу. Если объем сталагмометра V, а количество капель, составляющее этот объем, n и плотность жидкости d, тогда вес капли будет равен:
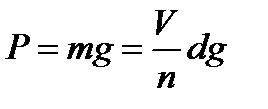
В состоянии равновесия вес капли и сила поверхностного натяжения равны. Тогда
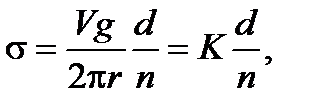 (Л.1.1)
(Л.1.1)
где 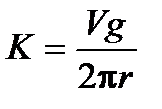 − постоянная сталагмометра.
− постоянная сталагмометра.
Количество вытекающих из сталагмометра капель зависит от плотности жидкости. Пусть при вытекании из сталагмометра образуется n0 капель воды, а ее плотность и поверхностное натяжении при данной температуре d0 и σ0 – известные табличные величины. Вода очень часто используется в качестве эталонной жидкости, так как она хорошо исследована и имеются справочные данные интересующих нас величин. Для исследуемой жидкости число капель и плотность обозначаем nх, dх. Из уравнения (Л. 1.1) получаем
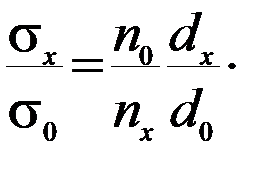

Если растворы разбавленные, d0 = d X, тогда выражение приобретает вид: 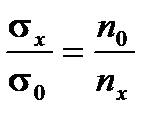 , а поверхностное натяжение определяется по формуле
, а поверхностное натяжение определяется по формуле
 (Л.1.2)
(Л.1.2)
Таким образом, для определения поверхностного натяжения необходимо подсчитать количество капель воды и исследуемой жидкости, вытекающей из сталагмометра.
Порядок выполнения работы
1. Тщательно промывают сталагмометр дистиллированной водой.
2. Определяют количество капель сначала для воды (эталонной жидкости), а затем для исследуемой жидкости. Предварительно промывают прибор исследуемым раствором перед началом работы с ним. Счет капель производят не менее трех раз до сходимости результатов.
3. Рассчитывают поверхностное натяжение исследуемой жидкости по формуле (Л.1.2).
Поверхностное натяжение воды при разных температурах:
| Температура, С |  , Дж/ м2 , Дж/ м2
|
| 16○ | 73,34 ·10-3 |
| 17○ | 73,19 ·10-3 |
| 18○ | 73,05 ·10-3 |
| 19○ | 72,89 ·10-3 |
| 20○ | 72,75 ·10-3 |
| 21○ | 72,69 ·10-3 |
| 22○ | 72,44 ·10-3 |
| 23○ | 72,28 ·10-3 |
| 24○ | 72,13 ·10-3 |
| 25○ | 71,97 ·10-3 |
Порядок выполнения работы
1. Перед началом работы тщательно промывают капилляр дистиллированной водой.
2. Определяют максимальное давление в газовом пузырьке сначала для воды (эталонной жидкости), а затем для исследуемой жидкости или раствора. Перед началом работы с исследуемым раствором промывают капилляр этим раствором. Измерение давления производят не менее пяти раз до сходимости результатов.
3. Рассчитывают поверхностное натяжение исследуемой жидкости (Л.1.5).
4. Сравнивают экспериментальные значения поверхностного натяжения для исследуемых растворов, определенные двумя методами, со справочными. Рассчитывают погрешность.
5. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Растворов ПАВ и ПИВ
Цель работы: 1. Определить поверхностное натяжение водных растворов поверхностно-инактивного вещества (по заданию преподавателя) и поверхностно-активного вещества (по заданию преподавателя) методом максимального давления в газовом пузырьке на границе раствор-воздух.
2.Построить изотермы поверхностного натяжения исследуемых растворов.
Оборудование и реактивы: установка для определения давления в газовом пузырьке; мерные колбы на 100 мл; химические стаканы на 100 мл, технические весы, соли и органические жидкости (по заданию преподавателя)
Порядок выполнения работы
1. В тщательно вымытых мерных колбах готовят растворы следующих концентраций (в моль/ л).
Растворы ПАВ: 0,10; 0,05; 0,02;0,01; 0,005;
Растворы ПИВ: 2; 1,15; 1; 0,75; 0,5.
2. Измеряют поверхностное натяжение при постоянной температуре методом максимального давления в газовом пузырьке (см. работу №1 часть 2).
3. Полученные экспериментальные и расчетные данные заносят в табл. 2
4. Представляют графически в виде изотерм поверхностного натяжения исследованных растворов (на одном графике).
Т а б л и ц а 2
| Конц. растворов ПАВ, моль/л | Р, мм.спитр. ст. | σ, Дж/М2 | Конц. растворов ПИВ, моль/л | Р, мм.спирт. ст. | σ, Дж/М2 |
5. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Растворов ПАВ и ПИВ
Цель работы: 1. Определить поверхностное натяжение водных растворов поверхностно-инактивного вещества (по заданию преподавателя) и поверхностно-активного вещества (по заданию преподавателя) методом сталагмометрии на границе раствор-воздух.
2. Построить изотермы поверхностного натяжения исследуемых растворов.
Оборудование и реактивы: сталагмометр; мерные колбы на 100 мл; химические стаканы на 100 мл, технические весы,соли и органические жидкости ( по заданию преподавателя).
.
Порядок выполнения работы
1. В тщательно вымытых мерных колбах готовят растворы следующих концентраций (в моль/ л).
Растворы ПАВ: 0,10; 0,05; 0,02;0,01; 0,005;
Растворы ПИВ: 2; 1,15; 1; 0,75; 0,5.
2. Определяют поверхностное натяжение при постоянной температуре методом сталагмометрии.
3. Полученные экпериментальные и расчетные данные заносят в табл. 3 и представляют графически в виде изотерм поверхностного натяжения исследованных растворов (на одном графике).
Т а б л и ц а 3
| Конц. растворов ПАВ, моль/л | n, число капель | σ, Дж/м2 | Конц. растворов ПИВ, моль/л | n, число капель | σ, Дж/м2 |
4. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Порядок выполнения работы
1. В отдельных колбах готовят путем последовательных разбавлений дистиллированной водой по 100 мл растворов поверхностно-активных веществ (ПАВ) следующих концентраций:
этилового спирта - 0,50; 0,25; 0,125; 0,062; 0,031; 0,015 моль/л;
пропилового спирта - 0,50; 0,25; 0,125; 0,062; 0,031; 0,015 моль/л;
бутилового спирта - 0,04; 0,03; 0,02; 0,01 моль/л.
2. Поверхностное натяжение приготовленных растворов определяют методом максимального давления в газовом пузырьке.
Опыт начинают с определения максимального давления образования пузырьков воздуха на границе вода-воздух, а затем переходят к растворам. Измерения σ ведут, переходя от растворов с меньшей концентрацией к растворам с большей концентрацией.
3. Поверхностное натяжение исследуемого раствора рассчитывают по формуле (Л.1.5).
4. Результаты измерений и расчетов заносятся в табл.4.
Т а б л и ц а 4
| Конц. растворов ПАВ, моль/л; этиловый спирт | Р, мм. сп... ст. | σ, Дж/м2 | Конц. растворов ПАВ, моль/л; пропиловый спирт | Р, мм. сп.. ст. | σ, Дж/м2 | Конц. растворов ПАВ, моль/л; бутиловый спирт | Р, мм. сп.. ст. | σ, Дж/м2 |
5. На одном графике (на миллиметровой бумаге) строят изотермы поверхностного натяжения для растворов этилового, пропилового и бутилового спиртов.
6. Далее определяют поверхностную активность и проверяют, выполняется ли правило Дюкло-Траубе для растворов этих поверхностно-активных веществ.
Для определения максимальной поверхностной активности проводят касательные к начальной точке изотерм, находят тангенсы угла наклона касательных и рассчитывают коэффициент Дюкло - Траубе как отношение поверхностных активностей двух гомологов.
Расчет коэффициента Траубе можно провести и другим способом. На начальном участке изотермы в пределах понижения σ не более, чем на 10-15 единиц по сравнению с σ0 чистого растворителя проводят параллельно горизонтальной оси прямую, которая пересекает все изотермы. Отрезок ординаты от σ0 до секущей прямой, равен понижению поверхностного натяжения ∆σ. Опустив перпендикуляры из точек пересечения прямой с кривыми изотерм, находят концентрации гомологов, при которых достигается одинаковое снижение поверхностного натяжения ∆σ. По отношению равновесных концентраций низшего и высшего соседних членов гомологического ряда, при одинаковом понижении поверхностного натяжения их растворов , находят коэффициент β (коэффициент Дюкло-Траубе).
7. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Порядок выполнения работы
Для определения внутренней энергии поверхностного слоя измеряют поверхностное натяжение жидкости в заданном интервале температур. Значение  определяют методом максимального давления воздуха в газовом пузырьке. Применяют термостат, в котором заданная температура поддерживается с точностью
определяют методом максимального давления воздуха в газовом пузырьке. Применяют термостат, в котором заданная температура поддерживается с точностью 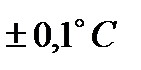 .
.
1. Определяют методом максимального давления в газовом пузырьке поверхностное натяжения сначала для воды, а затем для глицерина при комнатной температуре, тщательно промывая капилляр перед каждым измерением. Измеряют не менее трех-пяти раз до сходимости результатов.
2. Настраивают термостат на следующую температуру (+ 100). Выдерживают 10 минут для прогрева исследуемых жидкостей. Затем измеряют максимальное давление в пузырьке воздуха для воды и глицерина. Измерения проводят в интервале температур от 200 до 600 с интервалом в 10 градусов.
3. Полученные экспериментальные и расчетные данные заносят в табл.5.
Т а б л и ц а 5
|
Температура, ºС | Максимальное давление в газовом пузырке, мм спирт. ст.
|
Рср |
σ, Н/м | ||||
| 1 | 2 | 3 | 4 | 5 | |||
| 20 | |||||||
| 30 | |||||||
| 40 | |||||||
| 50 | |||||||
| 60 | |||||||
Для расчетов необходимо знать поверхностное натяжение воды при разных температурах:
| Температура, С |  , Дж/ м2 , Дж/ м2
|
| 20○ | 72,75 ·10-3 |
| 30○ | 71,15 ·10-3 |
| 40○ | 69,55 ·10-3 |
| 50○ | 67,90 ·10-3 |
| 60○ | 66,17 ·10-3 |
Для справки: поверхностное натяжение глицерина при разных температурах.
| Температура, С |  , Дж/ м2 , Дж/ м2
|
| 20○ | 59,4 ·10-3 |
| 30○ | 59,0 ·10-3 |
| 40○ | 58,5 ·10-3 |
| 50○ | 58,0 ·10-3 |
5. По экспериментальным данным строят график зависимости 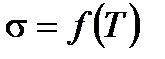 и определяют температурный коэффициент поверхностного натяжения
и определяют температурный коэффициент поверхностного натяжения 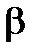 .
.
6. Внутреннюю энергию рассчитывают по формуле (1.2.3). По значению 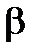 (1.2.2) рассчитывают молекулярную массу исследуемой жидкости и сравнивают с теоретическим значением.
(1.2.2) рассчитывают молекулярную массу исследуемой жидкости и сравнивают с теоретическим значением.
7. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Порядок выполнения работы
1. Измеряют поверхностное натяжение двух органических веществ, указанных в задании, сталагмометрическим методом (см. работу №1 часть1).
2. Рассчитывают парахоры для исследуемых жидкостей по формуле (Л.6.4)
3. Рассчитывают, используя свойство аддитивности, парахоры для исследуемых жидкостей.
4. Сравнивают теоретические и расчетные значения величин парахоров.
5. Используя приведенные табличные данные, рассчитывают парахоры воды, бензола, анилина и нитробензола.
6. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Порядок выполнения работы
Существует несколько методов измерения краевых углов смачивания.
Измерение краевых углов смачивания методом проецирования каплина экран .
Описание прибора. Прибор имеет следующее устройство (рис.Л.7.1).Капля К, нанесенная на исследуемую поверхность П, освещается лампой C, расположенной в верхней части прибора, и проецируется объективом O на матовое стекло экрана Э. Лучи света проходят через тепловой фильтр Ф и отражаются от зеркал З1, З2 и З3, помещенных в корпусе прибора. На планшете экрана укреплено приспособление для измерения краевых углов смачивания.
Рис.Л.7.1. Измерение краевых углов методом проецирования капли
Методика измерений. Выключателем, расположенным с левой стороны корпуса прибора, включается лампа осветителя (лампу включать только на время измерений). Перемещая винтами металлический держатель и изменяя угол наклона, достигают сфокусированного изображения профиля держателя на экране (матовом стекле). Подготовленный образец кладут на держатель и с помощью установочных винтов находят такое положение пластинки, чтобы ее изображение на экране имело вид резко очерченной горизонтальной линии, расположенной приблизительно в середине экрана. Затем с помощью шприца с иглой или пипетки осторожно наносят каплю жидкости на поверхность пластинки у ее края, обращенного к объективу О. Для хорошей воспроизводимости результатов необходимо наносить капли примерно одинаковых размеров диаметром неболее 2–3 мм. Окончательно регулируют положение держателя для получениянаиболее резкого изображения контуров капли и пластинки. Затем с помощью двух маховиков перемещают угломер в такое положение, чтобы его центр (точка пересечения перпендикулярных линий) был совмещен с вершиной краевого угла на изображении капли. Устанавливают так, чтобы совместить ее с границей раздела капля - поверхность пластинки. Затем угломер поворачивают в такое положение, чтобы его горизонтальная линия стала касательной к изображению капли и проходила через точку раздела трех фаз. Разность отсчетов при первой и второй установке угломера дает величину краевого угла. Эти отсчеты делают три раза и рассчитывают среднее значение краевого угла на одной стороне капли.
Таким же образом определяется краевой угол с другой стороны изображения капли, и из двух значений, которые должны быть близкими (θлев. и θправ.), рассчитывают среднее значение угла θср. Отсчеты по шкале берут с точностью до1o. После измерений во избежание перегрева необходимо выключить лампу осветителя.
Порядок выполнения работы
1. У лаборанта получают несколько металлических пластин.
2. Для измерения выбирают один из описанных выше методов определения краевых углов.
3. Устанавливают пластину в проекционный аппарат. На поверхность металла с помощью пипетки или шприца наносят каплю сначала воды, а потом исследуемых растворов. Добиваются четкого изображения на экране капли. Контур капли обрисовывают тонко заточенным карандашом на белом листе бумаги (кальке), заранее укрепленном на экране (это первый способ определения краевых углов смачивания).
Краевой угол может быть определен по фотоснимку (это второй способ определения краевых углов смачивания).
4. Определяют краевые углы всех растворов одним из методов. Для этого к контуру капли в точке соприкосновения трех фаз проводят касательные. Угол, образованный касательной и проекцией поверхности твердого тела, направленный в сторону жидкой фазы, и есть угол смачивания θ. Его замеряют транспортиром, а значения со sθ определяют по таблицам.
Напоминаем, сначала измерения краевого угла проводят для чистой воды, а затем для серии растворов поверхностно-активных веществ разной концентрации, строго соблюдая последовательность от разбавленного раствора к более концентрированному. Для каждой жидкости получают три-пять изображений капель.
5. По среднему значению угла смачивания θ находят величину со sθ и рассчитывают работу адгезии Wа. Значения σж-г для воды и водных растворов ПАВ различных концентраций определяют методом максимального давления в газовом пузырьке.
6. Затем металлическую поверхность покрывают слоем парафина и определяют краевые углы смачивания для исследуемых растворов на этой поверхности. Данные измерений угла смачивания θ , их косинусов и соответствующих концентраций ПАВ, а также расчетные значения работы адгезии Wа, заносят в табл. 6.
7. Строят график изотермы смачивания. Определяют характер инверсии смачивания.
Т а б л и ц а 6
| Исследуемая поверхность | Растворы ПАВ, моль/л | Р, мм.сп.. ст. | σ, Дж/м2 | θср | со sθ | Wа, | f |
8. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
АДСОРБЦИЯ
Основные понятия
Поверхностный слой обладает избыточной энергией поверхностного слоя (поверхностной энергией), которую можно выразить уранениями:
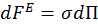 (при Т,V=const);
(при Т,V=const);
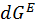 =
= 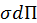 (при Т, p=const),
(при Т, p=const),
где 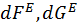 - избыточная энергия поверхностного слоя: энергияГельмгольца и Гиббса соответственно.
- избыточная энергия поверхностного слоя: энергияГельмгольца и Гиббса соответственно.
Явления, в результате которых изменяется величина поверхностной энергии, называются поверхностными явлениями. Адсорбция относится к их числу.
Самопроизвольное изменение концентрации компонентов системы в поверхностном слое по сравнению с концентрацией в объеме фазы называется адсорбцией.
Для количественного описания адсорбции применяют три величины.
1. Избыточная, или гиббсовская, адсорбция (Г) [кмоль/м2].Это избыток i – компонента в поверхностном слое по сравнению с его количеством в объеме фазы, приходящейся на единицу площади поверхности.
2. Абсолютная адсорбция (А).В тех случаях, когда способность вещества к адсорбции велика, то оно практически полностью находится в поверхностном слое.
3. Удельная адсорбция (а) [моль/кг или кг/кг]. Используется тогда, когда трудно определить площадь межфазной поверхности. В этом случае избыток вещества относят к массе адсорбента.
Явление поглощения одного вещества на границе раздела фаз другим веществом называется сорбцией. Различают адсорбцию и абсорбцию. Если происходит увеличение концентрации вещества только на поверхности другого, то процесс называется адсорбцией, а поглощение вещества всем объемом другого вещества − абсорбцией.
Сорбентом или адсорбентом считают вещество, которое поглощает, а адсорбтивом поглощаемое вещество. Адсорбенты бывают твердые и жидкие; адсорбтив может находиться в любом агрегатном состоянии: твердом, жидком, газообразном.
Явление сорбции имеет избирательный характер, данный адсорбент поглощает не любое вещество. Для каждого адсорбента адсорбция зависит от природы и концентрации адсорбтива, а также от температуры. С увеличением температуры адсорбция уменьшается вследствие усиления процесса десорбции (обратного процесса).
Следует заметить, что адсорбция бывает физической и химической. Характер определяется силами межмолекулярного взаимодействия.
Порядок выполнения работы
1. Определяют количество капель сначала для воды, а затем для исследуемых растворов. Начинают с самого разбавленного раствора ПАВ и последовательно переходят к растворам большей концентрации. Предварительно промывают прибор исследуемым раствором.
2. Рассчитывают поверхностное натяжение растворов разной концентрации по формуле (Л.1.2).
3. Строят изотерму поверхностного натяжения. По оси ординат откладывают 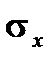 , по оси абсцисс – концентрацию.
, по оси абсцисс – концентрацию.
4. Определяют поверхностную активность 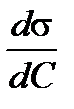 как производную из графика изотермы поверхностного натяжения. Поверхностную активность рассчитывают в джоулях на метр к киломолю [Дж·м/кмоль].
как производную из графика изотермы поверхностного натяжения. Поверхностную активность рассчитывают в джоулях на метр к киломолю [Дж·м/кмоль].
5. По уравнению (2.2.6) рассчитывают поверхностный избыток Г (R = 8,31·103 [Дж/ (кмоль·К).
6. Строят изотерму адсорбции (рис. 2.2) (по оси ординат откладывают величину адсорбции, по оси абсцисс – концентрацию). Определяют значение предельной адсорбции.
Далее определяют другим графическим способом величину предельной адсорбции (графический метод решения уравнения Ленгмюра). Все графики выполняются на миллиметровой бумаге с помощью линейки и карандаша.
7. Экспериментальные данные сводят в табл. 7 и анализируют полученные результаты.
Т а б л и ц а 7
| Раствор ПАВ, моль/л | n , число капель | σ, Дж/М2 | dσ/dc | Г, кмоль/м2 | С/Г | г∞ (1 способ) | г∞ (2 способ) |
8. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Порядок выполнения работы
1. Определяют величину максимального давления в газовом пузырьке сначала для воды (эталонной жидкости), а затем для исследуемых растворов. Начинают с самого разбавленного раствора ПАВ и последовательно переходят к растворам большей концентрации. Предварительно промывают прибор исследуемым раствором.
2. Рассчитывают поверхностное натяжение растворов разной концентрации по формуле (Л.1.5).
3. Строят изотерму поверхностного натяжения. По оси ординат откладывают 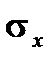 , по оси абсцисс – концентрацию.
, по оси абсцисс – концентрацию.
4. Определяют поверхностную активность 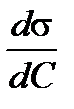 как производную из графика изотермы поверхностного натяжения. Поверхностную активность рассчитывают в джоулях на метр к киломолю [Дж·м/кмоль].
как производную из графика изотермы поверхностного натяжения. Поверхностную активность рассчитывают в джоулях на метр к киломолю [Дж·м/кмоль].
5. По уравнению (2.2.6) рассчитывают поверхностный избыток Г (R = 8,31·103 Дж/ (кмоль·К)).
6. Строят изотерму адсорбции (рис.2.2) (по оси ординат откладывают величину адсорбции, по оси абсцисс – концентрацию). Определяют значение предельной адсорбции.
7. Далее определяют предельную адсорбцию ( графическим решением уравнения Ленгмюра). Все графики выполняются на миллиметровой бумаге с помощью линейки и карандаша.
8. Экспериментальные и расчетные данные сводят в табл. 8 и анализируют полученные результаты.
Т а б л и ц а 8
| Раствор ПАВ, моль/л | Р, мм сп.ст. | σ, Дж/М2 | dσ/dc | Г, кмоль/м2 | С/Г | г∞ (1 способ) | г∞ (2 способ) |
9. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Лабораторная работа № 10. Определение адсорбции на границе твердое вещество - жидкость
Цель работы: изучить явление адсорбции на твердой поверхности;
количественно определить адсорбцию уксусной кислоты на угле;
построить изотерму адсорбции;
определить константы графически в уравнении Фрейндлиха;
сравнить теоретические и экспериментальные величины адсорбции,
рассчитать относительную погрешность.
Приборы :12 сухих конических колб объемом 250 мл, 6 воронок, пипетка на 10 мл, мерный цилиндр, бюретка на 50 мл, технические электронные весы, фильтры.
Реактивы: раствор уксусной кислоты, активированный уголь, 0,1 н раствор гидроксида натрия (калия), индикатор − фенолфталеин.
Получим изотерму адсорбции на твердой поверхности из раствора. В качестве адсорбента используют активированный уголь, имеющий большую удельную поверхность. Адсорбтивом является уксусная кислота.
Используется аналитический метод определения концентрации – метод титрования.
Порядок выполнения работы
1. В каждую из шести сухих колб (пронумерованных), кроме колбы 1, наливают по 50 мл дистиллированной воды, затем в колбы 1 и 2 − по 50 мл исследуемого раствора уксусной кислоты с помощью бюретки. Тщательно перемешивают содержимое колбы 2, и отобрав 50 мл разбавленной кислоты, переносят в колбу 3, из нее − в следующую по порядку колбу и т.д. Таким образом, получают шесть растворов; концентрация каждого из них уменьшается вдвое по сравнению с предыдущим раствором. Из последней колбы следует отобрать 50 мл раствора и отбросить. Таким образом, в каждой колбе объем раствора составляет 50 мл.
2. К 50 мл каждого раствора добавляют по 1 г активированного угля (навеску готовят на технических электронных весах). Содержимое колб хорошо перемешивают и оставляют для адсорбции на 30 мин.
3. За время адсорбции определяют концентрацию С0 исследуемого раствора кислоты титрованием 0,1 н NaOH (KOH) в присутствии индикатора фенолфталеина. Аликвотная часть кислоты составляет 5 мл. Концентрацию кислоты определяют по закону эквивалентов.
 Ск-ты=
Ск-ты= 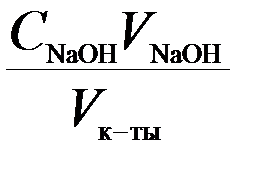 ,
,
где С – концентрация кислоты, моль/л; V – объем, мл.
Для остальных разбавленных растворов начальную концентрацию получают расчетом, последовательно уменьшая ее вдвое.
4. Через 30 мин отфильтровывают растворы от угля в сухие колбы с теми же номерами, и методом титрования определяют концентрацию шести растворов кислоты после адсорбции. По закону эквивалентов рассчитывают концентрации Ср. Для определения массы поглощенной кислоты достаточно знать объем раствора и концентрацию до и после адсорбции. Тогда количество поглощенной кислоты в 50 мл раствора определяется по формуле
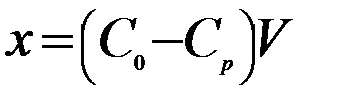 , моль;
, моль; 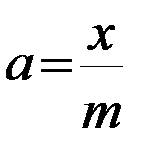 , моль/г.
, моль/г.
5.Экспериментальные и расчетные данные сводят в табл. 9.
Т а б л и ц а 9
| Конц. кислоты (С0)., моль/л, до адсорбции | VNaOH, мп | Конц. кислоты (Ср)., моль/л, после адсорбции | lg Ср | X, моль | x/m, моль/г | lgx/m |
6. . Для определения величины адсорбции используют уравнение (2.4.1). Постоянные К и 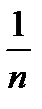 можно определить, графически решив уравнение Фрейндлиха. Прологарифмируем его. После логарифмирования оно преобразуется в уравнение прямой, не проходящей через начало координат (рис. 2.3):
можно определить, графически решив уравнение Фрейндлиха. Прологарифмируем его. После логарифмирования оно преобразуется в уравнение прямой, не проходящей через начало координат (рис. 2.3):
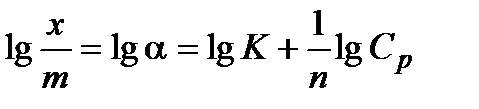
Строят изотерму адсорбции (рис.2.2) в координатах 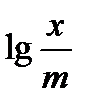 и lgCp . Эта прямая проходит под углом к абсциссе и отсекает на ординате отрезок 0К, равный lgK в масштабе оси ординат. Тангенс угла наклона
и lgCp . Эта прямая проходит под углом к абсциссе и отсекает на ординате отрезок 0К, равный lgK в масштабе оси ординат. Тангенс угла наклона 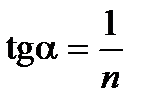 можно выразить как отношение 0К/0В, учитывая масштабы по обеим осям. Графически находят постоянные К и
можно выразить как отношение 0К/0В, учитывая масштабы по обеим осям. Графически находят постоянные К и 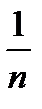 .
.
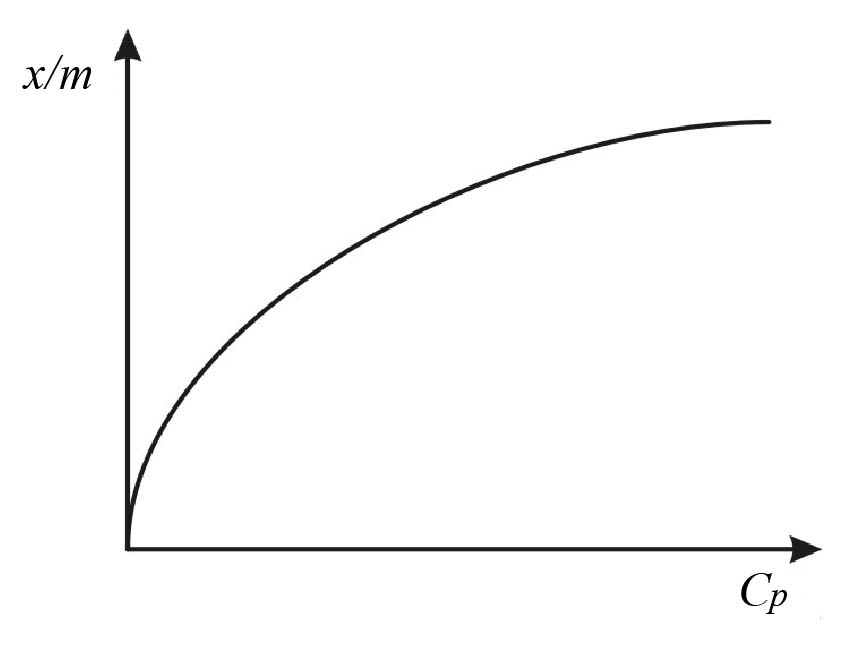
Рис.Л.10.2. Изотерма адсорбции на активированном угле
Подставив их в уравнение (2.4.1) для всех значений lgCp , получают значения 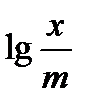 . Затем, найдя антилогарифмы, определяют
. Затем, найдя антилогарифмы, определяют 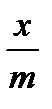 для шести растворов кислоты. Далее вычисляют отклонение
для шести растворов кислоты. Далее вычисляют отклонение 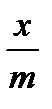 , рассчитанное от
, рассчитанное от 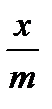 экспериментального.
экспериментального.
7. Строят изотерму адсорбции на активированном угле (рис.Л.10.2).
Все графики выполняются на миллиметровой бумаге с помощью линейки и карандаша.
8. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Лабораторная работа № 11. Адсорбция различных веществ углем
Цель работы: определить удельную поверхность твердогоадсорбента – активированного угля.
Приборы:установка для определения поверхностного натяжения методом максимального давления в газовом пузырьке, капилляр, химические стаканчики,конические пронумерованные колбы на 100 мл с пробками, воронки, бумажные фильтры.
Реактивы:дистиллированная вода, набор растворов (шесть растворов ПАВ разной концентрации), активированный уголь.
Порядок выполнения работы
Если известна площадь, занимаемая 1 молем вещества, находящегося на поверхности в виде мономолекулярного слоя (Пм, м2/ моль), а также предельная адсорбция ( 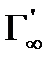 , моль/г) для твердого адсорбента, то удельная поверхность адсорбента (м2/г) рассчитывается по формуле:
, моль/г) для твердого адсорбента, то удельная поверхность адсорбента (м2/г) рассчитывается по формуле:
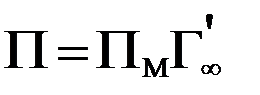 .
.
Площадь одной молекулы определяют, исследуя адсорбцию растворенного вещества (адсорбата) на границе раздела жидкость − газ. 1. На первом этапе для определения поверхностного натяжения используется метод максимального давления пузырька воздуха, который подробно описан в работе № 1 часть 2. Для исследования используют четыре-шесть растворов ПАВ (по заданию преподавателя).
Итогом этой части работы является определение предельной адсорбции и площади, приходящейся на 1 моль адсорбированного вещества (см. работу № 9):
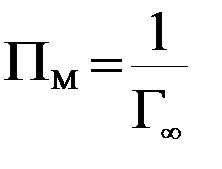
Для определения величины предельной адсорбции используют графический метод определения констант в уравнении Ленгмюра (работа № 9).
3. На втором этапе исследуют адсорбцию тех же самых растворов углем. В колбочки с пробкой помещают навески активированного угля (по 2 г), наливают по 25 мл каждого из исследуемых растворов. Колбочки с растворами встряхивают в течение 20 − 30 мин или переливают в специальные пробирки для центрифугирования (следует соблюдать инструкцию по технике безопасности при работе с центрифугой), где выдерживают их 10 − 15 мин.
4. Определяют поверхностное натяжение растворов после адсорбции растворенного вещества углем, по изотерме поверхностного натяжения находят новые концентрации растворов, а по разности – количество растворенного вещества, адсорбированное навеской угля. Количество вещества, адсорбированное 1 г угля, находят по формуле:
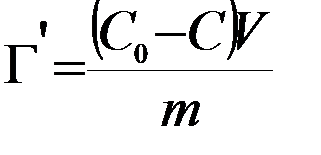 ,
,
где m – навеска угля; V – объем раствора в колбе; C0 – исходная концентрация исследуемого раствора; C – равновесная концентрация после адсорбции.
5. Для определения величины предельной адсорбции также используют графический метод определения констант в уравнении Ленгмюра.
6. Удельная поверхность адсорбента (активированного угля) определяется с помощью соотношения:
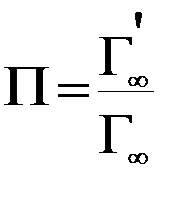 .
.
7. Все экспериментальные и расчетные данные заносятся в табл. 10, 11.
8.
До адсорбции углем Т а б л и ц а 10
| Раствор ПАВ, моль/л | Р, мм сп.ст. | σ, Дж/м2 | dσ/dc | Г, кмоль/м2 | С/Г | г∞ кмоль/м2 |
После адсорбции углем Т а б л и ц а 11
| Раствор ПАВ, моль/л | Р, мм сп.ст. | σ, Дж/м2 | dσ/dc | Г’, кмоль/м2 | С/Г’ | Г’∞ кмоль/м2 |
9. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Порядок выполнения работы
Измерение поверхностного натяжения исследуемого раствора проводят следующим образом.
1. На аналитических весах взвешивают небольшой сухой бюкс или стаканчик на 15 – 25 мл и записывают результат.
2. Заполняют микробюретку тремя мл дистиллированной водой. С помощью крана устанавливают постоянную скорость истечения раствора (примерно 1 капля за 5-10 секунд). В сухой и предварительно взвешенный бюкс отбирают 30 – 40 капель воды. Закрывают кран.
3. Взвешивают бюкс с водой и рассчитывают массу одной капли (mкапли).
4. Поверхностное натяжение определяют по формуле:
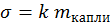 ,
,
где 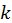 - постоянная капиляра, которая зависит от диаметра капилляра, материала капилляра, его чистоты.
- постоянная капиляра, которая зависит от диаметра капилляра, материала капилляра, его чистоты.
5. Постоянную капилляра определяют по известному поверхностному натяжению воды (эталонной жидкости).
6. Аналогичным образом определяют поверхностное натяжение растворов ПАВ заданных концентраций (начиная с самой маленькой концентрации). Перед отбором капель бюретку каждый раз промывают исследуемым раствором.
7. Каждое измерение массы капли повторяют не менее трех раз и рассчитывают среднее значение поверхностного натяжения раствора данной концентрации ПАВ. Полученные данные заносят в табл. 12.
Т а б л и ц а 12
| t0 опыта,,,0С | Константа капилляра, K | ||||||
| № п/п | Конц. раствора ПАВ, моль/л | Масса одной капли, мг | σ, Дж/М2 | ||||
| 1 | 2 | 3 | Средняя масса | ||||
|
| |||||||
8. На основании полученных данных строят изотерму поверхностного натяжения (рис.2.2). Зависимость поверхностного натяжения от концентрации ПАВ начинается из точки на оси ординат, отвечающей поверхностному натяжению воды при температуре эксперимента, и постепенно падает с увеличением концентрации раствора ПАВ.
9. Далее выполняют все вычисления и построения, описанные в работах № 8 и 9.
10. Затем рассчитывают число молекул, адсорбированных на 1м2 поверхности раздела фаз, площадь одной молекулы и толщину адсорбционного слоя.
11. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Белезин С.А. Практикум по физической и коллоидной химии. Учебное пособие. М.: Просвещение, 1980. 271с.
2. Гельфман М.И., Ковалевич О.В., Юстратов В.П. Коллоидная химия. СПб.: Лань, 2003. 332 с.
3. Елизарова Е.П. Коллоидная химия: учебн. пособие. СПб.: Изд-во политехн.ун-та, 2008. 85 с.
4. Е ременко Б.В.,Пелишенко С.С., Нижник В.В.,Усков И.А. Коллоидная химия Киев: Выща школа., 1988.168 с.
5. Коллоидная химия: метод. Указания к лаб. работам по коллоидной химии: Ульновск: Изд-во Ул ГТУ,2007. 76 с.
6. Морачевский А.Г. Физическая химия. Поверхностные явления и дисперсные системы: учебн. пособие. СПБ.: Изд-во «Лань», 2015.160 с.
7. Поверхностные явления. Изотермы адсорбции : метод. указания/ сост. Рощупкина И.Ю. , Алемаскина Г.А., Абдрахимова Е.С., Платонов И.А. – Самара: Изд-во Самар. Гос. Аэрокосм. Ун-т, 2013. 14 с.
8. Письменко В.Т., Калюкова Е.Н. Коллоидная химия. Методические указания к лабораторной работе по коллоидной химии. Ульяновск: УлГТУ, 2007, 76 с.
9. Практикум по коллоидной химии / Под ред. В.Г.Куличихина. М.: Вузовский учебник. ИНФРА-М. 2012. 288 c.
10. Практикум по коллоидной химии: Учеб. Пособие/ Баранова В.И., Бибик Е.Е., Кожевникова Н.М. и др. М.: Высш. шк., 1983. 216 с.
11. Савицкая Т.А., Шиманович Н.П. Практикум по коллоидной химии. (электронный ресурс) Часть1. http6// elib/bsu/by/handle /123456789/9858
12. Танцура Н.П. Поверхностные явления и дисперсные системы: учебн.пособие. СПб.:Изд-во Политехн. Универ - та, 2012.153 с.
13. Щ укин Е.Д., Перцов А.В., Амелина Е.А. Коллоидная химия. М.: Высш. шк., 2004. 445 с.
14. Ф ролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. Изд.3-е. М.: Альянс, 2004.462 с.
15.Ф ролов Ю.Г., Градский А.С. Лабораторные работы и задачи по коллоидной химии. М.: Химия, 1986. 216 с.
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ. 6
1. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ..
1.1. Термодинамическое описание поверхностного слоя в гетерогенных системах. Поверхностный слой на границе раздела фаз. 7
1.2. Поверхностное натяжение. 12
1.3. Поверхностное взаимодействие контактирующих. 16
конденсированных фаз: адгезия, смачивание, растекание. 16
Лабораторная работа № 1.
Поверхностное натяжение на границе жидкость – газ.
Метод сталагмометрии. 21
Метод максимального давления в газовом пузырьке. 23
Лабораторная работа №2.
Изотермы поверхностного натяжения.
растворов ПАВ и ПИВ.. 26
Лабораторная работа №3.
Изотермы поверхностного натяжения растворов ПАВ и ПИВ.. 27
Лабораторная работа №4.
Определение поверхностного натяжения.
растворов нескольких веществ одного гомологического ряда. 28
Лабораторная работа № 5.
Исследование влияния температуры..
на энергию поверхностного слоя. 30
Лабораторная работа № 6.
Парахор. 32
Лабораторная работа № 7.
Смачивание, изверение краевых углов. 35
2. АДСОРБЦИЯ.. 39
2.1 Основные понятия. 39
2.2. Фундаментальное уравнение адсорбции Гиббса. 41
2.3 Мономолекулярная теория адсорбции Ленгмюра. 43
2.4. Адсорбция на твердой поверхности. 45
Лабораторная работа № 8.
Изотерма поверхностного натяжения раствора поверхностно-активного вещества и адсорбция на границе жидкость - газ. 46
Лабораторная работа № 9.
Изотерма поверхностного натяжения раствора поверхностно-активного вещества и адсорбция на границе жидкость – газ. 48
Лабораторная работа № 10.
Определение адсорбции на границе твердое вещество - жидкость. 50
Лабораторная работа № 11.
Адсорбция различных веществ углем.. 53
Лабораторная работа № 12.
Исследование адсорбции ПАВ на границе раздела жидкость – газ методом поверхностного натяжения. 55
БИБЛИОГРАФИЧЕСКИЙ СПИСОК.. 58
ОГЛАВЛЕНИЕ.. 59
Елизарова Елена Петровна
САНКТ-ПЕТЕРБУРГСКИЙ
ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ПЕТРА ВЕЛИКОГО
________________________________________________________
Елизарова Е.П.
ФИЗИКО – ХИМИЯ
ПОВЕРХНОСТИ И ГРАНИЦ РАЗДЕЛА ФАЗ
Часть 1. «Поверхностные явления и адсорбция»
Учебное пособие
Санкт-Петербург
Издательство Политехнического университета
2016
Министерство образования и науки Российской Федерации
________________
САНКТ-ПЕТЕРБУРГСКИЙ
ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ПЕТРА ВЕЛИКОГО
________________________________________________________
Елизарова Е.П.
ФИЗИКО – ХИМИЯ
ПОВЕРХНОСТИ И ГРАНИЦ РАЗДЕЛА ФАЗ
Часть 1. «Поверхностные явления и адсорбция»
Учебное пособие
Санкт-Петербург
Издательство Политехнического университета
2016
УДК 543.06:539:620.3(076.5)
М31
Е л и з а р о в а Е. П. Физико-химия поверхности и границ раздела фаз. Часть 1. «Поверхностные явления и адсорбция»: учеб. пособие. / Е. П. Елизарова. – СПб. : Изд-во Политехн. ун-та, 2016. – 60 с.
Соответствует содержанию дисциплины Б2. В.3. «Физико-химия поверхности и границ раздела фаз» федерального государственного образовательного стандарта по направлению подготовки 22.03.01 «Материаловедение и технологии материалов» (уровень бакалавриата).
Учебное пособие содержит основные теоретические аспекты и методические указания к лабораторным работам по двум темам дисциплины Поверхностные явления и адсорбция.
Предназначено для студентов III курса СПбПУ, обучающихся по направлению подготовки «Материаловедение и технологии материалов», профиль «Материаловедение и технологии наноматериалов и наносистем», может быть полезно всем, кто интересуется вопросами, связанными с поверхностными явлениями и адсорбцией.
Табл. 12. Ил. 10. Библиогр. 15 назв.
Печатается по решению
Совета по издательской деятельности Ученого совета
Санкт-Петербургского политехнического университета Петра Великого.
Ó Елизарова Е.П., 2016
Ó Санкт-Петербургский политехнический
Университет Петра Великого, 2016
ВВЕДЕНИЕ
Поверхностные явления – важный раздел дисциплины «Физико-химия поверхности и границ раздела фаз». Они происходят потому, что на границе раздела фаз имеется переходная зона – поверхностный слой, свойства которого отличаются от свойств объемных фаз. Этот слой обладает избыточной поверхностной энергией. Изменение величины поверхностной энергии и приводит к возникновению поверхностных явлений. В учебном пособии уделено внимание таким вопросам, как граница раздела фаз, фундаментальное уравнение Гиббса для межфазной поверхности, поверхностное натяжение, смачивание, угол смачивания, уравнение Юнга, адгезия, когезия, коэффициент растекания и др.
Значительное место при изучении этой дисциплины отводится адсорбции. Адсорбция - самопроизвольный процесс, приводящий к различию в концентрациях компонентов в поверхностном слое и в объемной фазе. Основные понятия этого раздела: виды адсорбции, фундаментальное уравнение адсорбции Гиббса, изотерма Гиббса, мономолекулярная теория адсорбции Ленгмюра, адсорбция на твердом адсорбенте, ПАВ и ПИВ и др.
В пособии приведены методические указания к лабораторным работам по темам «Поверхностные явления и адсорбция».
Для описания поверхностных явлений используются законы термодинамики и химической кинетики.
1. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Дата: 2018-11-18, просмотров: 889.