Цель работы: определить поверхностное натяжение исследуемых растворов методом максимального давления в газовом пузырьке;
построить изотерму поверхностного натяжения;
определить величину адсорбции для каждого исследуемого раствора; построить изотерму адсорбции; графическим способом определить коэффициенты в уравнении Ленгмюра.
Приборы:установка для определения поверхностного натяжения методом максимального давления в газовом пузырьке, капилляр, химические стаканчики.
Реактивы:дистиллированная вода, набор растворов (шесть растворов ПАВ разной концентрации).
Для измерения поверхностного натяжения жидкости используется метод максимального давления в газовом пузырьке.
Порядок выполнения работы
1. Определяют величину максимального давления в газовом пузырьке сначала для воды (эталонной жидкости), а затем для исследуемых растворов. Начинают с самого разбавленного раствора ПАВ и последовательно переходят к растворам большей концентрации. Предварительно промывают прибор исследуемым раствором.
2. Рассчитывают поверхностное натяжение растворов разной концентрации по формуле (Л.1.5).
3. Строят изотерму поверхностного натяжения. По оси ординат откладывают 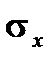 , по оси абсцисс – концентрацию.
, по оси абсцисс – концентрацию.
4. Определяют поверхностную активность 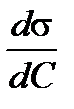 как производную из графика изотермы поверхностного натяжения. Поверхностную активность рассчитывают в джоулях на метр к киломолю [Дж·м/кмоль].
как производную из графика изотермы поверхностного натяжения. Поверхностную активность рассчитывают в джоулях на метр к киломолю [Дж·м/кмоль].
5. По уравнению (2.2.6) рассчитывают поверхностный избыток Г (R = 8,31·103 Дж/ (кмоль·К)).
6. Строят изотерму адсорбции (рис.2.2) (по оси ординат откладывают величину адсорбции, по оси абсцисс – концентрацию). Определяют значение предельной адсорбции.
7. Далее определяют предельную адсорбцию ( графическим решением уравнения Ленгмюра). Все графики выполняются на миллиметровой бумаге с помощью линейки и карандаша.
8. Экспериментальные и расчетные данные сводят в табл. 8 и анализируют полученные результаты.
Т а б л и ц а 8
| Раствор ПАВ, моль/л | Р, мм сп.ст. | σ, Дж/М2 | dσ/dc | Г, кмоль/м2 | С/Г | г∞ (1 способ) | г∞ (2 способ) |
9. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Лабораторная работа № 10. Определение адсорбции на границе твердое вещество - жидкость
Цель работы: изучить явление адсорбции на твердой поверхности;
количественно определить адсорбцию уксусной кислоты на угле;
построить изотерму адсорбции;
определить константы графически в уравнении Фрейндлиха;
сравнить теоретические и экспериментальные величины адсорбции,
рассчитать относительную погрешность.
Приборы :12 сухих конических колб объемом 250 мл, 6 воронок, пипетка на 10 мл, мерный цилиндр, бюретка на 50 мл, технические электронные весы, фильтры.
Реактивы: раствор уксусной кислоты, активированный уголь, 0,1 н раствор гидроксида натрия (калия), индикатор − фенолфталеин.
Получим изотерму адсорбции на твердой поверхности из раствора. В качестве адсорбента используют активированный уголь, имеющий большую удельную поверхность. Адсорбтивом является уксусная кислота.
Используется аналитический метод определения концентрации – метод титрования.
Порядок выполнения работы
1. В каждую из шести сухих колб (пронумерованных), кроме колбы 1, наливают по 50 мл дистиллированной воды, затем в колбы 1 и 2 − по 50 мл исследуемого раствора уксусной кислоты с помощью бюретки. Тщательно перемешивают содержимое колбы 2, и отобрав 50 мл разбавленной кислоты, переносят в колбу 3, из нее − в следующую по порядку колбу и т.д. Таким образом, получают шесть растворов; концентрация каждого из них уменьшается вдвое по сравнению с предыдущим раствором. Из последней колбы следует отобрать 50 мл раствора и отбросить. Таким образом, в каждой колбе объем раствора составляет 50 мл.
2. К 50 мл каждого раствора добавляют по 1 г активированного угля (навеску готовят на технических электронных весах). Содержимое колб хорошо перемешивают и оставляют для адсорбции на 30 мин.
3. За время адсорбции определяют концентрацию С0 исследуемого раствора кислоты титрованием 0,1 н NaOH (KOH) в присутствии индикатора фенолфталеина. Аликвотная часть кислоты составляет 5 мл. Концентрацию кислоты определяют по закону эквивалентов.
 Ск-ты=
Ск-ты= 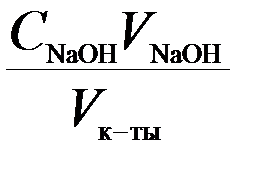 ,
,
где С – концентрация кислоты, моль/л; V – объем, мл.
Для остальных разбавленных растворов начальную концентрацию получают расчетом, последовательно уменьшая ее вдвое.
4. Через 30 мин отфильтровывают растворы от угля в сухие колбы с теми же номерами, и методом титрования определяют концентрацию шести растворов кислоты после адсорбции. По закону эквивалентов рассчитывают концентрации Ср. Для определения массы поглощенной кислоты достаточно знать объем раствора и концентрацию до и после адсорбции. Тогда количество поглощенной кислоты в 50 мл раствора определяется по формуле
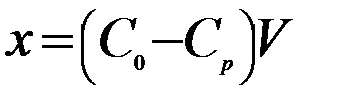 , моль;
, моль; 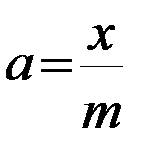 , моль/г.
, моль/г.
5.Экспериментальные и расчетные данные сводят в табл. 9.
Т а б л и ц а 9
| Конц. кислоты (С0)., моль/л, до адсорбции | VNaOH, мп | Конц. кислоты (Ср)., моль/л, после адсорбции | lg Ср | X, моль | x/m, моль/г | lgx/m |
6. . Для определения величины адсорбции используют уравнение (2.4.1). Постоянные К и 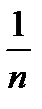 можно определить, графически решив уравнение Фрейндлиха. Прологарифмируем его. После логарифмирования оно преобразуется в уравнение прямой, не проходящей через начало координат (рис. 2.3):
можно определить, графически решив уравнение Фрейндлиха. Прологарифмируем его. После логарифмирования оно преобразуется в уравнение прямой, не проходящей через начало координат (рис. 2.3):
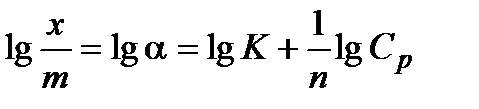
Строят изотерму адсорбции (рис.2.2) в координатах 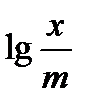 и lgCp . Эта прямая проходит под углом к абсциссе и отсекает на ординате отрезок 0К, равный lgK в масштабе оси ординат. Тангенс угла наклона
и lgCp . Эта прямая проходит под углом к абсциссе и отсекает на ординате отрезок 0К, равный lgK в масштабе оси ординат. Тангенс угла наклона 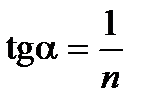 можно выразить как отношение 0К/0В, учитывая масштабы по обеим осям. Графически находят постоянные К и
можно выразить как отношение 0К/0В, учитывая масштабы по обеим осям. Графически находят постоянные К и 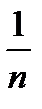 .
.
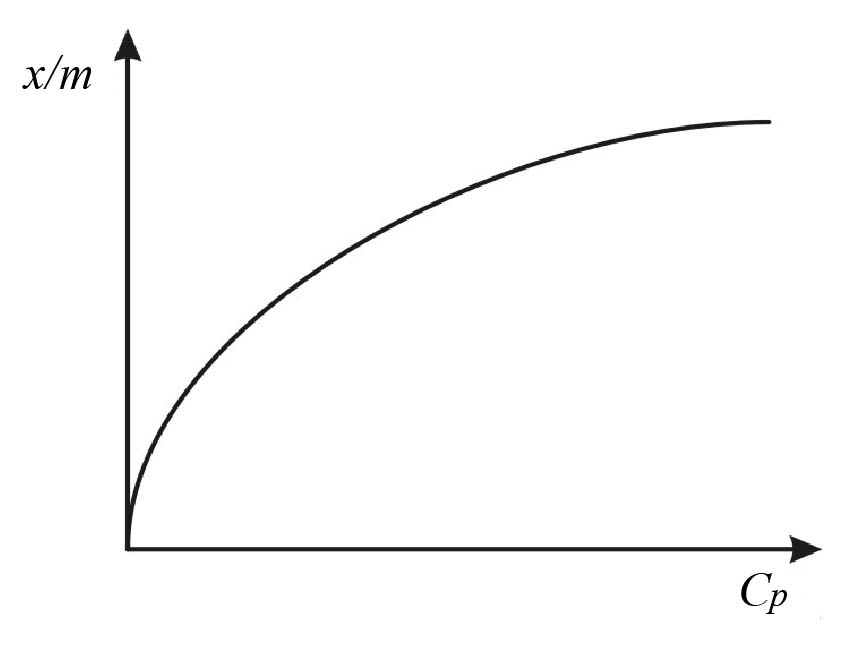
Рис.Л.10.2. Изотерма адсорбции на активированном угле
Подставив их в уравнение (2.4.1) для всех значений lgCp , получают значения 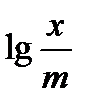 . Затем, найдя антилогарифмы, определяют
. Затем, найдя антилогарифмы, определяют 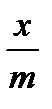 для шести растворов кислоты. Далее вычисляют отклонение
для шести растворов кислоты. Далее вычисляют отклонение 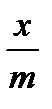 , рассчитанное от
, рассчитанное от 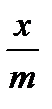 экспериментального.
экспериментального.
7. Строят изотерму адсорбции на активированном угле (рис.Л.10.2).
Все графики выполняются на миллиметровой бумаге с помощью линейки и карандаша.
8. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Лабораторная работа № 11. Адсорбция различных веществ углем
Цель работы: определить удельную поверхность твердогоадсорбента – активированного угля.
Приборы:установка для определения поверхностного натяжения методом максимального давления в газовом пузырьке, капилляр, химические стаканчики,конические пронумерованные колбы на 100 мл с пробками, воронки, бумажные фильтры.
Реактивы:дистиллированная вода, набор растворов (шесть растворов ПАВ разной концентрации), активированный уголь.
Порядок выполнения работы
Если известна площадь, занимаемая 1 молем вещества, находящегося на поверхности в виде мономолекулярного слоя (Пм, м2/ моль), а также предельная адсорбция ( 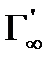 , моль/г) для твердого адсорбента, то удельная поверхность адсорбента (м2/г) рассчитывается по формуле:
, моль/г) для твердого адсорбента, то удельная поверхность адсорбента (м2/г) рассчитывается по формуле:
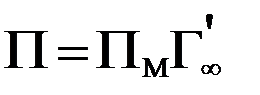 .
.
Площадь одной молекулы определяют, исследуя адсорбцию растворенного вещества (адсорбата) на границе раздела жидкость − газ. 1. На первом этапе для определения поверхностного натяжения используется метод максимального давления пузырька воздуха, который подробно описан в работе № 1 часть 2. Для исследования используют четыре-шесть растворов ПАВ (по заданию преподавателя).
Итогом этой части работы является определение предельной адсорбции и площади, приходящейся на 1 моль адсорбированного вещества (см. работу № 9):
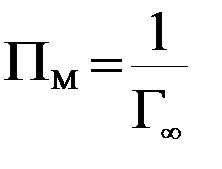
Для определения величины предельной адсорбции используют графический метод определения констант в уравнении Ленгмюра (работа № 9).
3. На втором этапе исследуют адсорбцию тех же самых растворов углем. В колбочки с пробкой помещают навески активированного угля (по 2 г), наливают по 25 мл каждого из исследуемых растворов. Колбочки с растворами встряхивают в течение 20 − 30 мин или переливают в специальные пробирки для центрифугирования (следует соблюдать инструкцию по технике безопасности при работе с центрифугой), где выдерживают их 10 − 15 мин.
4. Определяют поверхностное натяжение растворов после адсорбции растворенного вещества углем, по изотерме поверхностного натяжения находят новые концентрации растворов, а по разности – количество растворенного вещества, адсорбированное навеской угля. Количество вещества, адсорбированное 1 г угля, находят по формуле:
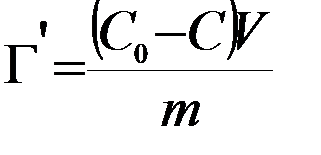 ,
,
где m – навеска угля; V – объем раствора в колбе; C0 – исходная концентрация исследуемого раствора; C – равновесная концентрация после адсорбции.
5. Для определения величины предельной адсорбции также используют графический метод определения констант в уравнении Ленгмюра.
6. Удельная поверхность адсорбента (активированного угля) определяется с помощью соотношения:
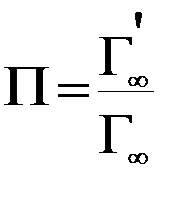 .
.
7. Все экспериментальные и расчетные данные заносятся в табл. 10, 11.
8.
До адсорбции углем Т а б л и ц а 10
| Раствор ПАВ, моль/л | Р, мм сп.ст. | σ, Дж/м2 | dσ/dc | Г, кмоль/м2 | С/Г | г∞ кмоль/м2 |
После адсорбции углем Т а б л и ц а 11
| Раствор ПАВ, моль/л | Р, мм сп.ст. | σ, Дж/м2 | dσ/dc | Г’, кмоль/м2 | С/Г’ | Г’∞ кмоль/м2 |
9. Отчет оформляется в соответствии с требованиями к оформлению отчетов.
Дата: 2018-11-18, просмотров: 880.