Как отмечалось ранее, большинство химических реакций в организме протекает с участием катализаторов — ферментов. Ферменты[11] — специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов.
Сходство ферментов и неорганических катализаторов заключается в том, что они:
© снижают энергию активации[12];
© не изменяют направления реакции, а лишь изменяют скорость ее протекания;
© в катализируемой реакции всегда затрачивается меньше энергии, чем в некатализируемой.
Но, поскольку ферменты являются белками, это придает им особые свойства:
© если неорганический катализатор может использоваться в разных типах реакций, то ферменты катализируют только одну реакцию или один вид реакции;
© большинство неорганических катализаторов ускоряют химические реакции при очень высоких температурах, имеют максимальную эффективность в сильнокислой или сильнощелочной среде, при высоких давлениях, а большинство ферментов активны при температурах 35-45˚С, физиологических значениях кислотности раствора и при нормальном атмосферном давлении;
© скорость ферментативных реакций в десятки тысяч (а иногда и в миллионы раз) выше скорости реакций, идущих с участием неорганических катализаторов. Например, пероксид водорода без катализаторов разлагается медленно: 2Н202 → 2Н20 + 02. В присутствии солей железа (катализатора) эта реакция идет несколько быстрее. Фермент каталаза за 1 сек. расщепляет 100 тыс. молекул Н202.
Известно более 2000 различных ферментов, представленных белками с высокой молекулярной массой, например каталаза (М=252000).
|
Строение ферментов |
Несмотря на большое количество и разнообразие ферментов, все их по особенностям строения молекул можно разделить на две группы:
©
|
© двухкомпонентные — сложные белки.
У двухкомпонентных ферментов, помимо белковой части, имеется добавочная группа небелковой природы — кофактор, например многие витамины.
В молекуле ферментов выделяют особую часть, представляющую собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Ее называют активным центром фермента. Именно эта часть фермента вступает в контакт с субстратом. Поскольку аминокислотные остатки, образующие каталитический центр, расположены в различных участках полипептидной цепи, он возникает только тогда, когда белковая молекула приобретает характерную для нее третич-
ную структуру (рис. 261). Если под влиянием каких-либо факторов происходит изменение третичной структуры фермента, то, как правило, это приводит к деформации каталитического центра и изменению ферментативной активности.
|
Свойства ферментов |
Ферменты как биологические катализаторы белковой природы обладают рядом важных свойств:
© все ферменты — глобулярные белки;
© ферменты обладают строгой специфичностью, каждый фермент катализирует только одну реакцию (или тип реакции);
© высокая активность, обеспечивающая протекание ферментативных реакций с большой скоростью;
© активность ферментов зависит от условий, в которых протекает реакция.
|
Механизм действия ферментов |
Ферментативные реакции протекают в несколько этапов:
© На первом этапе происходит образование фермент-субстратного комплекса за счет возникновения связей субстратного центра фермента с субстратом (или субстратами).
|
В 1959 году Д. Кошланд выдвинул гипотезу,
по которой пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу называют гипотезой "руки и перчатки" (гипотезой индуцированного соответствия) (рис. 262).
© На следующем этапе происходит сама химическая реакция и образуется продукт (продукты) этой реакции.
© На конечном этапе фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции.
Поскольку все ферменты являются белками, их активность наиболее высока при физиологически нормальных условиях:
© Большинство ферментов наиболее активно работает только при определенной температуре. При повышении температуры до некоторого значения (в среднем до 5О°С) каталитическая активность растет (на каждые 10°С скорость реакции повышается примерно в 2 раза). При температуре выше 50°С белок подвергается денатурации и активность фермента падает.
© Для каждого фермента существует оптимальное значение рН, при котором он проявляет максимальную активность.
| Фермент | Характер катализируемой реакции | рН |
| Пепсин | Гидролиз белка | 1,5-2,5 |
| Липаза | Гидролиз жиров | 4,7-5,0 |
Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. В резко кислой или резко щелочной среде хорошо работают лишь некоторые ферменты.
© При увеличении количества субстрата скорость ферментативной реакции растет до тех пор, пока количество молекул субстрата не станет равным количеству молекул фермента. При дальнейшем увеличении количества субстрата скорость увеличиваться не будет, так как происходит насыщение активных центров фермента.
© Так же на скорость реакции влияет увеличение концентрации фермента, так как в единицу времени преобразованиям подвергается большее количество молекул субстрата.
Углеводы
Углеводы, или сахариды, — органические вещества, в состав которых входит углерод, кислород, водород. Углеводы составляют около 1% массы сухого вещества в животных клетках, а в клетках печени и мышц — до 5%. Наиболее богаты углеводами растительные клетки (до 90% сухой массы). Химический состав углеводов характеризуется их общей формулой Сm(Н2О)n, где m≥n. Количество атомов водорода в молекулах углеводов, как правило, в два раза больше атомов кислорода (то есть как в молекуле воды). Отсюда и название — углеводы.
Различают две группы углеводов:
© простые сахара;
© сложные сахара, образованные остатками простых сахаров.
Простые углеводы
Простые углеводы называют моносахаридами, так как они не гидролизуются. Общая формула простых сахаров — (СН2О)n, где n ≥ 3.В зависимости от числа атомов углерода в молекуле моносахаридов различают: триозы (3С), тетрозы (4С), пентозы (5С), гексозы (6С), гептозы (7С). В природе наиболее широко распространены пентозы и гексозы.
|
Свойства моносахаридов |
© Низкая молекулярная масса;
© сладкий вкус;
© легко растворяются в воде;
© кристаллизуются;
© относятся к редуцирующим (восстанавливающим) сахарам.
Важнейшие моносахариды: из пентоз — дезоксирибоза и рибоза, входящие в состав ДНК, РНК и АТФ; из гексоз наиболее распространены глюкоза, фруктоза и галактоза (общая формула С6Н12О6).
Молекулы моносахаридов могут иметь вид прямолинейных цепочек или циклических структур (рис. 263). Для пентоз и гексоз — наиболее характерна именно циклическая структура, линейные молекулы встречаются очень редко. Молекулы дисахаридов и полисахаридов также образованы
|
Моносахариды могут быть представлены в форме a- и b-изомеров (рис. 264). Гидроксильная группа при первом атоме углерода может располагаться как под плоскостью цикла (a-изомер), так и над ней (b-изомер). a- и b-изомеры играют важную роль, например, в образовании крахмала и целлюлозы.
|
Дата: 2018-11-18, просмотров: 414. |
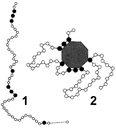 Рис. 261. Строение фермента:
1 — первичная структура молекулы ферментного белка (черным цветом обозначены аминокислоты, входящие в состав активного центра фермента); 2 — схематическое изображение фермент-субстратного комплекса.
Рис. 261. Строение фермента:
1 — первичная структура молекулы ферментного белка (черным цветом обозначены аминокислоты, входящие в состав активного центра фермента); 2 — схематическое изображение фермент-субстратного комплекса.
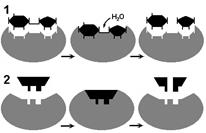 Рис. 262. Соответствие фермента и субстрата:
1 — гипотеза "ключа и замка"; 2 — гипотеза "руки и перчатки".
Рис. 262. Соответствие фермента и субстрата:
1 — гипотеза "ключа и замка"; 2 — гипотеза "руки и перчатки".
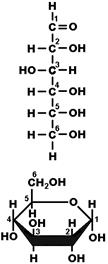 Рис. 263. Линейная и циклическая структура молекулы глюкозы.
Рис. 263. Линейная и циклическая структура молекулы глюкозы.
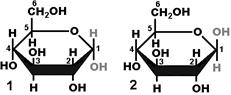 Рис. 264. Изомеры глюкозы:
1 — a-изомер; 2 — b-изомер.
Рис. 264. Изомеры глюкозы:
1 — a-изомер; 2 — b-изомер.