Белки являются полимерами, то есть состоят из нескольких структурных единиц — мономеров. Белки представляют собой непериодичные полимеры, мономерами которых являются аминокислоты.
В клетках и тканях обнаружено свыше 170 различных аминокислот, но в состав белков входит лишь 26. Причем 6 из них являются нестандартными. Они образуются в результате модификации стандартных аминокислот уже после их включения в полипептидную цепь. Поэтому обычными компонентами белков можно считать лишь 20 аминокислот.
В зависимости от того, могут ли аминокислоты синтезироваться в организме, различают:
© заменимые аминокислоты — десять аминокислот, синтезируемых в организме;
© незаменимые аминокислоты — аминокислоты, которые в организме не синтезируются.
Растения способны синтезировать все необходимые им аминокислоты, а животные же — лишь половину. Незаменимые аминокислоты должны поступать в организм вместе с пищей.
В зависимости от аминокислотного состава, белки бывают:
© полноценными, если содержат весь набор аминокислот;
© неполноценными, если какие-то аминокислоты в их составе отсутствуют.
Основная масса аминокислот, входящих в состав молекулы белка, яв-
|
В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают:
© нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу;
© основные аминокислоты, имеющие более одной аминогруппы;
© кислые аминокислоты, имеющие более одной карбоксильной группы.
Свойства аминокислот зависят не столько от количества аминогрупп и карбоксильных групп, сколько от их радикалов. Радикалы могут быть простыми и сложными, небольшими по размерам и громоздкими, гидрофильными и гидрофобными, химически инертными и высокоактивными, полярными и неполярными, заряженными положительно и отрицательно и т.д. Особенности радикалов, их число и расположение оказывают существенное влияние на структуру, химические и физические свойства полипептидов.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах. Это зависит от рН раствора и от того, какая аминокислота: нейтральная, кислая или основная.
|
Пептиды |
Пептиды — органические вещества, состоящие из остатков аминокислот[10], соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот (рис. 256). При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой, между ними возникает ковалентная азот-углеродная связь, которую называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пепти-
|
На одном конце молекулы находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
В широком смысле пептиды и белки — одно и то же. В более узком
— пептидами называют олигопептиды, содержащие до 10 остатков аминокислот, белками же называют полипептиды, состоящие из более чем 10 остатков.
|
Структура белковой молекулы |
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул. Кроме того, клетке энергетически невыгодно держать белки в развернутой форме — в виде цепочки. Поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Образование компактных конформаций возможно благодаря возникновению внутримолекулярных и межмолекулярных связей (прежде всего водородных), возникающих между различными группировками аминокислотных остатков полипептидных цепей, а также в результате гидрофобных взаимодействий между неполярными радикалами. Выделяют 4 уровня пространственной организации белков (рис. 257).
|
Первичная структура |
Под первичной структурой белка понимают последовательность расположения аминокислотных остатков в одной или нескольких полипептидных цепях, составляющих молекулу белка.
Первым белком, у которого была выявлена аминокислотная последовательность, стал гормон инсулин. Исследования проводились в Кембриджском университете Ф.Сэнгером с 1944 по 1954 год. Было выявлено, что молекула инсулина состоит из двух полипептидных цепей (21 и 30 аминокислотных остатков), удерживаемых около друг друга дисульфидными мостиками. За свой кропотливый труд Ф.Сэнгер был удостоен Нобелевской премии.
|
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка.
|
Вторичная структура |
|
Вторичной структурой называют упорядоченное свертывание полипептидной цепи. Основным вариантом вторичной структуры является a-спираль, имеющая вид растянутой пружины. Она образована одной полипептидной цепью в результате возникновения внутримолекулярных водородных связей между
карбоксильными группами и аминогруппами, расположенными на соседних витках спирали (рис. 258). Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость.
|
Третичная структура |
Большинство полипептидных цепей приобретает вид компактной глобулы. Третичная структура — это способ укладки полипептидных цепей глобулярных белков, возникающий в результате образования изгибов, приводящих к наложению одних участков спирали на другие, и определенных взаимодействий между этими участками. При образовании третичной структуры происходит сшивание участков в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между боковыми цепями аминокислотных остатков.
|
У некоторых белков третичная структура стабилизируется ди-
сульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. Третичная структура специфична для каждого белка.
|
Четвертичная структура |
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. В одних белках субъединицы одинаковы или имеют сходное строение, в других различны. Однако они всегда образуют единое целое и располагаются в молекуле симметрично.
Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи.
Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя a-субъединицами (141 аминокислотный остаток) и двумя b-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
|
Классификация белков |
Обычно белки классифицируют по отдельно взятым признакам.
По химическому составу различают:
© простые — белки, состоящие только из аминокислот (фибрин, трипсин);
© сложные — белки, содержащие помимо аминокислот еще и небелковую — простетическую группу, которая может быть представлена ионами металлов (металлопротеины — гемоглобин), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
По форме молекулы различают:
© Глобулярные — белки, имеющие сферическую форму — форму компактной глобулы (инсулин, белки крови, ферменты). Для них наиболее важна третичная структура. Хорошо растворимы в воде, в разбавленных водных растворах кислот, оснований и солей.
© Фибриллярные — белки, имеющие вытянутую форму молекул, обычно собранных в пучки, образующие волокна (кератин ногтей, волос, перьев, паутины, шелка, коллаген сухожилий). Для них наиболее важна вторичная структура. Нерастворимы в воде. Отличаются большой механической прочностью.
Дата: 2018-11-18, просмотров: 395. |
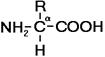 Рис. 255. Общая формула аминокислот.
Рис. 255. Общая формула аминокислот.
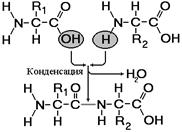 Рис. 256. Образование дипептида.
Рис. 256. Образование дипептида.
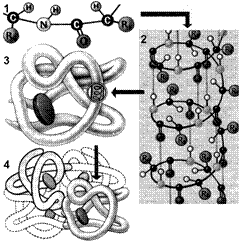 Рис. 257. Структура белковой молекулы:
1 — первичная; 2 — вторичная; 3 — третичная; 4 — четвертичная структуры.
Рис. 257. Структура белковой молекулы:
1 — первичная; 2 — вторичная; 3 — третичная; 4 — четвертичная структуры.
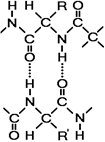 Рис. 258. Водородные связи.
Рис. 258. Водородные связи.
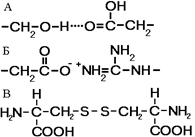 Рис. 259. Связи, стабилизирующие третичную структуру:
А — водородные, Б — ионные, В — дисульфидные.
Рис. 259. Связи, стабилизирующие третичную структуру:
А — водородные, Б — ионные, В — дисульфидные.