ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
« ДОНЕЦКИЙ НАЦ И ОНАЛЬН Ы Й УН И ВЕРСИТЕТ »
БИОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
ОБЩАЯ БИОЛОГИЯ
(Руководство к лабораторным занятиям для студентов 1-го курса специальности 06.03.01 Биология)
Донецк 2018
Составители: Е.Н. Маслодудова канд. биол. наук, доцент
Е.В. Сухинина ст. лаборант
Руководство к лабораторным занятиям написано в соответствии с программой курса Общая биология для студентов университетов, обучающихся по специальности «Биология».
Руководство охватывает все разделы дисциплины и дает отчетливое представление о развитии органического мира. В пособие собраны различные задания, упражнения, вопросы для размышлений, таблицы и схемы для заполнения и сравнения.
Каждое занятие содержит краткую теоретическую справку, перечень необходимого оборудования, методические указания к выполнению работы.
В пособии уделено внимание культивированию простейших в лаборатории как первой ступени подготовки исследователя в области биологии.
| № п/п | Название темы |
| 1 | Устройство световых микроскопов. Правила пользования микроскопом. Техника микроскопирования. - 2часа |
| 2 | Простейшие. Культивирование в лаборатории Составление схем поэтапной работы создания культуры простейших. -4 часа |
| 3 | Методы культивирования саркодовых в лаборатории. -2 часа |
| 4 | Методы культивирования жгутиконосцев в лаборатории. -2 часа |
| 5 | Методы культивирования инфузорий в лаборатории. Изготовление временных и постоянных препаратов. –6 час. |
| Модульный контроль - 2 часа | |
| 6. | Онтогенетический уровень организации жизни Биология клетки . Эукариотическая клетка. Многообразие клеток и тканей животных и человека - 4 часа |
| 7. | Биология развития. Качественные отличия живого от неживого. Особенности организации живой материи во времени и пространстве. Клеточная теория строения живых организмов. Деление клетки – 2 часа |
| 8. | Индивидуальное развитие организмов Размножение. Формы размножения организмов и их цитологические основы. Этапы и морфология. Гаметогенез. Мейоз. Органогенез. - 4 часа. |
| 9. | Популяционно - видовой уровень организации Эволюция органического мира, факторы эволюционного процесса: наследственная изменчивость, свойственный отбор, дрейф генов, изоляция, миграция особей, борьба за существование. Видообразование и макроэволюционные процессы. Вид. Критерии вида. Видообразование. Основные направления эволюционного процесса. Пути достижения биологического прогресса- 2 часа |
| 10 | Биогеоценотический уровень организации . Цепи питания. Свойства и типы, характеристика биогеоценозов. . Биогенные круговороты углерода, азота, воды – 2 часа |
| Всего -32 часа |
ЗАНЯТИЕ 1 (2 часа)
ТЕМА: Устройство световых микроскопов. Правила пользования микроскопом. Техника микроскопирования.
Методы культивирования простейших. -2часа
ЦЕЛЬ: Ознакомиться с устройством микроскопа МБР-1, с правилами микроскопирования и методами изготовления временных микропрепаратов, а также с другими марками микроскопов – МБИ-3, МБС-1.
СОДЕРЖАНИЕ:
1. Изучение устройства микроскопа МБР-1.
2. Правила работы с микроскопом МБР-1.
3.Изготовление временных препаратов простейших.
МАТЕРИАЛ И ОБОРУДОВАНИЕ: микроскопы МБР-1, МБИ-3, МБС-1, чашки Петри, предметные и покровные стёкла, пипетки, стаканчики с водой, пинцеты глазные, препаровальные иглы, марлевые салфетки, вата, крылья бабочек.
Таблицы: устройство микроскопа, порядок оформления лабораторных работ.
НОВАЯ ТЕРМИНОЛОГИЯ: макровинт, микровинт, конденсор, тубус, оптическая ось, окуляр, объектив, предметный столик, фокусное расстояние, временный препарат.
Работа 1. Устройство микроскопа МБР-1.
Рассмотрите основные части микроскопа МБР-1: механическую, оптическую и осветительную (рис. 1).
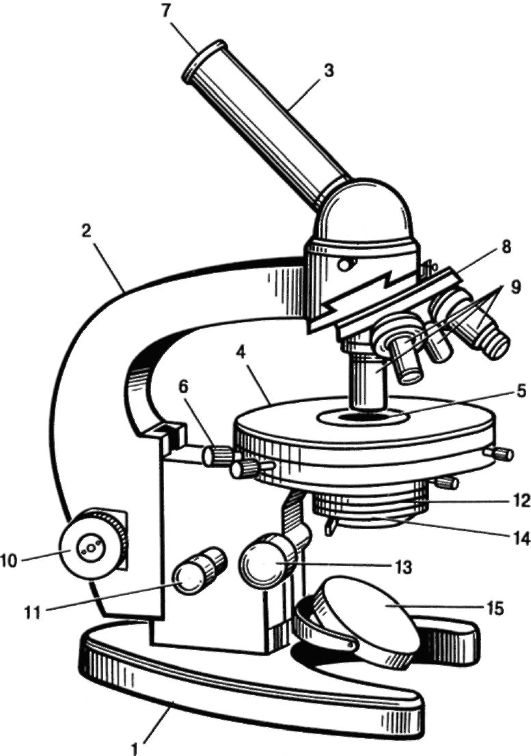
.
Рис. 1. Микроскоп МБР-1:
1 - основание (штатив); 2 - тубусодержатель; 3 - тубус; 4 - предметный столик; 5 - отверстие предметного столика; 6 - винты, перемещающие столик; 7 - окуляр; 8 - револьвер; 9 - объектив; 10 - макрометрический винт; 11 - микрометрический винт; 12 - конденсор; 13 - винт конденсора; 14 - диафрагма; 15 - зеркало
К механической части относятся: штатив, предметный столик, тубус, револьвер, макро- и микрометрический винты. Оптическая часть микроскопа представлена окулярами и объективами. Осветительная система микроскопа состоит из зеркала, конденсора и диафрагмы.
Зарисуйте устройство микроскопа.
Работа 2. Правила работы с микроскопом МБР-1.
1. Поставьте микроскоп штативом к себе, предметным столиком от себя.
2. Приведите в рабочее положение объектив малого увеличения. Для этого поворачивайте револьвер до тех пор, пока нужный объектив не займёт срединное положение по отношению к тубусу и предметному столику (встанет над отверстием столика). Когда объектив занимает срединное (центрированное) положение, в револьвере срабатывает специальное устройство-защёлка. При этом слышится лёгкий щелчок и револьвер фиксируется. Запомните, что изучение любого объекта начинается с малого увеличения.
3.Поднимите с помощью макровинта объектив над столиком примерно на 0,5 см.
4.Конденсор поднимите вплотную к столику. Откройте диафрагму.
5. Глядя в окуляр (левым глазом!), вращайте зеркало в разных направлениях до тех пор, пока поле зрения не будет освещено ярко и равномерно.
6. Положите на предметный столик препарат покровным стеклом вверх, чтобы объект находился в центре отверстия предметного столика.
7. Переведите глаз с окуляра на объектив и медленно опустите тубус с помощью макровинта, чтобы объектив находился на расстоянии около 2 мм от препарата.
8. Смотрите в окуляр и одновременно медленно поднимайте тубус с помощью кремальеры до тех пор, пока в поле зрения не появится изображение объекта (запомните, что фокусное расстояние для малого увеличения равно 0,5 см).
9. Для того чтобы перейти к рассмотрению объекта при большом увеличении микроскопа, прежде всего, центрируйте препарат, т.е. поместите объект или ту его часть, которую вы рассматриваете, в самый центр поля зрения. Для этого, глядя в окуляр, передвигайте препарат руками, пока объект не займёт нужного положения. Если объект не будет центрирован, то при большом увеличении он останется вне поля зрения.
10. Вращая револьвер, переведите в рабочее положение объектив большого увеличения.
11. Глядя в микроскоп, слегка и очень осторожно опускайте тубус поворотом микровинта по часовой стрелке.
12. Для тонкой фокусировки используйте микрометрический винт.
13. При зарисовке препарата смотрите в окуляр левым глазом, а в альбом – правым.
14. Закончив рассмотрение объекта, переведите микроскоп снова на малое увеличение и только затем снимите препарат со столика.
15. Все перечисленные здесь действия в такой же последовательности повторяйте каждый раз при работе с микроскопом.
16. Содержите микроскоп в чистоте: каждый раз при использовании смахивайте с него пыль мягкой кисточкой или мягкой тряпочкой. Не развинчивайте окуляры и объективы. При хранении микроскопа объектив должен стоять на малом увеличении или в нейтральном положении.
17. Микроскоп храните накрытым чехлом.
Работа 3. Изготовление временных препаратов простейших.
САРКОДОВЫЕ
Амебы. Амебы встречаются в мелких пресноводных водоемах-прудах, канавах, лужах, болотах, - богатых гниющими растительными остатками преимущественно в придонном слое воды. В теплое время года их можно собрать для занятия непосредственно в природе. Тем или иным путем взмучивают поверхностный слой ила и собирают его вместе с водой в сосуд, экскурсионное ведерко. В частности, этого можно добиться, опустив в воду аквариумный сосуд или ведерко отверстием книзу; у самого дна водоема сосуд резко наклонить; выходящий воздух поднимет со дна, который вместе с водой наполнит банку. Амеб собирают также, осторожно соскабливая скальпелем поверхностный налет на нижней стороне плавающих листьев волной растительности. Использование материала возможно после того, как принесенная с водоема проба спокойно постоит несколько часов.
В более позднее время года амеб специально культивируют. В простейшем случае ограничиваются тем, что доставляют в лабораторию из подходящих водоемов воду вместе с илом и гниющими остатками; материал используют через 1/2 месяца. Культура становится обильнее, если ее подкормить; для этого доставленную из водоема воду после фильтрования приливают по полстакана в сосуд (банку, простоквашницу), в котором за 3-4 дня до этого нарезанное сено залито водой (слой воды над сеном около 2см).
Культура амеб, и в частности амебы протеус, развивается еще лучше на специально приготовленной питательной среде, исключающей к тому же присутствие рачков: на рисовом настое, почвенном настое. Лучшие результаты достигаются смесью почвенного настоя и настоя из молодых древесных веток. Одновременно с настоем на огородной почвенной земле готовится настой из молодых лиственных деревьев. Через 7-10 дней слить в один сосуд оба настоя в равных частях. Богатая микрофлора разовьется здесь через 5-7 дней. Питательную среду разлить в несколько небольших кристаллизаторов (чашки Коха) и заразить амебами, выловив их пипеткой из пробы, принесенной с водоема.
В любом случае культура сохраняется жизнеспособной 2-3 месяца, после чего следует произвести пересев в свежую питательную среду.
Перед началом занятия, по крайней мере за четверть часа, животные рассаживаются на предметные стекла. Пробы берутся пипеткой из придонного слоя культуры и с поверхностной пленки. Из сборной культуры быстрее и с большим успехом корненожки вылавливаются следующим путем: на поверхность воды осторожно плашмя накладываются покровные стекла; они удерживаются на пленке поверхностного натяжения и на нижней их стороне собираются саркодовые; через несколько часов или на другой день перед занятием стекла снимают и, не переворачивая, переносят на предметные стекла снабдив их восковыми ножками.
Микропрепараты менее пригодны для проведения занятия и используются при отсутствии живого материала. Для изготовления микропрепаратов амебы фиксируются подогретой перед использованием до 50-60° жидкостью Шаудина. Приготовление фиксатора: 8-9 г кристаллической сулемы нагреть до кипения в 100 см3 дистиллированной воды, охладить в темноте (получится насыщенный раствор), декантировать, смешать с 96-градусным или абсолютным спиртом в отношении 2:1. Покровное стекло с амебами, снятое с поверхностной пленки в аквариуме и снабженное восковыми ножками, наложить на каплю фиксирующей жидкости на предметном стекле. Жидкость фиксирует и одновременно приклеивает амеб к стеклу. Через 3-5 мин амеб подвергают йодированию, т. е. отмыванию йодом фиксатора, содержащего-сулему: покровное стекло снимают и погружают в смесь 1-2 частей йодной тинктуры и 100 частей 70-градусного спирта; сулема и йод образуют легка растворимое в спирте соединение. Смесь сменяют несколько раз до прекращения обесцвечивания (потребное для этого время не превышает 5-10 мин). Амебы остаются при этом приклеенными к стеклу жидкостью Шаудина.
Для лучшего выявления ядра препарат окрасить гематоксилином по Делафильду: промыть его предварительно 70-градусным спиртом, а затем дистиллированной водой и перенести на сутки в водный раствор красителя" (одна часть красителя на 150-200 частей дистиллированной воды). Гематоксилин можно заменить квасцовым кармином. Промыть препарат в воде,провести быстро через спирт возрастающей крепости для обезвоживания, просветлить в ксилоле (гвоздичном масле) и быстро заключить в канадский бальзам.
Арцеллы и диффлюгии. В культурах амеб всегда встречаются в большем или меньшем количестве и пресноводные раковинные корненожки - арцеллы, диффлюгии и др. Сбор их в природе, культивирование в лаборатории, приготовление питательной среды и рассаживание на предметные стекла осуществляется так же, как указано для амеб. Богатые сборы раковинных корненожек дает выжимка (рукой) мха: выжатый мох прополоскать в отжатой жидкости и снова выжать его. Изготовление тотальных; микропрепаратов ведется так же, как описано для амеб; микропрепараты раковин готовятся более простым путем.
Изготовление микропрепарата раковин на глицерин-желатине. Раковины корненожек не нуждаются в фиксации, окраске, обезвоживании и просветлении; вместо канадского бальзама можно использовать смесь глицерина-желатины. Приготовление: 7 г кристаллической желатины размочить в течение 2-3 ч в 42 см3дистиллированной воды; добавить 50 г глицерина и 0,5-1 г кристаллической карболовой кислоты; смесь, помешивая, подогреть на водяной бане, профильтровать через стеклянную вату и охладить; смесь затвердевает в прозрачную желеобразную массу.
Покровное стекло, снятое с поверхностной пленки аквариума с приставшими к нему раковинами, перенести на сутки в глицерин. Кусочек приготовленной смеси поместить в центре предметного стекла и слегка подогреть (над пламенем спиртовки, на металлической пластинке, лежащей на электроплитке, или иным путем); смесь разжижается; накрыть ее покровным стеклом с раковинами корненожек и очень осторожно подогревать с тем, чтобы избежать бурных токов смеси, которые могут вынести объект за пределы покровного стекла. Смесь должна заполнить все пространство под покровным стеклом, не выступая за края его.
Раковина фораминифер. Эти корненожки собираются вместе с морским песком. Песок отмучивают для удаления ила; грубые примеси удаляются просеиванием через металлическое решето с ячеями до 2 мм в диаметре. Фиксировать 70-градусным спиртом. Раковинки выбирают препаровальными иглами под лупой. Микропрепараты готовят на канадском бальзаме с проведением из 96-градусного спирта через абсолютный спирт или, при его отсутствии, через карбол-ксилол: одна объемная часть карболовой кислоты и четыре части ксилола.
ЖГУТИКОНОСЦЫ
Свободноживущие зеленоокрашенные жгутиконосцы. Эвглены и другие подобные жгутиконосцы обитают в стоячей загрязненной воде, т. е. богатой органическими веществами - в прудах, болотах и в лужах поблизости от навозных куч, где они иногда появляются в таких огромных количествах, что окрашивают воду в зеленый цвет.
Эвглен нетрудно разводить на искусственно приготовленной питательной среде. Основу ее составляет минеральная смесь Кнопа, Бенеке или Успенского; смесь Кнопа: сернокислого магния MgSCX-0,25 г, азотнокислого кальция Ca(NO3)2-1,0 г, фосфорнокислого калия КН2РО4 - 0,25 г, хлористого калия КС1-0,12 г, следы хлористого железа FCl3, дистиллированная вода - 1 л. К ней через каждые 1-2 дня добавляется несколько капель мясного бульона. Последний готовится кипячением мелко нарезанных кусочков нежирного мяса с последующей фильтрацией через вату так же, как описано для культивирования дафний.Длительное культивирование эвглен возможно и на почвенном настое с добавлением или без добавления бульона.
Культуру эвглен, собранных в природе или разведенных в искусственных условиях, можно "обогатить", т. е. сконцентрировать эвглен в небольшом объеме воды. Для этого сосуд, куда переносят воду с находящимися в ней: эвгленами (стаканчик, пробирку, небольшую колбу), закрывают со всех сторон черной бумагой, в которой вырезают небольшое отверстие; сосуд помещают отверстием к источнику света. Вследствие положительного фототаксиса (т. е. движения к свету) эвглены скапливаются в течение суток в небольшом освещенном пространстве, откуда они вылавливаются пипеткой.
Микропрепараты жгутиконосцев (эвглен). А. Для обнаружения жгута к капле культуры на предметном стекле прибавить каплю 10-процентного раствора красителя - опаловый синий. Тотчас же сделать на том же стекле тонкий мазок: другое (чистое) предметное шлифованное стекло подвести к капле смеси (культуры и красителя) и, удерживая стекло в наклонном положении, передвигать его вдоль первого стекла; смесь распределится на предметном стекле тонким слоем. После подсыхания нанести на мазок каплю канадского бальзама или глицерин-желатины и накрыть покровным стеклом. Бесцветные жгутики видны на голубом фоне красителя. Б. Для обнаружения хроматофоров обесцветить эвглен, продержав их 1-2 дня в темноте; парамил при этом потребляется, а хроматофоры выступают отчетливее. Фиксировать 2-процентным формалином, обезводить глицерином: к капле воды с фиксированными эвгленами добавить каплю глицерина и отсосать ее (осторожно!); поверх положить комочек смеси глицерин-желатины, подогреть и; накрыть покровным стеклом.
ИНФУЗОРИИ
Культура туфельки хвостатой. Культура ставится за 2-3 недели до использования ее на занятии. Для нее готовится питательная среда по любому описанному ниже способу. 1. Сенной настой: мелко нарезанное луговое сено: залить водой (речной, прудовой), которая должна на 1-2 см выступать над сеном. 2. Сенной навар: 15-20 г мелко нарезанного лугового сена залить 1л воды, в колбе с ватной пробкой кипятить 15-20 мин, навар охладить и разлить в чашки или простоквашницы, разбавляя остуженной кипяченой водой. 3. Настой на зернах риса и пшеницы. 4. Навозный настой 5. Молочная питательная среда: чистые химические пробирки залить на 3/4 профильтрованной через бумажный фильтр речной или прудовой водой, прибавить в каждую по 2-3 капли снятого молока, заткнуть ватными пробками.
Приготовленную тем или иным путем питательную среду оставить на несколько дней открытой с тем, чтобы в ней развились бактерии, которыми питаются инфузории. Для заражения к ней прибавляют (около стакана) воды, взятой из придонного слоя с некоторым количеством ила из водоема (пруд, озерцо, лужа), богатого гниющими растительными остатками. Массовые скопления туфелек заметны по краям сосуда поблизости от поверхности воды. В пробирки с молочной средой пересаживают пипеткой по 10-12 туфелек и сохраняют месяцами; 1-2 раза в месяц добавляют по капле молока.
Инфузорий для занятия выбирают из мест их скопления. Для получения: большего количества особей в небольшом количестве воды можно их сконцентрировать одним из следующих способов: 1) культуру профильтровать через складчатый бумажный фильтр, ополоснуть и воронку опрокинуть в чашку Петри; 2) перелить часть культуры в длинную трубку (до 1/2 м), вертикально-закрепленную в штативе: в силу отрицательного геотропизма туфельки соберутся в поверхностном слое; 3) центрифугировать культуру в течение 5 мин. и пробу взять со дна центрифужной пробирки.
Изготовление микропрепаратов туфелек. Тотальные микропрепараты готовят простейшим, хотя и не столь надежным, способом из фиксированных" 3-4-процентным формалином туфелек. После фиксации их в небольшой пробирке осторожно отсосать фиксатор пипеткой ("проверить под лупой, чтобы не удалить инфузорий); обезводить глицерином: внести в пробирку немного смеси равных частей глицерина и воды, через несколько часов заменить (контроль под лупой!) эту смесь более концентрированной - две части глицерина и одна часть воды; через несколько часов сменить смесь на чистый глицерин, в котором сохранять материал не менее суток. Несколько инфузорий перенести в каплю разогретой смеси глицерин-желатины. Можно туфелек окрасить квасцовым кармином, который приливается на несколько минут к фиксированным инфузориям, слегка отмытым водой; до обезвоживания краситель отмывается водой.
Вольвокс
В летнее время вольвоксов собирают водным сачком из мельничного газа. Сохраняют их фиксированными в 4-5-процентном формалине.
Культивирование. Культуру вольвоксов можно получить на почвенном наваре: 3 кг сухой огородной земли кипятить в 2 л воды в эмалированной посуде; отстаивать в течение двух дней, декантировать. После фильтрации жидкость уварить в колбе из стекла "Дружная горка" до объема в 0,5 л и добавить немного хлористого железа FеСl3 (две платиновые петли). Навар сохранять в эрленмейеровской колбе из того же стекла с пробкой из стерильной ваты. При использовании разбавлять в 40 раз дважды дистиллированной водой. В такую жидкость перенести несколько живых вольвоксов, сохранять на подоконнике.
Изготовление микропрепаратов. Простейший способ: к капле воды с отсаженными фиксированными вольвоксами прибавить немного порошка гуммиарабика (на кончике скальпеля), оставить препарат для высыхания (накрыть каким-нибудь колпаком), нанести на образовавшуюся пленку каплю канадского бальзама или глицерин-желатины, накрыть покровным стеклом.
Предпочтительнее готовить микропрепараты на гуммиарабиковой смеси: в каплю такой смеси на предметном стекле пересадить несколько фиксированных в формалине вольвоксов и накрыть покровным стеклом. Не требуется при этом ни обезвоживания, ни просветления объекта. Способ приготовления гуммиарзбиковой смеси: 1 часть сухого гуммиарабика растворить в 10 частях дистиллированной холодной (без подогревания) воды с добавлением 10 частей глицерина; использовать через несколько месяцев после приготовления.
На глицерин-желатине препараты готовят с предварительным обезвоживанием путем проведения через глицерин возрастающей концентрации.
Работа 9. Мозжечок
Готовый окрашенный препарат рассматривается при малом (х8) и большом (х40) увеличении. При малом увеличении видны: 1) корка мозжечка (серое вещество), разделенная на два слоя (молекулярный, окрашенный в коричневый цвет, и ганглионарный, образованный нейронами); 2) белое вещество, образованное отростками нейронов. При большом увеличении внимательно рассмотрите нейроны. Хорошо видны их дендриты и ядро (рис.12).
Зарисуйте препарат целиком. На рисунке должны быть обозначены: 1) кора мозжечка, а в ней: а) молекулярный слой, б) ганглионарный слой, в) тела нейронов, г) дендриты, д) ядра; 2) белое вещество.
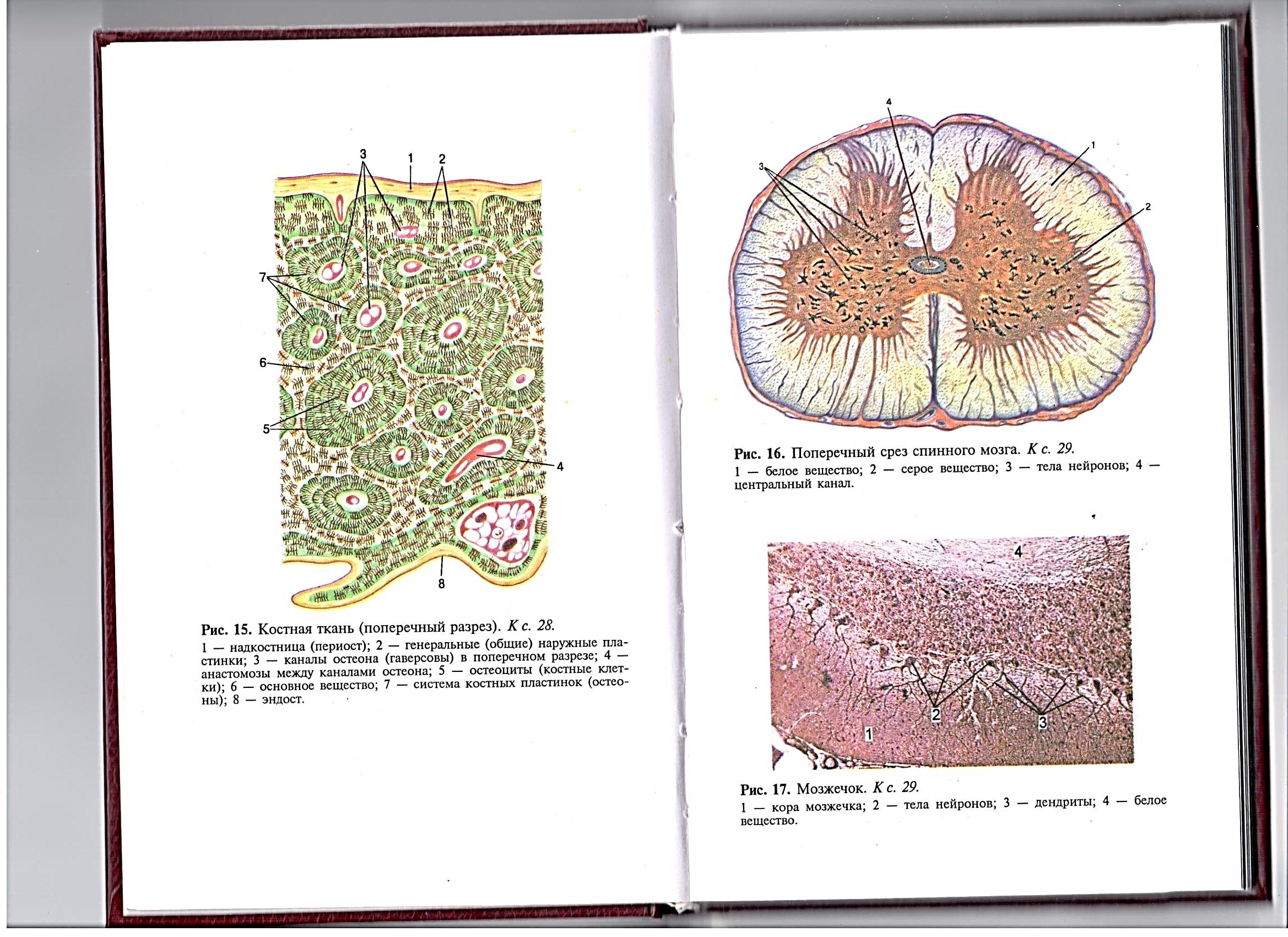
| Рис.12. Мозжечок 1-кора мозжечка; 2-тела нейронов; 3-дендриты; 4-белое вещество. |
Контроль итогового уровня знаний. Подчеркнуть правильные ответы.
1. Кубический эпителий встречается в: а) коже; б) тонком кишечнике;
в) толстом кишечнике; г) почечных канальцах; д) роговице глаза.
2. Костная ткань состоит из: а) остеоцитов; б) коллагеновых волокон; в) остеобластов; г) хондроцитов; д) эластических волокон.
3. Гистиоциты – это клетки: а) хрящевой ткани; б) костной ткани; в) эпителиальной ткани; г) соединительной ткани; д) нервной ткани.
4. Отмершие безъядерные клетки входят состав: а) цилиндрического эпителия; б) многослойного ороговевающего эпителия; в) многослойного неороговевающего эпителия; г) переходного эпителия; д) железистого эпителия.
5. Железистая ткань – это разновидность: а) собственно соединительной ткани; б) соединительной ткани со специальными свойствами; в) эпителиальной ткани; г) мышечной ткани; д) нервной ткани.
Тема: Биология развития. Качественные отличия живого от неживого. Особенности организации живой материи во времени и пространстве. Клеточная теория строения живых организмов. Деление клетки – 2 часа
Общая цель. Раскрыть содержание определения жизни как особой, высшей формы существования материи: ознакомления с жизненным циклом клетки и одним из видов клеточного деления (митозом).
Конкретные цели
1. Уметь показать, что качественные особенности живой материи заключаются в более сложной организации, упорядоченности во времени и пространстве по сравнению с неживой.
2. Уметь охарактеризовать различные виды деления клетки (равномерное бинарное деление прокариотических клеток, амитоз эукариотических клеток, митоз и мейоз).
3. Уметь охарактеризовать жизненный цикл клетки и митотический цикл клетки.
4. Уметь охарактеризовать фазы митоза и раскрыть его биологическое значение.
Мотивационная характеристика. Обмен веществ и деление клетки составляют основу жизнедеятельности организма. Нарушения этих процессов приводит к заболеванию или гибели структур живой системы. Знание особенностей обмена веществ и деление клеток позволяет понять механизмы возникновения и особенности течения многих заболеваний и найти оптимальные способы их лечения.
Аудиторная работа
Содержания. Изучить: 1) митоз в клетках корешка лука; 2) митотический цикл клетки.
Оборудование . 1. Таблицы: схема митотического цикла клетки, схема митоза клетки, схема равномерного бинарного дробления прокариотической клетки. 2. Макропрепараты: митоз в клетках корешка лука.
ХРОМОСОМНЫЙ УРОВЕНЬ
Рис. 18. Яичник млекопитающего
1-оболочка; 2-соединительнотканная строма; 3-примординальные фолликулы; 4-вторичные фолликулы; 5-третичный зрелый фолликул (гаафов пузырек); 6-фолликулярная жидкость; 7-овоцит; 8-тека фолликулов; 9-яйценосный бугорок; 10-желтое тело.
Сравните величину яйцеклетки и других клеток яичника.
Контроль итогового уровня знаний. Подчеркнуть правильные ответы.
1.Кроссинговер происходит в: а) профазе II; б) анафазе I; в) профазе I; г) метафазе I; д) телофазе I.
2.Набор хромосом и ДНК в сперматоците 1-го порядка: а) n 2c; б) 2n 2c; в) 2n 4c; г) 4n 4c; д) n c.
3.Набор хромосом и ДНК в овоците: а) 2n 4c; б) n 2c; в) 4n 4c; г) n c; д) 2n 2c.
4.В сперматогенезе мейоз происходит в период: а) созревания; б) роста; в) оплодотворения; г) формирования; д) размножения.
5. В телофазе митоза растительной клетки происходят: а) деспирализация наследственного материала; б) цитокинез из центра клетки; в) образование ядерной мембраны; г) цитокинез из периферии клетки; д) спирализация наследственного материала.
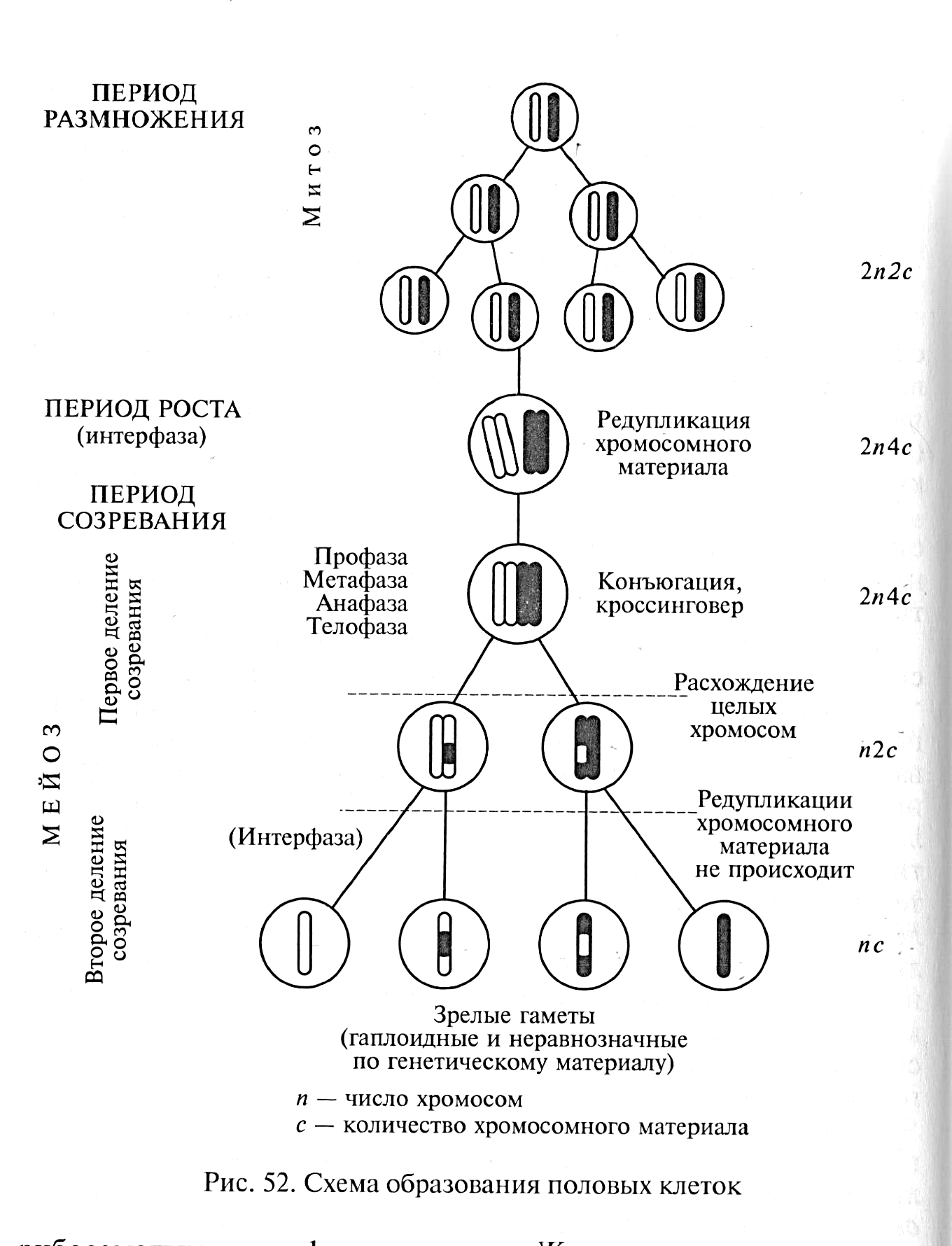
Рис. 19. Схема образования половых клеток.
Стадия гаструлы
| Рис. 26. Гаструлирующий зародыш амфибии 1 – бластопор; 2 – колбовидные клетки. |

Рис. 27. Ход гаструляции у зародыша амфибий:
1 – эктодерма; 2 – мезодерма; 5 – энтодерма; I – ранняя гаструла с крупным бластоцелем (4), начало инвагинации под губой бластопора (3); II– средняя гаструла: развивающаяся полость первичной кишки (6) вытесняет бластоцель; III – поздняя гаструла: мезодерма со срединной закладкой хорды (11) в виде крыши первичной кишки (6) постилает эктодерму (7), полость первичной кишки соответствует полости сформированного гастроцеля (10), спереди - просвет головной кишки (9), из области замкнутого бластопора (8) идет инвагинация мезодермы (2), бластоцель полностью вытеснен; поверхность зародыша покрыта только эктодермой.
Стадия нейрулы
| Рис. 28. Поперечный срез зародыша лягушки на стадии нейрулы: 1-нервная трубка; 2-хор-да; 3-сомит; 4 – боковая пластинка мезодермы; 5-просвет кишечника; 6- ганглиозная пластинка. |
 В результате интенсивного размножения клеток некоторых отделов зародыш постепенно принимает удлиненную форму. Взаимодействие хордомезодермы с лежащей над ним эктодермой приводит к формированию полой нервной трубки. Действие, посредством которого хордомезодерма инициирует развитие нервной трубки из эктодермы – первичная эмбриональная индукция, а клеточный ответ на индукцию – нейруляция.
В результате интенсивного размножения клеток некоторых отделов зародыш постепенно принимает удлиненную форму. Взаимодействие хордомезодермы с лежащей над ним эктодермой приводит к формированию полой нервной трубки. Действие, посредством которого хордомезодерма инициирует развитие нервной трубки из эктодермы – первичная эмбриональная индукция, а клеточный ответ на индукцию – нейруляция.
На препарате поперечного среза зародыша на стадии поздней нейрулы (рис. 28.) найдите очертания нервной трубки с каналом внутри нее (нейроцель), нервная трубка погружена под эктодерму.
Под нервной трубкой хорошо заметны контуры хорды с радиально расположенными ядрами клеток. По обе стороны от этих образований видны сомиты, щелевидная полость – вторичная полость тела, или целом. Из эктодермы образуются покровный эпителий, нервная система и органы чувств; из энтодермы - эпителий кишечника, пищеварительные железы, легкие; из мезодермы – скелет, мышцы, кровеносная система, выделительные органы, половая система.
! Зарисуйте основные стадии эмбрионального развития лягушки.
Просмотр фильма: «Метаморфоз амфибий».
Вопросы для повторения и обсуждения
1. Что вы понимаете под ростом и развитием организмов? Какова связь между ростом и дифференциацией клеток?
2. В чем заключаются молекулярные основы дифференцировки клеток?
3. Сформулируйте понятие онтогенеза и назовите периоды онтогенеза?
4. Какова разница между прямым и непрямым развитием?
5. Каким образом оплодотворенная яйцеклетка развивается в многоклеточную структуру?
6. Какие факторы влияют на продолжительность жизни?
Контрольные задания
1. Как вы прокомментируете высказывание: в построении любого органа или части организма принимают участие производные нескольких зародышевых листков?
2. Какие факты подтверждают, что развивающийся зародыш представляет собой целостную систему?
Познакомьтесь с личиночным типом онтогенеза (рис. 39.) на примере майского жука и бурой лягушки. Какие стадии метаморфоза обозначены цифрами 1-4 для А и 1-7 для Б? Чем эти стадии отличаются друг от друга?
3. В лаборатории были выращены лягушки из неоплодотворенных яиц (путем партеногенеза). Эти животные будут сильнее или слабее, чем обычные лягушки того же самого биологического вида? В чем конкретно могут проявиться различия между этими лягушками?
А Б

Рис. 32. Метаморфоз у животных
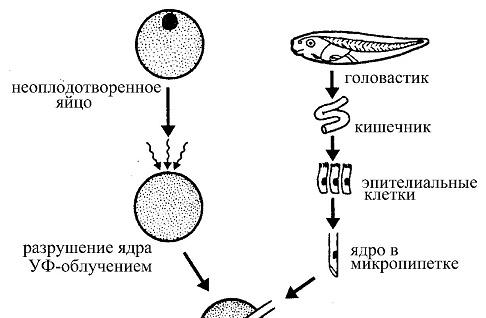 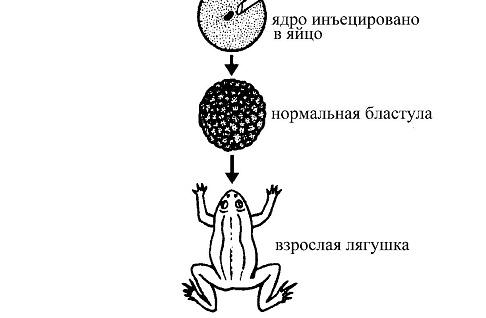 Рис. 33. Развитие взрослой лягушки из яйцеклетки, ядро которой заменено ядром из соматической клетки кишечного эпителия головастика
Рис. 33. Развитие взрослой лягушки из яйцеклетки, ядро которой заменено ядром из соматической клетки кишечного эпителия головастика
|
6.Проанализируйте процесс опыления и двойного оплодотворения у цветковых растений (рис. 34). Установите пра-вильную последовательность следующих событий: второй спермий сливается с крупной диплоидной центральной клеткой (образуется триплоидная клетка); пыльцевое зерно попадает на рыльце пестика (опыление); после оплодотво-рения начинается процесс формирования семени и плода; первый спермий сливается с яйцеклеткой (образуется зигота); из вегетативной клетки пыльцевого зерна образуется пыльцевая трубка. Что обозначено цифрами 1-6? Назовите части семени (7-9), которые образуются в результате двойного оплодотворения из клеток 4, 5, 6 (рис. 34).
8.Зародыш многоклеточного животного в своем развитии как бы повторяет этапы развития своих предков. Например, зародыш млекопитающего в ходе эмбрионального развития как бы проходит стадии развития одноклеточных, двухслойных, трехслойных. Используя рис. 35. объясните данное явление.
9. Назовите стадии развития зародыша, представленные на рис. (36. - I, II, III). Что обозначено цифрами 1-7? Охарактеризуйте каждую стадию эмбриогенеза. На какой стадии происходит дифференцировка клеток? Сколько зародышевых листков образуется у эмбрионов позвоночных животных?
Рис. 34. Схема двойного оплодотворения цветкового растения
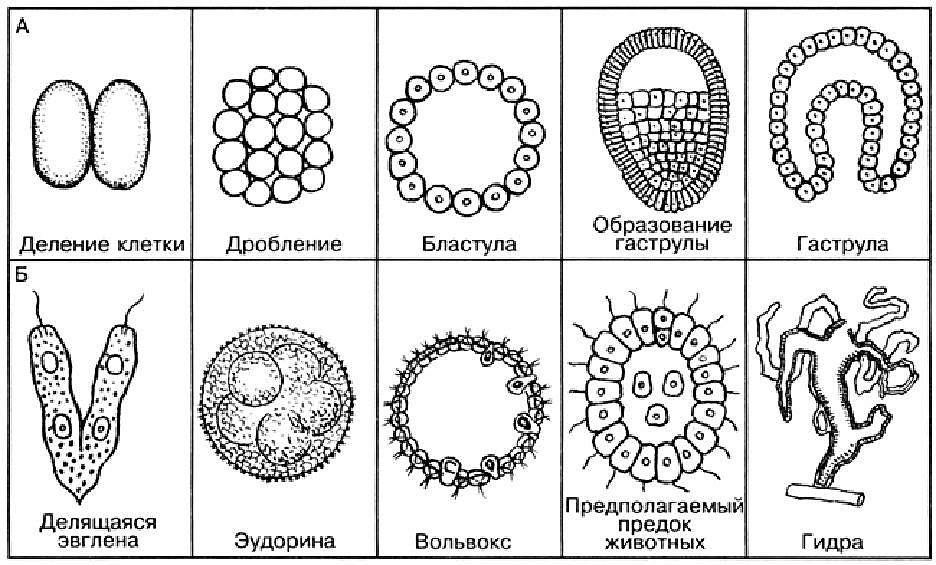
Рис. 35. Стадии развития многоклеточных животных (А); организмы, организация которых соответствует определенной стадии развития зародышей (Б)
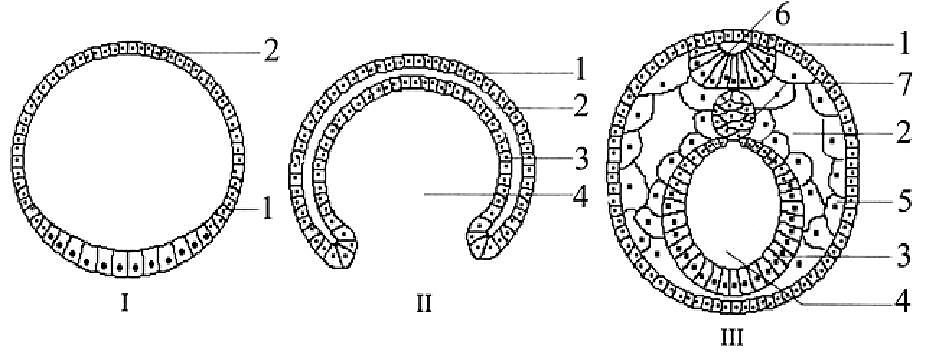
Рис. 36. Стадии развития зародыша
Тема: Популяционно - видовой уровень организации Эволюция органического мира, факторы эволюционного процесса: наследственная изменчивость, свойственный отбор, дрейф генов, изоляция, миграция особей, борьба за существование. Видообразование и макроэволюционные процессы. Вид. Критерии вида. Видообразование. Основные направления эволюционного процесса.
Органическая эволюция – объективный процесс.
Популяция – элементарная эволюционная единица. Основные характеристики популяции как эколого-генетической системы (популяционный ареал, численность особей в популяции, возрастной состав, половой состав, основные морфо-физиологические характеристики популяции, генетическая гетерогенность популяции, генетическое единство популяции). Мутации разных типов – элементарный эволюционный материал. Генетические процессы в популяциях. Элементарное эволюционное явление.
Элементарные факторы эволюции. Мутационный процесс. Популяционные волны. Изоляция. Генетико-автоматические процессы. Естественный отбор.
Формирование адаптаций – результат действия естественного отбора. Классификация и механизм возникновения адаптаций. Относительный характер адаптаций.
Вид – основной этап эволюционного процесса. Понятие, критерии и структура вида. Видообразование – результат микроэволюции. Основные пути и способы видообразова-ния.
Закономерности макроэволюции. Эволюция онтогенеза (целостность и устойчивость, эмбрионизация и автономизация онтогенеза, онтогенез – основа филогенеза). Эволюция филогенетических групп (формы филогенеза, главные направления эволюции, вымирание групп и его причины). Эволюция органов и функций. Эволюционный прогресс.
Происхождение и эволюция человека.
Органическая эволюция – объективный процесс
Контрольные задания
1. Одним из доказательств эволюции является единство органического мира, в котором существует ряд организмов, занимающих промежуточное положение между крупными систематическими группировками, – переходные формы. На рисунке 55 представлены некоторые из ныне существующих переходных форм организмов. Познакомьтесь с данными организмами и укажите в их строении признаки разных типов организации.

Рис. 55. Ныне существующие переходные формы:
 1 – мечехвост, занимающий промежуточное положение между современными типичными членистоногими и ископаемыми трилобитами; 2 – перипатус, несущий признаки членистоногих и кольчатых червей; 3 – эвглена, соединяющая признаки животных и растений; 4 – личинка мечехвоста, похожая на личинку трилобитов; 5– ползающий гребневик соединяет в себе наравне с признаками кишечнополостных животных признаки плоских червей
1 – мечехвост, занимающий промежуточное положение между современными типичными членистоногими и ископаемыми трилобитами; 2 – перипатус, несущий признаки членистоногих и кольчатых червей; 3 – эвглена, соединяющая признаки животных и растений; 4 – личинка мечехвоста, похожая на личинку трилобитов; 5– ползающий гребневик соединяет в себе наравне с признаками кишечнополостных животных признаки плоских червей
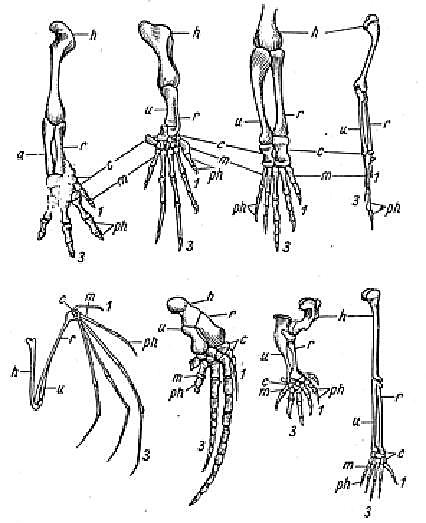
2. Скелет конечностей амфибий, рептилий, птиц и млекопитающих, несмотря на довольно крупные различия во внешнем виде конечностей и выполняемой ими функции, оказывается построенным сходно (рис. 56). О чем свидетельствует сходство в строении конечностей, несущих весьма различные функции, у позвоночных?
Рис. 56. Гомология передних конечностей позвоночных
(саламандра, морская черепаха, крокодил, птица, летучая мышь, кит, крот, человек) гомологичные части обозначены одинаковыми буквами и цифрами.
3. В строении практически любого организма можно найти органы или структуры, сравнительно недоразвитые и утратившие былое значение в процессе филогенеза, – это рудиментарные органы. На рис. 57 представлены рудиментарные задние конечности питона, едва заметные выросты рудименты крыльев у киви, рудименты тазовых костей китообразных. О чем свидетельствуют данные органы?
Рис. 57. Примеры рудиментарных органов
(А-задние конечности питона; Б-крыло киви; В-элементы тазового пояса гладкого кита)
4. Среди животных одной из наиболее ярких реликтовых форм является гаттерия – единственный представитель целого подкласса рептилий (рис. 58). В ней отражены черты рептилий живших на Земле в мезозое. Другой известный реликт – кистеперая рыба латимерия, сохранившаяся малоизмененной с девона.Среди растений реликтом может считаться гинкго. Облик этого растения дает представление о древесных формах, вымерших в юрском периоде. О чем свидетельствуют реликтовые формы?
Рис. 58. Реликтовые организмы
1-гаттерия; 2-латимерия; 3-опоссум; 4-гинкго.
5. В пользу существования родства систематических групп животных служат ископаемые переходные формы. Заполните таблицу 2, указав некоторые признаки первоптиц в сравнении с рептилиями и настоящими птицами.
Таблица 2.
И настоящих птиц
| Системы органов и жизненные процессы | Рептилии | Археоптерикс | Настоящие птицы |
| Чешуя | |||
| Перья | |||
| Передние конечности | |||
| Наличие зубов | |||
| Хвостовые позвонки | |||
| Сердце | |||
| Способность к полету | |||
| Образ жизни | |||
| Размножение |
6. Можно ли считать археоптерикса переходной формой между классом рептилий и настоящих птиц и почему? Какое значение имеет археоптерикс для доказательства эволюции органической природы (рис. 59)?
Рис. 59. Отпечатки костей скелета и перьев археоптерикса
Перечислите известные Вам переходные формы. Почему промежуточные формы не дают достаточных доказательств эволюции?
7. Зародыши птиц на ранних стадиях эмбрионального развития выделяют в качестве конечного продукта азотистого обмена аммиак, на более поздних мочевину, а на последних стадиях развития – мочевую кислоту. Сходным образом у головастиков лягушек конечным продуктом обмена является аммиак, а у взрослых амфибий – мочевина. Как объяснить данные факты?
8. Изучение эмбрионального развития высших, наземных позвоночных показало, что у них закладываются и достигают известного уровня развития некоторые органы, не имеющие у взрослого животного никакого значения, но вполне сходные с органами, характеризующими взрослых рыб. Рассмотрите рисунок 60 и ответьте, о чем свидетельствует факт закладки частей жаберного аппарата у зародышей наземных позвоночных?
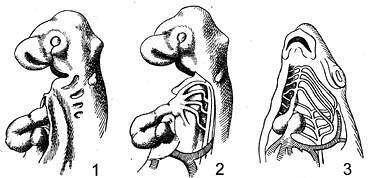
Рис. 60. Сравнение закладки жаберного аппарата у зародыша курицы с жаберным
аппаратом костистой рыбы:
1 – жаберные щели зародыша курицы; 2 – то же с удаленными покровами, видны артериальные дуги, идущие по жаберным дугам между жаберными щелями; 3 – артериальные дуги костистой рыбы
9. Как можно доказать объективность процесса эволюции жизни на Земле?
10. Перед вами находится лошадь, мышь, черепаха, бабочка, сосна. Какими методами наиболее надежно можно установить родство этих форм?
Маскировка
| Вид насекомого | Окраска тела | Окраска среды | Тип окраски |
| Серый усач | |||
| Крапивница | |||
| Жужелица черная | |||
| Пяденица Березовая | |||
| Лимонница |
Таблица 4.
Демонстрация
| Вид насекомого | Окраска тела | Окраска среды | Тип окраски |
| Божья коровка | |||
| Оса обыкновенная | |||
| Щавелевый клоп | |||
| Павлиний глаз | |||
| Шмель полевой |
Работа 2. Коадаптивная эволюция насекомых-опылителей.
Пользуясь определителями, определите насекомых, познакомьтесь с морфологической характеристикой насекомых следующих отрядов: жесткокрылые, чешуекрылые, двукрылые, прямокрылые, перепончатокрылые, стрекозы и полужесткокрылые. Обратите внимание на строение ротового аппарата и на опушенность тела. Установите участие насекомых в опылении растений. Заполните таблицу 5. Какое значение в опылении растений имеет опушенность тела насекомого? Какие связи с растениями исторически обусловили особенности строения ротовых частей и других приспособлений у насекомых?
Таблица 5.
Занятие 11
Биотические факторы среды
Помимо абиотических воздействий живые организмы испытывают на себе и влияние друг друга. Определяющими факторами в этом отношении являются видовое разнообразие сообщества и численность популяций, образующих биоценоз.
Видовое разнообразие биоценозов. Каждый живой организм живет в окружении множества других, вступая с ними в самые разнообразные отношения как с положительными так и с отрицательными для себя последствиями. Связь с другими организмами обеспечивает питание и размножение, возможность защиты, смягчает неблагоприятные условия среды. В то же время биотическое окружение- это и опасность ущерба или гибели.
Задание 1. Приведите примеры взаимоотношений видов биоценозе:
а) отрицательные (антагонистические): _______________________
б) положительные (симбиотические):_______________________
Задание 2. Раскройте понятия «абиотические факторы», «биотические факторы», «антропогенные факторы», приведите примеры. Рассмотрите рис. 1, дайте определения терминам «оптимум», «экологическая валентность», «экологический спектр вида», приведите примеры стенобионтных и эврибионтных видов растений и животных.
Абиотические факторы__________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
Биотические факторы___________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
Антропогенные факторы_________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
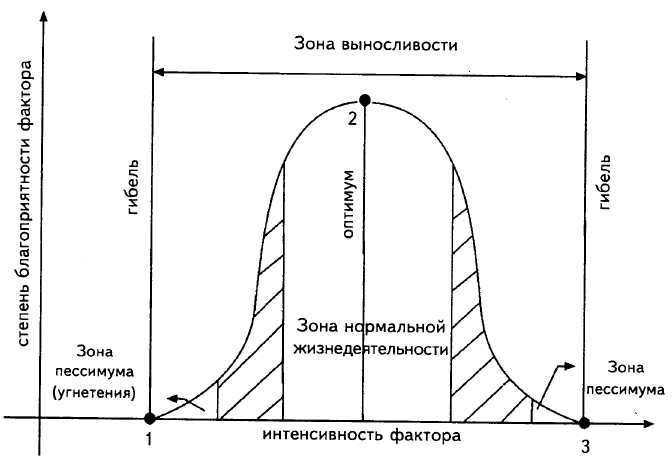
Рис. 1. Общая схема действия экологического фактора на живой организм
1 – точка минимума; 2 – точка оптимума; 3 – точка максимума
Оптимум__________________________________________________________________________________________________________________________________________________
Экологическая валентность ______________________________________________________
_____________________________________________________________________________
Экологический спектр вида ______________________________________________________
_____________________________________________________________________________
Стенобионты,Эврибионты ____________________________________________________
__________________________________________________________________________________________________________________________________________________________
Задание 2. Сформулируйте основные закономерности, присущие действию экологичес-ких факторов на живые организмы.
Закон лимитирующих факторов (Блэкман, 1909)____________________________________
__________________________________________________________________________________________________________________________________________________________
Закон толерантности (Шелфорд, 1913)____________________________________________
Закон неоднозначного действия фактора на различные функции организма ____________
__________________________________________________________________________________________________________________________________________________________
Закон (эффект) компенсации факторов (Рюбель, 1930)_______________________________
_____________________________________________________________________________
_____________________________________________________________________________
Закон незаменимости фундаментальных факторов (Вильямс, 1949) __________________
_____________________________________________________________________________
_____________________________________________________________________________
Закон совокупного действия факторов _____________________________________________
__________________________________________________________________________________________________________________________________________________________
Правило экологической индивидуальности (Раменский, 1924) _________________________
__________________________________________________________________________________________________________________________________________________________
Правило взаимодействия факторов _______________________________________________
__________________________________________________________________________________________________________________________________________________________
Задание 3. Изучить схему соотношения типов питания в экосистеме (см. рисунок).

Задание 4. На рис. экологической пирамиды рассмотреть и зарисовать правило 10 % перехода энергии и вещества с одного трофического уровня на следующий, как определенную экологическую закономерность.
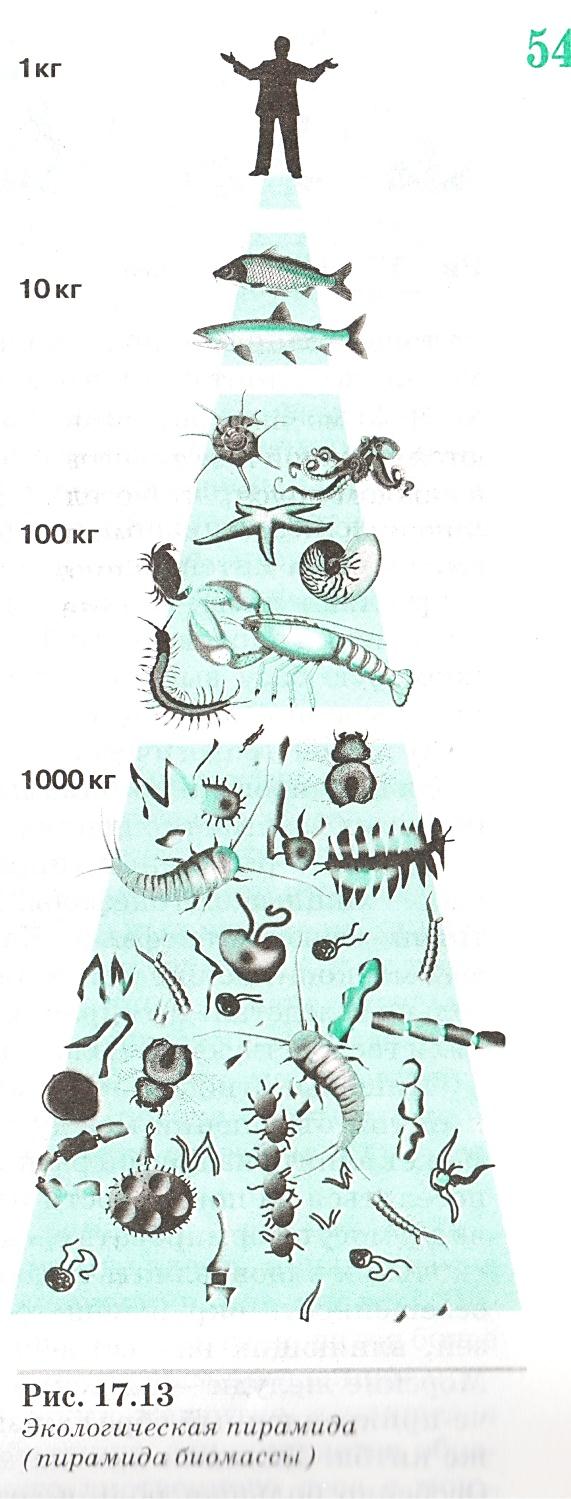
Рис. Экологическая пирамида (пирамида биомассы)
Контрольные вопросы
1. Дайте определение понятию «экологический фактор». 2. Определите понятие «оптимум экологического фактора». 3. Приведите примеры приспособлений живых организмов к чрезмерному действию абиотических факторов среды.
Состав биогеоценоза
Все виды, составляющие биоценоз, взаимодействуя с физическими факторами среды (т.е. образуя биогеоценоз), осуществляют круговорот веществ, при этом каждый вид имеет свою функцию в системе круговорота. Какие же формы участия в круговороте присущи разным видам сообщества?
Выделим сначала составные части биогеоценоза:
климатический режим (температура, влажность, освещенность и другие факторы, создающие физические условия существования организмов);
химическая среда обитания (наличие минеральных солей, дефицит или избыток отдельных химических элементов, а также органических веществ – жиров, белков, углеводов и др.);
продуценты – автотрофные организмы, главным образом зеленые растения (а также хемосинтезирующие организмы), образующие органические вещества из неорганических, т.е. создающие новое органическое вещество в дополнение к уже имеющемуся; продуценты определяют биологическую продуктивность биоценоза;
консументы – гетеротрофные организмы, растительноядные и плотоядные, потребляющие готовое органическое вещество в форме живых организмов;
редуценты и детритофаги – гетеротрофные организмы, которые разрушают мертвые остатки растений и животных и превращают их в простые химические соединения (вода, диоксид углерода, аммиак, метан, сероводород и др.).
Проанализируем роль (или значимость) каждой из перечисленных групп живых организмов в биоценозах.
Продуценты. Суммарная продукция фотосинтеза называется первичной продукцией. За 1 год зеленые растения планеты образуют 170-180 млрд т нового сухого органического вещества. Биологическая продуктивность различных биоценозов неодинакова (рис. 61) В тропическом дождевом лесу синтезируются 2200 г сухого растительного вещества на 1 м2 в год, в лесах умеренного пояса – 1250, тайга дает 800, а сельскохозяйственные угодья – 650 г на 1м2 в год. Для сравнения укажем, что в такой бедной климатической зоне, как тундра образуется 140г вещества, а в открытом океане – всего лишь 125 г на 1м2. Объясняется это тем, что в океане биогенные элементы рассеяны в толще и труднодоступны. Более продуктивна область континентального шельфа, куда вместе с речным стоком поступают биогенные элементы.

Рис. 61.Площадь поверхности и годовая продукция экосистем
Консументы. Растительноядные организмы носят название первичных консументов, или консументов первого порядка. Хищники, пищей которым служат растительноядные организмы, - это консументы второго порядка, более крупные хищники – консументы третьего порядка и т.д. Ряд взаимосвязанных видов, из которых каждый предыдущий служит пищей последующему, носит название цепи питания. Пищевая цепь, или цепь питания, - это перенос энергии от растения через ряд организмов путем поедания одних видов другими. Через цепи питания реализуются трофические связи между видами. Разные уровни питания в экологической системе называют трофическими уровнями. В основе цепи питания (первый трофический уровень) всегда лежат зеленые растения – продуценты. Второй уровень – первичные консументы (растительноядные животные), третий – вторичные консументы (плотоядные животные, поедающие растительноядных) и т.д.
| |
| Рис. 62. Экологическая пирамида |
В силу того, что хищники за немногими исключениями в пищевом отношении неспециализированы, в реальных условиях цепи питания могут
перекрещиваться, образуя сети питания (рис. 169). Общая закономерность состоит в том, что в начале пищевой цепи находятся зеленые растения, в конце – крупные хищники.

Рис. 63. Сети питания
Редуценты и детритофаги. Редуценты (от лат. reducentis – возвращающий, восстанавливающий), или деструкторы, - это организмы (главным образом бактерии и грибы), разлагающие мертвый органический материал до диоксида углерода, воды и других неорганических соединений. Детритофаги – это животные, потребляющие мертвый материал (экскременты животных, отмершие части их тела: личиночные покровы насекомых, старая кожа змей, рога копытных, перья птиц, опавшие листья деревьев и т.п.). Они играют завершающую и очень важную роль в круговороте веществ, осуществляемом биоценозом.
Тела погибших растений и животных и другой мертвый органический материал разлагаются поэтапно. Вначале на мертвом субстрате поселяются бактерии и грибы, способные к усвоению легкорастворимых сахаров, затем в процесс разложения вступают микроорганизмы, специализирующиеся на расщеплении целлюлозы, лигнина и сложных белков. Измельчают и частично перерабатывают органические остатки животные – детритофаги. Сюда входят простейшие, круглые черви, почвенные клещи, ногохвостки. Экскременты крупных детритофагов – мокриц, многоножек, дождевых червей, улиток и слизней, личинок мух и жуков представляют собой питательную среду для бактерий и грибов. Детритофаги широко представлены в наземных местообитаниях и достигают высокой численности. Так, в лесах умеренной зоны на 1м2 почвы можно обнаружить до 1000 видов животных, при этом численность простейших и мелких круглых червей может достигать 10 млн, ногохвосток и почвенных клещей - 100 тыс., других беспозвоночных – около 50 тыс. Скорость разложения определяется главным образом температурой среды и влажностью.
МИТОЗ
митоз - это непрямое деление клетки
| количество хроматид и хромосом | события | морфологическая картина | |
М И Т О З
46 хромосом;
92 хроматиды
(по 2 хроматиды в каждой хромосоме)
по 46 хроматид в каждой дочерней клетке
ИНТЕРФАЗА (это уже не митоз, а промежуток до следующего митоза)
Следующий митоз
МЕЙОЗ
мейоз - это деление половых клеток
ОСОБЕННОСТИ
· происходит только в половых клетках
· состоит из двух последовательных делений с короткой интерфазой между ними
· профаза первого деления очень сложная и состоит из 5 стадий
· в зигонему профазы первого деления происходит соединение гомологичных хромосом (биваленты или тетрады), которые остаются связанными между собой до анафазы первого деления
· в анафазу первого деления происходит разделение и расхождение к полюсам целых хромосом, состоящих из двух хроматид, а не разделение хромосом на отдельные хроматиды, как в митозе
· в интерфазу между первым и вторым делениями мейоза отсутствует S-период и перед вторым делением не происходит редупликации ДНК
· в процессе мейоза образующиеся дочерние клетки полностью не разделяются между собой, а остаются связанными тонкими цитоплазматическими мостиками
|
| количество хроматид и хромосом | события | морфологическая картина | ||
ИНТЕРФАЗА
G1-период
клетка имеет присущую ей форму, имеет ядро, в ядре выявляется хроматин в виде точек, зерен, глыбок; как правило, имеется ядрышко
S-период
G2-период
М Е Й О З
Первое
деление
п
р
о
ф
а
з
а
23 бивалента, каждый из которых состоит из 2 хромосом; всего - 46 хромосом;
92 хроматиды (46х2; по 2 хроматиды в каждой хромосоме)
в ядре имеются толстые нити, расположенные неупорядоченно
Метафаза
Анафаза
по 23 хромосомы в каждой дочерней клетке (каждая хромосома состоит из 2 хроматид, всего - 46 хроматид
Телофаза
Интерфаза
G1-период
S-период
Второе деление
Профаза
23 хромосомы; 46 хроматид (по 2 хроматиды в каждой хромосоме)
Метафаза
Анафаза
по 23 хроматиды (гаплоидный набор) в каждой дочерней клетке
Телофаза
Рис. 21. Кариотип Зубра (2n= 60)
Рис. 22. Кариотип яка (2 n = 60)
Рис. 23. Кариотип домашней свиньи (2 n =38)
Рис. 24. Кариотип домашней овцы (2 n =54)
(каракульская порода)
Рис. 25. Кариотип муфлона (2 n =54)
Рис. 26. Кариотип аргали (2 n =56)
Рис. 27. Кариотип бухарского уриала (2 n =58)
Рис. 28. Кариотип Эльбрусского барана (гибрид) (2 n =55)
Рис. 29. Кариотип овцебыка (2 n =48)
Рис. 30. Кариотип домашнего кролика (2 n =44)
Рис. 31. Кариотип нутрии (2 n =40)
Рис. 32. Кариотип домашней собаки (2 n =78)
Рис. 33. Кариотип домашней кошки (2 n =38)
Рис. 34. Кариотип стерляди (2 n =60)
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
« ДОНЕЦКИЙ НАЦ И ОНАЛЬН Ы Й УН И ВЕРСИТЕТ »
БИОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
ОБЩАЯ БИОЛОГИЯ
(Руководство к лабораторным занятиям для студентов 1-го курса специальности 06.03.01 Биология)
Донецк 2018
Составители: Е.Н. Маслодудова канд. биол. наук, доцент
Е.В. Сухинина ст. лаборант
Руководство к лабораторным занятиям написано в соответствии с программой курса Общая биология для студентов университетов, обучающихся по специальности «Биология».
Руководство охватывает все разделы дисциплины и дает отчетливое представление о развитии органического мира. В пособие собраны различные задания, упражнения, вопросы для размышлений, таблицы и схемы для заполнения и сравнения.
Каждое занятие содержит краткую теоретическую справку, перечень необходимого оборудования, методические указания к выполнению работы.
В пособии уделено внимание культивированию простейших в лаборатории как первой ступени подготовки исследователя в области биологии.
| № п/п | Название темы |
| 1 | Устройство световых микроскопов. Правила пользования микроскопом. Техника микроскопирования. - 2часа |
| 2 | Простейшие. Культивирование в лаборатории Составление схем поэтапной работы создания культуры простейших. -4 часа |
| 3 | Методы культивирования саркодовых в лаборатории. -2 часа |
| 4 | Методы культивирования жгутиконосцев в лаборатории. -2 часа |
| 5 | Методы культивирования инфузорий в лаборатории. Изготовление временных и постоянных препаратов. –6 час. |
| Модульный контроль - 2 часа | |
| 6. | Онтогенетический уровень организации жизни Биология клетки . Эукариотическая клетка. Многообразие клеток и тканей животных и человека - 4 часа |
| 7. | Биология развития. Качественные отличия живого от неживого. Особенности организации живой материи во времени и пространстве. Клеточная теория строения живых организмов. Деление клетки – 2 часа |
| 8. | Индивидуальное развитие организмов Размножение. Формы размножения организмов и их цитологические основы. Этапы и морфология. Гаметогенез. Мейоз. Органогенез. - 4 часа. |
| 9. | Популяционно - видовой уровень организации Эволюция органического мира, факторы эволюционного процесса: наследственная изменчивость, свойственный отбор, дрейф генов, изоляция, миграция особей, борьба за существование. Видообразование и макроэволюционные процессы. Вид. Критерии вида. Видообразование. Основные направления эволюционного процесса. Пути достижения биологического прогресса- 2 часа |
| 10 | Биогеоценотический уровень организации . Цепи питания. Свойства и типы, характеристика биогеоценозов. . Биогенные круговороты углерода, азота, воды – 2 часа |
| Всего -32 часа |
ЗАНЯТИЕ 1 (2 часа)
ТЕМА: Устройство световых микроскопов. Правила пользования микроскопом. Техника микроскопирования.
Методы культивирования простейших. -2часа
ЦЕЛЬ: Ознакомиться с устройством микроскопа МБР-1, с правилами микроскопирования и методами изготовления временных микропрепаратов, а также с другими марками микроскопов – МБИ-3, МБС-1.
СОДЕРЖАНИЕ:
1. Изучение устройства микроскопа МБР-1.
2. Правила работы с микроскопом МБР-1.
3.Изготовление временных препаратов простейших.
МАТЕРИАЛ И ОБОРУДОВАНИЕ: микроскопы МБР-1, МБИ-3, МБС-1, чашки Петри, предметные и покровные стёкла, пипетки, стаканчики с водой, пинцеты глазные, препаровальные иглы, марлевые салфетки, вата, крылья бабочек.
Таблицы: устройство микроскопа, порядок оформления лабораторных работ.
НОВАЯ ТЕРМИНОЛОГИЯ: макровинт, микровинт, конденсор, тубус, оптическая ось, окуляр, объектив, предметный столик, фокусное расстояние, временный препарат.
Работа 1. Устройство микроскопа МБР-1.
Рассмотрите основные части микроскопа МБР-1: механическую, оптическую и осветительную (рис. 1).

.
Рис. 1. Микроскоп МБР-1:
1 - основание (штатив); 2 - тубусодержатель; 3 - тубус; 4 - предметный столик; 5 - отверстие предметного столика; 6 - винты, перемещающие столик; 7 - окуляр; 8 - револьвер; 9 - объектив; 10 - макрометрический винт; 11 - микрометрический винт; 12 - конденсор; 13 - винт конденсора; 14 - диафрагма; 15 - зеркало
К механической части относятся: штатив, предметный столик, тубус, револьвер, макро- и микрометрический винты. Оптическая часть микроскопа представлена окулярами и объективами. Осветительная система микроскопа состоит из зеркала, конденсора и диафрагмы.
Зарисуйте устройство микроскопа.
Работа 2. Правила работы с микроскопом МБР-1.
1. Поставьте микроскоп штативом к себе, предметным столиком от себя.
2. Приведите в рабочее положение объектив малого увеличения. Для этого поворачивайте револьвер до тех пор, пока нужный объектив не займёт срединное положение по отношению к тубусу и предметному столику (встанет над отверстием столика). Когда объектив занимает срединное (центрированное) положение, в револьвере срабатывает специальное устройство-защёлка. При этом слышится лёгкий щелчок и револьвер фиксируется. Запомните, что изучение любого объекта начинается с малого увеличения.
3.Поднимите с помощью макровинта объектив над столиком примерно на 0,5 см.
4.Конденсор поднимите вплотную к столику. Откройте диафрагму.
5. Глядя в окуляр (левым глазом!), вращайте зеркало в разных направлениях до тех пор, пока поле зрения не будет освещено ярко и равномерно.
6. Положите на предметный столик препарат покровным стеклом вверх, чтобы объект находился в центре отверстия предметного столика.
7. Переведите глаз с окуляра на объектив и медленно опустите тубус с помощью макровинта, чтобы объектив находился на расстоянии около 2 мм от препарата.
8. Смотрите в окуляр и одновременно медленно поднимайте тубус с помощью кремальеры до тех пор, пока в поле зрения не появится изображение объекта (запомните, что фокусное расстояние для малого увеличения равно 0,5 см).
9. Для того чтобы перейти к рассмотрению объекта при большом увеличении микроскопа, прежде всего, центрируйте препарат, т.е. поместите объект или ту его часть, которую вы рассматриваете, в самый центр поля зрения. Для этого, глядя в окуляр, передвигайте препарат руками, пока объект не займёт нужного положения. Если объект не будет центрирован, то при большом увеличении он останется вне поля зрения.
10. Вращая револьвер, переведите в рабочее положение объектив большого увеличения.
11. Глядя в микроскоп, слегка и очень осторожно опускайте тубус поворотом микровинта по часовой стрелке.
12. Для тонкой фокусировки используйте микрометрический винт.
13. При зарисовке препарата смотрите в окуляр левым глазом, а в альбом – правым.
14. Закончив рассмотрение объекта, переведите микроскоп снова на малое увеличение и только затем снимите препарат со столика.
15. Все перечисленные здесь действия в такой же последовательности повторяйте каждый раз при работе с микроскопом.
16. Содержите микроскоп в чистоте: каждый раз при использовании смахивайте с него пыль мягкой кисточкой или мягкой тряпочкой. Не развинчивайте окуляры и объективы. При хранении микроскопа объектив должен стоять на малом увеличении или в нейтральном положении.
17. Микроскоп храните накрытым чехлом.
Работа 3. Изготовление временных препаратов простейших.
Алгоритм изготовления временного микропрепарата
1.Взять предметное стекло за боковые края.
2. Нанести на предметное стекло 1-2 капли живой культуры простейших.
3. Аккуратно под углом, чтобы не было пузырьков воздуха, накрыть материал покровным стеклом.
5. Изучать при малом, а затем при большом увеличении микроскопа.
6. Зарисовать наблюдаемый объект в альбом.
Тема 2. Простейшие. Культивирование в лаборатории Составление схем поэтапной работы создания культуры простейших. -4 часа
Изучение методики промышленного культивирования простейших в курсе «Общая биология»
Курс «Общая биология» в соответствии со стандартом подготовки бакалавров биологии предусматривает лекционные и лабораторные занятия. В рабочую программу дисциплины включено три занятия по теме «Культивирование простейших в лаборатории». Методы, используемые на этих занятиях способствуют формированию приемов, умений и навыков организации поисковой и исследовательской работы, самостоятельной познавательной деятельности, проведения опытов.
Биологическое образование охватывает большой круг естественнонаучных исследований. С развитием биологии представление о биотехнологии менялось.
В компетенцию биотехнологии входит культивирование (разведение) клеток, тканей, организмов в целях практического их использования, основанное на знании общебиологических закономерностей.
Постановка лабораторной культуры, разведение простейших как элемент биотехнологии. способствует вовлечению студентов в процесс познания живой природы, изучению тонких взаимоотношений в биоценозах. Клеточные культуры с каждым годом находят все большее применение в самых разнообразных областях биологии, медицины и сельского хозяйства. Их используют при решении таких общебиологических проблем, как выяснение механизмов дифференцировки и пролиферации, взаимодействия клеток со средой, адаптации, старения, биологической подвижности, злокачественной трансформации и многих других. Важная роль отводится клеточным культурам в биотехнологии при производстве вакцин и биологически активных веществ. Они являются исходным материалом для создания клеток-продуцентов, используются в целях повышения продуктивности сельскохозяйственных животных и для выведения новых сортов растений. Культуры клеток применяются для диагностики и лечения наследственных заболеваний, в качестве тест - объектов при испытании новых фармакологических веществ, а также для сохранения генофонда исчезающих видов животных и растений. Одноклеточные простейшие используются в качестве объектов биологических методов борьбы с загрязнением окружающей среды. Протисты используются как компонент активного ила при биологической очистке сточных вод
В настоящее время зоокультура беспозвоночных перспективна в разных направлениях: в частности, есть опыт культивирования свободноживущих простейших (инфузорий) в целях индустриального рыбоводства; дождевых червей для улучшения плодородия почв; личинок домашней мухи – для утилизации навоза и производства белка
Задачей данной темы является формирование у студентов биологов понятия культивирования одноклеточных простейших, как сложного и многопланового технологического процесса, состоящего из ряда последовательных этапов. Это особенно важно, поскольку в основе любого биотехнологического производства лежит та или иная клеточная культура. Студенты должны знать, как правильно организовать работу в культуральной лаборатории, какое оборудование существует для достижения этих целей и как его правильно применять, чем руководствоваться при выборе объектов культивирования и питательных сред, какие этапы работы предшествуют собственно процессу культивирования. Только в этом случае можно рассчитывать на эффективное применение полученных знаний.
Новизна и актуальность темы заключается в сочетании различных форм работы, направленных на углубление биолого-экологических знаний с опорой на практическую деятельность и с учетом региональных экологических особенностей.
Студенты учатся самостоятельно планировать постановку эксперимента, в полевых условиях отыскивают материал и создают питательные среды для культивирования свободноживущих простейших разных систематических групп. Получив определенный результат, изучают простейших под микроскопом, фотографируют, составляют схемы проведения эксперимента и готовят отчет с презентацией.
Такая методика лабораторных работ способствует формированию творческого подхода к выполнению поставленной задачи, пытливости ума, приобретению исследовательских навыков при работе с микроскопом, дает основы систематики, используемые в биологии.
Формы отчетности по данной теме должны быть представлены в отчете по такой схеме:
1. Выявленные места обитания простейших в природе.
2. Методы взятия проб простейших разных систематических групп в естественном биоценозе.
3.Подготовка питательной среды для культивирования простейших.
4. Процесс культивирования разных систематических групп.
5. Просмотр материала под микроскопом, определение, зарисовки и фотографирование.
6. Составление блок-схемы процесса культивирования разных систематических групп простейших
7. Отчет с презентацией.
Культивирование простейших (амебы, жгутиковые, инфузории) проводится по методике акад. Ю.И. Полянского (19 )
СУБСТРАТЫ ДЛЯ КУЛЬТИВИРОВАНИЯ БИООБЪЕКТОВ Принципы составления питательных сред. Все живые клетки нуждаются в экзогенных источниках питания, содержащихся в питательных средах. Питательная среда обеспечивает жизнедеятельность, рост и развитие биообъектов.
Прежде чем начинать работы по культивированию разных типов одноклеточных необходимо точно знать их питательные потребности и зависимости. Постоянным компонентом питательных сред является вода, в которой нуждаются все живые клетки. Некоторые компоненты питательных сред, находящиеся в твердом агрегатном состоянии, могут либо образовывать придонный осадок, либо равномерно распределяться по всему объему в виде взвеси, либо плавать на поверхности раствора (частицы угля). Жидкие углеводороды при внесении в воду образуют несмешивающуюся фракцию. В питательной среде должны присутствовать все элементы, необходимые для построения компонентов живых клеток в доступной для усвоения форме. В больших количествах клеткам необходимы макроэлементы: углерод, азот, кислород, водород, фосфор, сера, калий, кальций, магний. Снабжение клеток кислородом и водородом осуществляется за счет воды. Углерод является составной частью всех органических соединений и его источники многочисленны и многообразны: чаще всего сахара, многоатомные спирты и органические кислоты. В качестве азотистого субстрата для изготовления питательных сред служат в основном белки животного и растительного происхождения. Помимо макроэлементов, клетки в незначительных количествах нуждаются также и в некоторых микроэлементах: натрий, марганец, никель, кобальт, хлор, цинк, медь, кремний, молибден, бор, ванадий и некоторые другие.
Отмечается целесообразность промышленного культивирования свободноживущих простейших, в частности, инфузорий. Известны работы по созданию технологической схемы непрерывного культивирования инфузории Paramecium caudatum Ehrenberg, 1838, как «стартового» корма для рыб (Олексив, 1986), а также по массовому культивированию инфузорий в морской воде (Новоселова, 2013). Разработан аппарат для непропорционально-проточного культивирования крупных инфузорий Spirostomum ambiguum Muller, 1786 (Пролубников, Кокова, 1987), в котором определены оптимальные площадь поверхности дна для оседания инфузорий и интенсивность аэрации. Получены мутации простейших, снижающие запрет на размножение, т.е. утратившие характерные для них стадии покоя и размножающиеся непрерывно многие годы (Хлебович, 1986). Spirostomum ambiguum также широко применяется для токсикологических и фармакологических исследований (Цисанова и др.). Исследуют возможность массового культивирования хлореллы как источника ценных химических соединений (каротиноидных комплексов, аминокислот и других ценных соединений. Показано, что суспензия и сырая паста хлореллы при добавлении к рационам сельскохозяйственных животных и птиц повышают их продуктивность до 30 %. Несомненен разноплановый теоретический интерес изучения протистов.
Поэтому не случайно протисты привлекают внимание многих исследователей, а протистология достаточно интенсивно развивается.
Простейшие – это организмы, тело которых представлено одной клеткой. Они обитают в разнообразных условиях среды, и в первую очередь в водоемах богатых органическим веществом. Их легко обнаружить среди водной растительности и на дне водоема среди остатков гниющих растений. Простейшие могут давать несколько поколений всего за одни сутки, поэтому возможность получения больших их биомасс открывает перспективы практического приложения культивирования простейших.
Среди простейших наиболее широко используются инфузории, и в первую очередь инфузория туфелька (Paramaecium caudatum Ehrenberg). Размеры разных видов инфузорий невелики – 50-100 мкм, поэтому их можно увидеть только при большом увеличении микроскопа. У инфузории туфельки размер тела значительно больше, около 200 мкм. Из-за малых размеров инфузории являются доступным кормом для личинок большинства рыб (как промысловых, так и аквариумных). В связи с этим простейшие широко используются в практике лабораторного и промышленного культивирования на ранних стадиях развития рыб.
Тело инфузорий покрыто продольными рядами многочисленных
мелких ресничек, которые совершают волнообразные движения. С их помощью туфелька плавает (тупым концом вперед). Несмотря на малые размеры инфузории достаточно подвижны. Так, Paramaecium caudatum при комнатной температуре двигается со скоростью до 2,5 мм/с. То есть, за одну секунду проделывает расстояние, превышающее длину тела в 10-15 раз (в 2-3 раза быстрее, чем рекордсмен мира в беге на 100 м). Это обстоятельство следует учитывать при выкармливании мелких, малоподвижных личинок рыб, которые даже при высокой концентрации инфузорий иногда остаются голодными (не могут схватить подвижную инфузорию).
С помощью ресничек инфузории подгоняют корм, в том числе и бактерий, к ротовому отверстию. Ротовое отверстие всегда открыто. Мелкие пищевые частицы проникают через рот в глотку и скапливаются на ее дне. После чего пищевой комок вместе с небольшим количеством жидкости отрывается от глотки, образуя в цитоплазме пищеварительную вакуоль. Последняя проделывает в теле инфузории сложный путь, в процессе которого осуществляется переваривание пищи.
Питаются инфузории бактериями, водорослями, грибами, мелкими мертвыми частицами (детритом) и растворенным органическим веществом (РОВ). Чем меньше размер инфузорий, тем большую роль в их питании играют бактерии. Разные бактерии и водоросли имеют для них различную пищевую ценность. Следует учитывать, что инфузории могут отфильтровывать и заглатывать любые частицы, независимо от их питательной ценности, поэтому присутствие в среде нежелательных частиц (минеральной взвеси, «грубого» детрита) сказывается на их продуктивности.
Суточный рацион достигает 500% от массы их тела, коэффициент использования потребленной пищи на рост К1 равен 30-40%, а коэффициент использования усвоенной пищи на рост К2 – 50-70%. Т.е., инфузории достаточно эффективно используют потребленную пищу.
Размножение инфузорий происходит путем деления клеток. Кроме того, размножение может осуществляться половым путем. В последнем случае две клетки соединяются (конъюгируют), в результате чего происходит обмен частями ядерного аппарата, несущего наследственную информацию.
В оптимальных условиях инфузории обладают высокой интенсивностью размножения. К примеру,Stylonichia pustulata при температуре 20-25оС делится 4-5 раз в сутки. При одинаковой температуре быстрее размножаются мелкие инфузории, число которые может за 6 суток увеличиться до 10 млн. экземпляров.
Мелкие виды морских инфузорий делятся со скоростью 3 деления в сутки, более крупные 1-2 деления. В пресных водоемах (в частности, в Можайском водохранилище) время удвоения массовых видов простейших составляет 3-40 часов, а наименьшая – у мелких представителей – 3-8 часов (Белова, Садчиков, 2005). Их численность в толще водохранилища достигает 4 тысяч экземпляров в литре воды.
Многие инфузории выдерживают значительное понижение температуры. Установлено, например, что P.caudatum при понижении температуры до 0оС продолжает делиться, но в замедленном темпе (один раз в 20 дней). Верхний температурный порог этого вида из средней климатической зоны составляет 36оС, но уже при 30оС организмы находятся в угнетенном состоянии. Жизненные процессы инфузорий протекают более интенсивно при периодической смене температур, чем при постоянной. В диапазоне от 4 до 28оС парамеция хорошо выдерживает суточные колебания температуры в пределах 12оС.
На рост, размножение и питание инфузорий большое влияние оказывает рН среды. Оптимум для P.caudatum лежит в пределах 6,6-7,6, причем развиваются они и при больших колебаниях рН от 4,7 до 9,1. Инфузории устойчивы к пониженным концентрациям кислорода в воде. Однако оптимальные значения этого показателя для большинства видов находятся в пределах 6-8 мг/л.
Биохимический состав инфузорий (Paramecium caudatum) составляет: протеин – 58% от сухой массы, жир – 32%, зола — 3%. Калорийность – 6,6 ккал/г сухого вещества. Суточная удельная продукция составляет 4,0 и более. Т.е., за одни сутки инфузории могут увеличить биомассу в 4 раза. Это делает их перспективным кормом для личинок рыб.
В практике лабораторного и массового культивирования обычно используют высокопродуктивные и широко распространенные в эвтрофных водах виды, такие как Paramaecium caudatum, P.aurelia, P.bursaria, P.multimicronudeatum, Stylonichia (Oxytricha) pastulata, Colpoda steine, Colpidium colpoda, C.stiatum, C.campilium, Tetrahymena pyriformis.
Основными факторами, влияющими на рост и развитие инфузорий, являются: количество и качество пищи, накапливающиеся в среде продукты метаболизма, рН среды, температура, содержание кислорода и т.д.
При культивировании простейших применяют различные бактериальные, водорослевые и дрожжевые питательные среды. Наиболее часто используется сенной настой, на котором обильно развивается сенная палочка (Bacillus subtilis) и другие бактерии, служащие пищей для простейших. Исследователи в качестве корма при лабораторном культивировании Paramaecium caudatumиспользовали сухое молоко, смесь дрожжей и бактерий, экстракт хлореллы, овсяной отвар и др.
На темп развития простейших влияет качество и количество корма. Так, Paramaecium caudatum иP.aurelia имеют достаточно высокий темп деления (2,5 раза в сутки) при питании Bacillus subtilis, выделенных из сенного настоя. Показано, что при разнообразном бактериальном корме темп деления несколько выше, чем при использовании монокультуры.
Большое влияние на рост культуры простейших оказывают продукты их собственного метаболизма. Наблюдения за ростом простейших показали, что рост инфузорий прекращается задолго до того, как израсходованы питательные вещества, что связано с увеличением в среде продуктов метаболизма. В лабораторных экспериментах показано, наличие в среде метаболитов простейших приводит к их инцистированию или конъюгации, несмотря на наличие в среде достаточного количества пищи. В связи с этим культуральную среду необходимо постоянно обновлять.
В зависимости от концентрация водородных ионов (рН) среды одни и те же факторы оказывают положительное или отрицательное влияние на рост простейших. рН среды оказывает большое значение на рост и развитие инфузорий. В зависимости от рН среды размеры вакуолей и их количество сильно меняется. По мере развития культуры инфузорий рН среды заметно меняется, от 4,7 до 8,0 и выше. Инфузории Paramaecium caudatum достаточно хорошо развиваются в пределах значений рН от 4,7 до 9,1; оптимум для них находится в пределах 6,5-7,0.
Интенсивность дыхания простейших увеличивается при повышении температуры среды. Дыхание инфузорий зависит от рН среды; оно наиболее интенсивно при рН 6,6-7,6. В щелочной среде интенсивность дыхания уменьшается; то же самое происходит и в кислой среде (до рН 3,7). Дыхание зависит от физиологического состояния организма, от количества пищи, условий среды обитания и т.д. При голодании интенсивность дыхания понижается.
Постоянный уровень концентрации кислорода в среде, поддерживаемый за счет продувания культуры воздухом, позволяет получать высокие плотности инфузорий, вплоть до 800 тыс. экз./мл. Поэтому в процессе культивирования простейших среда должна постоянно обогащаться кислородом.
При низких температурах (в пределах 0оС) Paramaecium caudatum делится один раз в 20 суток. По мере повышения температуры среды до 28оС темп деления заметно повышается. При температуре свыше 30оС темп деления понижается, вплоть до его полного прекращения при 35оС. Так, темп деления Paramaecium caudatum при 29оС составляет 2 деления в сутки, а при комнатной температуре – одно деление. Температура оказывает влияние на размеры инфузорий, интенсивность движения, деятельность сократительной вакуоли, дыхание и т.д. Температурный оптимум для P.caudatumлежит в пределах 26-30оС.
Резюмируя изложенное выше можно отметить, лучшим кормом для Paramaecium caudatum являются бактерии (Bacillus subtilis, Aerobacter aerogenes), а также смесь бактерий и дрожжей. Оптимальное значение рН лежит в пределах 6,8, температура среды – 28оС. В культуре простейших могут накапливаться продукты метаболизма, которые, если их не удалять, ведут к прекращению роста или гибели парамеций. Культуре простейших необходима постоянная аэрация воздухом.
Культивирование простейших ведут в накопительном или проточном режимах. При накопительном культивировании достаточно быстро накапливаются продукты метаболизма, поэтому этот метод используется для получения одноразового небольшого количества простейших. Однако при использовании серии культиваторов (колб или иных сосудов) можно длительное время поддерживать культуру простейших.
Для периодического культивирования широко используется сенной отвар. Берут 10 г сена и помещают его в 1 л воды, кипятят в течение 20 минут, затем фильтруют и разбавляют равным количеством воды (или используют без разбавления).
В настоящее время большое внимание уделяется методам проточного культивирования. В практике непрерывного культивирования микроорганизмов применяют два метода культивирования: пропорционально-проточный и непропорционально-проточный, которые подробно описаны в книгах: В.Е.Кокова и Г.М. Лисовский (1976, 1982). Эти методы также могут использоваться при культивировании микроводорослей, коловраток и других организмов.
Непрерывное пропорционально-проточное культивирование характеризуется тем, что клетки и культуральная среда в выводимой из культиватора суспензии находятся в том же соотношении, что и в культиваторе. Это достигается установкой в культиваторе различных перемешивающих устройств, обеспечивающих равномерное распределение организмов в суспензии. Непрерывное непропорционально-проточное культивирование характеризуется тем, что соотношение организмов в культиваторе и в выводимой из культиватора суспензии находятся совершенно в ином соотношении. Это связано с тем, что часть клеток простейших осаждаются на стенках культиватора, особенно при использовании пластин, увеличивающих внутреннюю поверхность сосуда.
Для выращивания простейших используются сосуды типа делительных воронок с одним или двумя эрлифтами объемом от 0,2 до 10 литров. Эрлифты служат для аэрации среды, с расходом воздуха 9 л/мин. Кормом служит смесь дрожжей и бактерий. Ежедневно 3-10 раз сливают определенный объем культуры парамеций и добавляют равный объем среды с кормом. Оптимум скорости потока среды составлял 0,6 объема среды в культиваторе, т.е. 60%. Специалистами были получены высокие показатели продуктивности культуры. Суточная продукция инфузорий стабильно держалась на уровне 2 г сухого или примерно 20 г сырого вещества на 1 л культуры.
В улучшенном варианте культиваторов с двумя эрлифтами и дополнительными поверхностями (с пластинами внутри для увеличения площади прикрепления парамеций) была достигнута максимальная плотность культуры 73 тыс. особей на 1 мл. Полученные величины продукции инфузорий 20 кг/м3 в сутки намного превышают продукцию других организмов при периодическом культивировании.
Для пропорционально-проточного метода используют реакторы с перемешивающим устройством, обеспечивающим равномерное распределение организмов в среде. Для регулирования подачи среды при непрерывном методе используют специальные дозаторы, которые подают питательную суспензию в реактор и удаляет определенный объем отработанной суспензии вместе с простейшими. Ролики изготовлены из тефлона, шланги – медицинские. Дозатор прикрепляется к мотору с определенным количеством оборотов и работает в заданном режиме. Скорость потока может изменяться за счет диаметра шланга и скорости вращения роликов.
При данном способе культивирования на 10-е сутки популяция Paramaecium caudatum достигала 14 тысяч экземпляров в 1 мл среды (при исходной численности 1 тыс. экз./мл) и удерживалась на этом уровне в течение одного месяца. Продукция составляла 6 тыс. экз./мл в сутки (или 6 г сырого вещества на 1 литр в сутки).
Для получения культуры простейших обычно используют настой сена. При приготовлении сенного настоя возможны различные варианты соотношения сена и воды, а также замачивания сена водой. При лабораторном культивировании берут 10-20 г сена на 1 л воды. При массовой культивировании инфузорий (в помещении или под открытом небом) лучшие результаты были получены при концентрации сена 1-2 г/л. При более высоких концентрациях сенного настоя культура быстро загнивает, и на поверхности воды появляется бактериальная пленка.
Сено заливают сырой водой и кипятят в течение 15-20 минут (чтобы убить нежелательные организмы), затем настаивают в течение 2-3 дней и фильтруют. При приготовлении большого количества сенного настоя (к примеру, для культивирования простейших в больших бассейнах) сено следует залить кипятком, затем охладить его, а настой процедить. Срок настаивания 2-3 дня.
Во время кипячения погибают все микроорганизмы, но сохраняются споры бактерий. Через несколько дней из спор развиваются сенные палочки, служащие пищей для инфузорий. По мере необходимости настой добавляют в культуру простейших. Настой может храниться в холодном месте в течение одного месяца.
Кормовые дрожжи вносят из расчета 100 мг/л. Для создания бактериальных сред используют также настой из растительного салата, разбавленного молока, отвар из различных круп. Кроме того, в качестве корма для инфузорий можно использовать высушенные корки банана, дыни, нарезанную морковь, молоко, сушеные листья салата и других овощей и фруктов, которые являются субстратом для развития бактерий. Отвар сливают в чистую посуду и заражают инфузориями.
При использовании указанных выше кормов важно не передозировать питание. В противном случае размножающиеся бактерии резко снижают концентрацию кислорода в среде, что отрицательно сказывается на развитии простейших.
Инфузорий культивируют в различных емкостях – колбах, делительных воронках, аппаратах Вейса, бассейнах, полиэтиленовых садках и др. Хорошие результаты достигаются при комнатной температуре, но пик размножения инфузорий наблюдается при 22-26оС. В первые дни культивирования продувка должна быть очень слабая, чтобы не поднимался осадок со дна сосуда. При наличии продувки инфузории располагаются в нижней части сосуда, а при недостатке кислорода они устремляются к поверхности воды. Это их свойство используют для концентрирования инфузорий перед скармливанием их личинкам рыб. Кроме того, инфузории обладают положительным фототаксисом, т.е. стремятся к свету. Это тоже позволяет их собирать в больших количествах.
«Закваску» инфузорий вносят в емкость из сенного настоя (из расчета 20 г сена на 1 л воды). Для этого достаточно внести несколько капель на 1 л воды. Живой корм необходимо начинать приготавливать за 8-9 дней до получения одно- и двухдневных личинок толстолобиков, кефалей и других рыб с малым ртом. Культуру инфузорий, используют, как правило, не дольше 20 дней, после чего ее заменяют новой. Для постоянного поддержания культуры ее заряжают в нескольких сосудах с интервалом в неделю, при этом каждый сосуд перезаряжают каждые две недели. Для длительного хранения культуры инфузорий, ее хранят в холодильнике при температуре 3-10оС.
Инфузорий вносят в емкость, где содержатся личинки рыб при оптимальной плотности посадки 10 тысяч штук на 1 м3 воды. На рыбоводных заводах для этой цели используют детские ванны объемом 40 л. В первые два дня проточность воды необязательна. Для аэрации воды при необходимости можно применять аквариумный компрессор с распылителем воздуха.
Опыты культивирования свободноживущих инфузорий в проточном режиме, указывает на принципиальную возможность получения в небольших производственных емкостях больших количеств живого корма, доступного личинкам всех видов рыб в первые дни выклева..
Дата: 2018-11-18, просмотров: 1528.