Температура условия твердения вяжущего.
Твердение портландцемента, как и других вяжущих, является сложным комплексом взаимосвязанных химических, физико-химических и физических процессов. С химической точки зрения твердение – это переход безводных клинкерных минералов в гидраты в результате реакций гидролиза и гидратации, с физической – постепенное загустевание цементного теста и возникновение единого конгломерата из гидратированных и негидратированных частичек. [3]
Взаимодействие портландцемента с водой приводит к образованию новых гидратных веществ, обусловливающих схватывание и твердение теста, растворной или бетонной смеси. Состав новообразований зависит от химического и минерального составов цементов, а также от ряда других факторов и в первую очередь от температуры, при которой взаимодействуют компоненты.
Цементное тесто, приготовленное путем смешивания цемента с водой, имеет три периода твердения. Вначале, в течение 1 – 3 ч. после затворения цемента водой, оно пластично и легко формуется. Потом наступает схватывание, заканчивающееся через 5 – 10 ч. после затворения; в это время цементное тесто загустевает, утрачивая подвижность, но его механическая прочность еще не велика. Переход загустевшего цементного теста в твердое состояние означает конец схватывания и начало твердения, которое характерно заметным возрастанием прочности. Твердение бетона при благоприятных условиях длится годами – вплоть до полной гидратации цемента.
Сразу после затворения цемента водой начинаются химические реакции. Уже в начальной стадии процесса гидратации цемента происходит быстрое взаимодействие алита с водой с образованием гидросиликата кальция и гидроксида:
2(3CaO*SiO2) + 6H2O = 3CaO*2SiO2*3H2O + 3Ca(OH)2.
После затворения гидроксид кальция образуется из алита, так как белит гидратируется медленнее алита и при его взаимодействии с водой выделяется меньше Ca(OH)2, что видно из уравнения химической реакции:
2(2CaO*SiO2) + 4H2O = 3Ca*2SiO2*3H2O + Ca(OH)2.
Взаимодействие трехкальциевого алюмината с водой приводит к образованию гидроалюмината кальция:
3CaO*Al2O3 + 6H2O = 3CaO*Al2O3*6H2O.
Для замедления схватывания при помоле клинкера добавляют небольшое количество природного гипса (3 – 5 % от массы цемента). Сульфат кальция играет роль химически активной составляющей его в гидросульфоалюминат кальция (минерал эттрингит) в начале гидратации портландцемента:
3CaO*Al2O3 + 3(CaSO4*2H2O) + 26H2O = 3CaO*Al2O3*3CaSO4*32H2O.
В насыщенном растворе Ca(OH)2 эттрингит сначала выделяется в коллоидном тонкодисперсном состоянии, осаждаясь на поверхности частиц 3Ca*Al2O3, замедляет их гидратацию и затягивает начало схватывания цемента. Кристаллизация Ca(OH)2 из пересыщенного раствора понижает концентрацию гидроксида кальция в растворе, и эттрингит уже образуется в виде длинных иглоподобных кристаллов. Кристаллы эттрингита и обуславливают раннюю прочность затвердевшего цемента. Эттрингит, содержащий 31 – 32 молекулы кристаллизационной воды, занимает примерно вдвое больший объем по сравнению с суммой объемов реагирующих веществ (C3A и сульфат кальция). Заполняя поры цементного камня, эттрингит повышает его механическую прочность и стойкость. Структура затвердевшего цемента улучшается еще и потому, что предотвращается образование в нем слабых мест в виде рыхлых гидроалюминатов кальция.
Четырехкальциевый алюмоферрит при взаимодействии с водой расщепляется на гидроалюминат и гидроферрит:
4CaO*Al2O3*Fe2O3 + m*H2O = 3CaO*Al2O3*6H2O + CaO*Fe2O3*nH2O.
Гидроалюминат связывается добавкой природного гипса, как указано выше, а гидроферрит входит в состав цементного геля.
Температура оказывает очень большое влияние на твердение портландцемента. При температурах от 0 до 8 оС происходит значительное (в 2 – 3 раза) по сравнению с твердением при обычных температурах замедление этих процессов, а ниже 0 оС они почти полностью прекращаются. Повышение же температуры твердеющих растворов и бетонов сопровождается большим ускорением роста прочности. Оно становится достаточно заметным уже при температуре бетонных смесей 30 – 40 оС при их твердении в теплые периоды года. В больших же массивах эти температуры могут держаться и в холодное время.
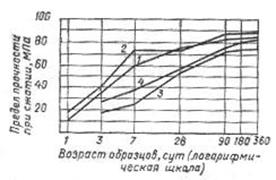
Рисунок 1.[2] Изменение прочности по времени образцов из цементного теста, твердевших при 20 оС
1 и 2 – тонкость помола 3000 и 5000 см2/г, В/Ц = 0,25;
3 и 4 – тонкость помола 3000 и 5000 см2/г, В/Ц = 0,35.
Резкое ускорение процессов твердения цементов и бетонов наступает при 70 – 95 оС и особенно при 175 – 200 оС и выше. Однако такое интенсивное воздействие температуры на твердение цементов, а, следовательно, и бетонов проявляется лишь при наличии в них воды в жидком состоянии. Недостаток воды во время твердения при повышенных температурах не только замедляет процессы гидратации, но и снижает прочность и стойкость бетонов. При полном испарении воды процессы твердения прекращаются.
Тепловлажная обработка ПЦ при повышенных температурах (80 – 200 оС) вызывает не только ускорение, но и большие изменения в химическом составе и структуре новообразований. При повышенных температурах клинкерные минералы образуют гидратные соединения с пониженным количеством молекул воды. Тепловлажностная обработка способствует увеличению размеров частичек новообразованием и тем в большей степени, чем выше температура и длительнее ее воздействие на твердеющий цемент. Все это снижает прочностные характеристики и повышает пористость цементного камня при одинаковой степени гидратации исходного вяжущего.
Тепловлажная обработка цемента при твердении тем слабее отражается на его прочности, пористости и некоторых других свойствах, чем раньше она проведена после затворения вяжущего водой при прочих равных условиях.
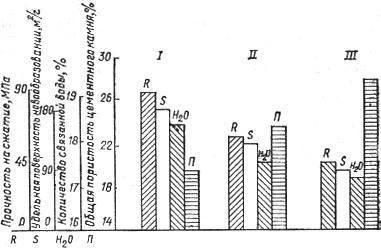
Рисунок 2.[2] Влияние условий твердения на некоторые свойства цементного камня
I – твердение в воде при 20 оС в течение 28 сут, степень гидратации 0,66;
II – твердение в воде при 20 оС в течение 28 сут, затем в воде при 90 оС в течение 8 ч, степень гидратации 0,7;
III – твердение в воде при 20 оС в течение 28 сут, затем в воде при 174,5 оС в течение 8 ч, степень гидратации 0,75.
Таким образом, Тепловлажная обработка, способствуя ускорению твердения, может приводить к некоторому недоиспользованию потенциальных возможностей цементов, полнее проявляющихся при обычном твердении. Лишь автоклавная обработка, способна компенсировать отрицательное влияние и обеспечить получение бетонов высокой прочности.
БТЦ отличается от обыкновенного цемента прежде всего более интенсивным твердением в первые 3 сут. Интенсивное твердение цемента в первые сроки возможно при достаточном количестве в нем зерен клинкера тонких фракций (0- 20 мкм). Суточная прочность цемента в основном зависит от содержания зерен клинкера размером менее 10 мкм, а 3-суточная – до 30 мкм. Процентное содержание указанных фракций клинкера в цементе определяет примерно ожидаемую его 1- и 3-суточную прочность.
Через 3 сут твердения в нормальных условиях прочность БТЦ обычно достигает 60 – 70 % марочной. В последующие сроки твердения интенсивность нарастания прочности замедляется и через 28 сут и более прочностные показатели быстротвердеющего цемента становятся такими же, как и у обычных высококачественных портландцементов.
1.3. Условия разрушения (коррозии) композита на рассматриваемом вяжущем. Области применения продукта. [2]
Портландцемент и различные его производные, а, следовательно, и бетоны на их основе характеризуются относительно высокой стойкостью против действия многих агрессивных факторов, наиболее часто встречающихся при эксплуатации зданий и сооружений. Тем не менее, при неблагоприятных условиях они могут быстро разрушаться, и необходимы мероприятия, защищающие бетонные и железобетонные конструкции от преждевременного износа.
Различные виды цементов характеризуются различной стойкостью против действия тех или иных агрессивных факторов.
Можно разделить коррозионные процессы, возникающие в цементных бетонах при действии водной среды, по основным признакам на три группы.
К первой группе (коррозия I вида) относятся процессы, протекающие в бетоне под действием вод с малой временной жесткостью. При этом некоторые составляющие цементного камня растворяются в воде и уносятся при ее фильтрации сквозь толщу бетона.
Ко второй группе (коррозия II вида) относятся процессы, развивающиеся в бетоне под действием вод, содержащих вещества, вступающие в химические реакции с цементным камнем. Образующиеся при этом продукты реакций либо легко растворимы и уносятся водой, либо выделяются на месте реакции в виде аморфных масс, не обладающих вяжущими свойствами. К этой группе могут быть отнесены, например, процессы коррозии, связанные с воздействием на бетон различных кислот, магнезиальных и других солей.
В третьей группе (коррозия III вида) объединены процессы коррозии, вызванные обменными реакциями с составляющими цементного камня, дающими продукты, которые, кристаллизуясь в порах и капиллярах, разрушают его. К этому же виду относятся процессы коррозии, обусловленные отложением в порах камня солей, выделяющихся из испаряющихся растворов, насыщающих бетон (солевая форма коррозии).
Отложение солей в порах цементного камня возможно и при химической коррозии, сопровождающейся, в частности, образованием гидротрисульфоалюмината кальция (зттрингита), а также двуводного гипса. Этот процесс сопровождается сильным давлением кристаллов на стенки пор и капилляров и возникновением напряжений, вызывающих деформации в цементном камне и бетоне и даже их разрушение.
При подсосе растворов разных солей 5 %-ной концентрации в течение 3 мес. кристаллизационное давление может достигать: при Na2SO4 - 4,4; MgSO4 - 3,6; NaCl - 2,7; CaSO4 - 0,09 МПа.
При особенно неблагоприятных температурных и влажностных условиях в порах цементного камня такие соли, как Na2SO4, MgSO4*H2O из безводных или маловодных форм могут переходить в соединения с большим количеством молекул воды (N2SO4*10H2O, MgSO4*7H2O) переход сопровождается увеличением объема твердой фазы в 1,5 - 3 раза и возникновением напряжений в десятки МПа, вызывающих большие деформации.
Классификация основных видов коррозии под действием природных вод:
1. Коррозия выщелачивания ( I ), вызываемая растворением гидроксида кальция, содержащегося в цементном камне, и выносом его из бетона.
Обусловливается тем, что составляющие цементного камня и, в первую очередь, гидроксид кальция в той или иной степени растворимы в воде. Содержание его в цементном камне через 1 - 3 мес твердения достигает 10-15%, считая на СаО, а растворимость при обычных температурах 1,2 г/л. После вымывания свободного гидроксида кальция и уменьшения его концентрации в фильтрующейся через бетон воде до значения менее 1,1 г/л начинается разложение ЗСаО*SiO2*ЗН2О с выделением из него гидроксида кальция.
При дальнейшем уменьшении концентрации СаО в воде до значений менее 0,56 г/л и завершении гидролиза указанных соединений начинается разложение СзАН12 и СзАН6 и переход их в С2АН8, который в свою очередь гидролизуется при концентрациях СаО в растворе ниже 0,36 г/л. При длительном воздействии мягких вод на цементный камень возможно полное вымывание гидроксида кальция с разложением остальных гидратных соединений до аморфных рыхлых гидратов кремнезема, глинозема и оксида железа. Но и частичное вымывание гидроксида кальция из цементного камня приводит к значительному снижению прочности.
Присутствие в водном растворе NaCl и Na2SO4 повышает растворимость Са(ОН)2 в воде, который следовательно, быстрее вымывается из цементного камня.
2. Кислотная коррозия ( II ) - результат действия кислот при значениях показателя рН менее 7.
Возникает под действием различных неорганических и органических кислот, вступающих в химическое взаимодействие с гидроксидом кальция, а также с другими соединениями цементного камня. Этот вид коррозии в зависимости от силы той или иной кислоты, определяемой показателями концентрации ионов водорода рН, может протекать очень интенсивно. Значения рН для водных растворов различных веществ следующие:
| Насыщенная известковая вода при 25 0С | 12,4 |
| Насыщенный раствор Mg(OH)2 при 25 0С | 10,5 |
| Нейтральный раствор | 7 |
| Вода насыщенная СО2 при 25 °С | 5,72 |
| 1 %-ный раствор уксусной кислоты | 3,5 |
| 0,1н раствор серной кислоты | 1 |
Под действием той или иной кислоты на цементный камень образуются кальциевая соль и аморфные бессвязные массы SiO2*aq, A1(OH)3, Fe(OH)3.
Образовавшиеся продукты, растворимые в воде, выносятся из цементного камня, нерастворимые же в виде рыхлых масс остаются. Все это сопровождается снижением прочности цементного камня, а в последующем и полным его разрушением.
3. Углекислотная коррозия ( II ), обусловленная действием на цементный камень, углекислоты и являющаяся частным случаем кислотной коррозии.
Углекислая коррозия развивается при действии на цементный камень, содержащей углекислый газ СО2. При этом вначале идет реакция между Са(ОН)2 цемента и углекислотой с образованием малорастворимого СаСО3 по схеме:
Ca(OH)2 + CO2 + H2O = CaCO3 + 2H2O
Дальнейшее воздействие Н2СО3 на цемент приводит, однако, к образованию более растворимого гидрокарбоната:
CaCO3 + H2CO3 ↔ Ca(HCO3)2.
Углекислая коррозия воздействует на цементный камень тем слабее, чем больше в водном растворе гидрокарбонатов кальция и магния.
4. Сульфатная коррозия ( III ), подразделяемая на сульфоалюминатную, вызываемую действием на цемент ионов 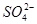 при их концентрации от 250—300 до 1000 мг/л; сульфоалюминатно-гипсовую, также возникающую главным образом под действием сульфатных ионов
при их концентрации от 250—300 до 1000 мг/л; сульфоалюминатно-гипсовую, также возникающую главным образом под действием сульфатных ионов 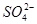 , но при концентрации их в растворе более 1000 мг/л, и гипсовую, которая происходит под действием воды, содержащей большое количество Na2SO4 или K2SO4.
, но при концентрации их в растворе более 1000 мг/л, и гипсовую, которая происходит под действием воды, содержащей большое количество Na2SO4 или K2SO4.
Сульфоалюминатная коррозия (разновидность сульфатной) является следствием взаимодействия гипса с высокоосновными алюминатами кальция, содержащимися в цементном камне, по схеме:
3CaO*Al2O3*6H2O + 3CaSO4 + 25H2O = 3CaO*Al2O3*3CaSO4*31H2O.
Образование малорастворимой трехсульфатной формы гидросульфоалюмината кальция (эттрингита) из твердого C3AH6 и растворенного в воде гипса сопровождается увеличением твердой фазы (по сравнению с C3AH6) примерно в 4,76 раза. Это вызывает возникновение сильных напряжений в цементном камне, приводящих к нарушению его структуры, деформациям и снижению прочности.
5. Магнезиальная коррозия ( II ) , подразделяемая на собственно магнезиальную, вызываемую действием катионов магния при отсутствии в воде ионов SO4 и сульфатно-магнезиальную, происходящую в цементном камне при совместном действии на него ионов Mg2+ и 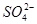 .
.
Магнезиальная коррозия цементного камня наступает под действием на них растворимых солей магния, кроме MgSO4. В этом случае между гидроксидом кальция цементного камня и, например, хлористым магнием происходит реакция по схеме:
Ca(OH)2 + MgCl2 = CaCI2 + Mg(OH)2,
вызывая разрушение цементного камня.
В случае сульфатно-магнезиальной коррозии реакция идет по схеме:
Ca(OH)2 + MgSO4 + 2H2O = CaSO4*2H2O + Mg(OH)2.
Влияние на цементный камень растворов хлоридов натрия, калия и кальция (но не аммония) при умеренных их концентрациях не сказывается отрицательно, однако растворы СаС12 высокой концентрации действуют агрессивно.
Области применения БТЦ.
БТЦ в настоящее время широко применяются в промышленности. Они повышают марку бетона, что приводит к уменьшению массы изделий и экономии бетона на 8 – 30 %, стали – до 15 % и снижению стоимости изделий – на 3 – 15 %. При использовании БТЦ появляется реальная возможность сократить производственный цикл, увеличить оборачиваемость форм.
БТЦ целесообразно применять при изготовлении высокопрочных, обычных и преднапряженных железобетонных изделий и конструкций. Это дает возможность значительно сократить потребность в металлических формах.[3]
Применение БТЦ в строительстве имеет исключительно важное значение. Они позволяют отказаться от самого длительного и дорогого процесса – тепловлажностной обработки железобетонных изделий на заводах, требующей значительного расхода топлива и больших производственных площадей для размещения тепловых установок (камер, котельных установок и др.). Они позволяют особенно эффективно решать проблемы возведения зданий и сооружений из монолитного бетона с применением скользящих и переставных опалубок.
При их использовании значительно экономичнее должны решаться задачи зимнего бетонирования. Предпосылкой для этого является то обстоятельство, что бетоны на БТЦ уже через 4 – 10 ч твердения при 10 – 15 оС могут набирать до 30 – 50 % марочной прочности. Как известно, последующее замерзание бетона почти не отражается на конечной его прочности после оттаивания.
1.4. Сырьевые материалы для производства продукта:
Дата: 2019-12-10, просмотров: 344.