1.4.1 Попередня обробка сировини
При використанні для готування живильних більшість середовищ перерахованих джерел сировини, особливо гідролізатів деревини, сульфітних лугів, різних видів вуглеводної сировини, необхідно вносити в середовище додатково мікроелементи, азотне й фосфорне харчування, вітаміни. Для цього використають кукурудзяний екстракт, дріжджові авто лізати або гідро лізати, відходи виробництва вітамінів, лимонної кислоти й ін. До складу середовищ уводять мінеральні солі, що містять азот, фосфор, калій, магній й інші елементи. Джерелом азоту в середовищі може бути аміак, що підтримує рН на певному рівні.
Вирішальне значення для проведення біотехнологічних процесів має хімічний і біологічний склад води. Вода не повинна містити токсичних забруднень, вірусів, плазмід і суперечка.
У процесі підготовки живильних важливих середовищ значення має змішування й стабілізація готового реакційного середовища.
Підготовка живильних сполучених середовищ із використанням різних методів її обробки: фізико - механічних (здрібнювання компонентів, гомогенізація, перемішування, розчинення, фільтрація, теплова обробка); хімічних (регулювання окислювально-відбудовного потенціалу, рН середовища, іонної сили, осмотичного тиску, гідроліз, нейтралізація); біологічних (оцінка середовища на стерильність, попереднє культивування на середовищі, ферментативний гідроліз, ізомеризація й т.д.).
Готові середовища можуть не вимагати стерилізації, і після готування на них можна культивувати мікроорганізми. У деяких випадках живильного необхідно середовища стерилізувати, що можна здійснити шляхом нагрівання, озонування, що стерилізує фільтрації, хлоруванні, обробки формаліном або опромінення.
1.4.2 Культивування мікроорганізмів
Основною стадією технологічного процесу виробництва мікробних білкових препаратів є культивування мікроорганізмів. У період пуску виробництва та стадія складається з підготовки й вирощування вихідного посівного матеріалу аж до доведення процесу в промислових ферментаторах, тобто до рівня, що коли утворилася біомасу вже можна відокремлювати від рідкої фази й сушити. При сталому виробництві чисту культуру посівного матеріалу подають у ферментатори для постійного підновлення культури. Тому незалежно від способу культивування й періоду роботи заводу процес вирощування мікроорганізмів має два щаблі: одержання чистої культури посівного матеріалу; вирощування мікробних мас у промислових ферментаторах.
1.4.3 Одержання чистої культури
Посівним матеріалом називають чисту культуру мікроорганізму, що виходить шляхом її послідовного асептичного пересівання із пробірки в колбу, а потім в апарати обсягу, що збільшується, аж до великого посівного апарата, з якого вона передається у виробництво при уведенні в роботу чергового ферментатора або в працюючий ферментатор для підтримки в ньому росту основної культури продуцента.
Готування посівного матеріалу виробляється по наступних стадіях вирощування: в умовах лабораторії; у малому посівному апарату; у великому посівному апарату; у малому ферментаторі; у промисловому ферментаторі.
Перша стадія вирощування посівного матеріалу здійснюється в заводській лабораторії. Головне - зберегти вихідний штам у незмінному стані.
Суперечки мікроорганізмів, утворені нестатевим шляхом, являють собою найкращу форму збереження вихідного штаму мікроорганізму. Однак при тривалому зберіганні культури можуть виникнути спонтанні нерегульовані мутації. Тому необхідно періодично проводити розсів культури й перевірку її однорідності як по морфологічним, так і по фізіологічних ознаках. При розсіві з колонії, що дала найкращі показники по діагностуючому середовищу, роблять новий розсів в 30 - 40 пробірок. Потім з кожних 5 - 6 пробірок відбирають одну й перевіряють, що перебуває в ній мікроорганізм на здатність утворювати білок, продуцентом якого він є. Проведення такої безперервної селекції дозволяє зберегти в активній формі вихідну культуру продуцента.
Однорідний штам мікроорганізму висівають у пробірки, вирощують д певного віку в оптимальних умовах, а потім поміщають у холодильник при температурі 3 – 4 °С. Пересівання культур проводять через певні проміжки часу. Тривалі паузи між пересіваннями неприпустимі, тому що при цьому виснажується й сохне середовище, позначається негативний вплив метаболітів, можливі мутації.
При пересіваннях варто переносити тільки суперечки або невеликі шматочки міцелію без середовища, щоб у свіже середовище не вносити продукти метаболізму. Для тривалого зберігання штамів часто використають крохмальні середовища.
Дріжджі зберігають в 10 % - ному водяному розчині гліцерину в запаяних ампулах в атмосфері рідкого азоту при низьких температурах (- 196 ÷ - 165 °С)
Заготовлені чисті культури мікроорганізмів у міру необхідності подають у виробництво. Для цього штам МО асептично пересівають у качалочні колби із середовищем, що відповідає складу середовища, і вирощують до відповідного віку.
Одержання чистої культури можна також здійснити в лабораторному ферментаторі періодичної або безперервної дії. Потім розведення чистої культури, що перебуває в стадії інтенсивного зростання, задають у малий посівний апарат з підготовленим живильним . середовищем
Готування живильного для середовища посівного матеріалу окремо від основного виробництва здійснюють лише на деяких заводах.
На другій стадії вирощування посівного матеріалу живильне й із дріжджове розведення надходять у малий посівний апарат обсягом 0,5 м3. Щільність початкової засівби невелика (0,01 % у перерахуванні на сухі дріжджі). Спочатку в посівний апарат подають близько 40 л середовища зі змістом РВ 2 - 2,6 % і розбавляють її в 4 - 4,5 рази стерильною водою так, щоб зміст РВ не перевищувало 0,45 - 0,5 %. Інтенсивно середовище, поступово додають інша кількість живильного розчину (70 - 90 л) зі швидкістю 7 - 8 л/г, при цьому рН підтримують на рівні 4 - 5,5 додаванням аміачної води.
Культивування продовжують до нагромадження дріжджів 3,5 - 4 г/л (по сухій масі). Процес закінчується за 12 - 15 годин.
Третя стадія готування посівного матеріалу здійснюється в посівних апаратах обсягом 4 – 5 м3. У них подають близько 180 - 200 л середовища, розбавляють в 6 - 6,5 рази стерильною водою й задають всі дріжджі, отримані на другій стадії (близько 300 л). Всю масу активно аэрують у плині 10 - 12 годин при одночасному доливі живильного із середовища розрахунку 70 - 75 л/г і додаванні аміачної води для підтримки рН.
Четверта стадія процесу здійснюється в малому ферментаторі обсягом 12 – 15 м3. Апарат на 10 % заповнюють стерильною або прокип'яченою водою, уводять близько 0,5 м3 середовища й перекачують уміст попереднього апарата (2,5 – 2,7 м3). Вирощування посівного матеріалу триває 8 – 9 ч при постійному доливі середовища з розрахунку близько 1,5 – 1,7 м3 за один цикл. До кінця циклу дріжджів у середовищі повинне втримуватися 4 – 5 г/л (по сухій масі). Потім починають відбирати в основне виробництво по 1 – 1.5 м3 дріжджів у годину, додаючи одночасно свіже середовище зі змістом РВ 1 – 1,2 %. Процес триває від 5 до 10 год, після чого цикл готування посівного матеріалу відновляється.
На початку кожного циклу в лабораторії відбирають варіанти культури дріжджів, які дали найкращі результати по нагромадженню білка й швидкості росту в основному виробництві.
Якщо підприємство має більшу продуктивність й обсяг посівного матеріалу, рівний 1 – 1,5 м3/ч, недостатній, у схему готування посівного матеріалу включають п'яту стадію, тобто ще один ферментатор, в 4 – 6 разів більший по обсязі ферментатора четвертого ступеня. У цьому випадку четверту стадію процесу проводять, як третю, п'ятий апарат працює по режиму четвертої стадії, добір готових дріжджів становить 6 -7 м3/ч.
Чистоту процесу вирощування дріжджів контролюють щогодини. Проби відбирають і переглядають під мікроскопом, мертві клітини красяться метиленовою синню, а живі залишаються не пофарбованими.
При перегляді визначають кількість мертвих і клітин, що брунькуються, стосовно загальної кількості дріжджів і виражають їх у процесі. Проводять спостереження над морфологічними змінами дріжджів: визначають кількість дрібних клітин і клітин з подвійними бруньками й відзначають наявність диких дріжджів – не сахаромицетів і бактерій.
1.4.4 Контроль живильних речовин і стимуляторів росту
Аміак застосовують як джерело азоту й для регулювання рН середовища при вирощуванні дріжджів, а також збільшення виходу чистого білка. У виробництві використають аміак водний технічний (ДЕРЖСТАНДАРТ 9 - 57), що представляє собою розчин газоподібного аміаку у воді.
Відсоток змісту аміаку у водяному розчині визначають по питомій вазі й титруванням. Визначають пікнометром або ареометром. При визначенні титрування 10 мол випробуваного розчину наливають за допомогою бюретки в мірну колбу ємністю 200 мол; колбу доливають до мітки дистильованої води й розчин ретельно перемішують. Потім 5 мол отриманого розчину відбирають піпеткою й переносять у колбу для титрування, розбавляють дистильованою водою до 50 мол і титрують 0,1 Н розчином Н2SО4 з індикатором метілоранжом до рожевого відтінку. Зміст аміаку:
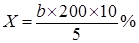
Суперфосфат застосовується в дріжджовому виробництві як джерело фосфору необхідного дріжджам у процесі росту. Використають водорозчинні солі фосфорної кислоти. По діючий ДСТу 8382 – 57 вологість доброякісність суперфосфату повинна бути не більше 13 %; зміст що засвоївся Р2О5 не менш 19 %. Повинен бути розсипчастим, що не злежується в щільні грудки.
Визначення змісту фтору: наявність водорозчинного фтору пригнічуючи діє на процес розмноження дріжджів, тому контроль за дотриманням норм має велике значення. Кількість фтору в середовищі дріжджі-вирощувального апарата не повинне перевищувати 0,001 %.
Сірчану кислоту застосовують для очищення засівних дріжджів від бактеріальної інфекції й для регулювання рН середовища при вирощуванні дріжджів. Використають сірчану кислоту акумуляторну (ДЕРЖСТАНДАРТ 667 - 53) і контрольний технічний поліпшений (ДЕРЖСТАНДАРТ 2184 - 59).
Кукурудзяний екстракт використають у виробництві як джерело активаторів росту. По діючий ВТУ 39 - 53 (П) кукурудзяний екстракт характеризується наступними показниками. По зовнішньому вигляді - густа непрозора рідина із пластівчастою суспензією, здатної відстоюватися. Зміст сухих речовин не менш 48 %, кислотність не більше 14 %, вільного сірчистого газу стосовно сухої речовини не більше 0,5 %. Гарний екстракт дозволяє збільшити вихід на 20 - 25 %.
1.4.5 Аналіз повітря подаваний у дріжджі-вирощувальний апарат
Для визначення кількості МО в повітрі, що подається в дріжджі-вирощувальні апарати, рекомендується метод пропущення певної кількості повітря через стерильну воду й потім посів цієї води в чашки Петрі для кількісного визначення МО, затриманих з повітря.
Для здійснення цього аналізу необхідний прилад, що складається з реометра й склянки Дрекселя із що приводить і відвідною трубками.
Реометр можна використати будь-якої марки, здатний пропускати 100 - 200 л повітря за 10 - 15 хв.
Якщо повітря, що вдмухує в апарати, добре очищений, то в ньому не повинне втримуватися ні цвілів, ні сторонніх дріжджових грибків. [17].
Дата: 2019-12-10, просмотров: 342.