Приход
Расход
Конвертированный газ
метан
окись углерода
двуокись углерода
водород
азот
аргон
пары воды
Всего конвертированного газа
74
4560
3126
998
5533
129
4036
18456
104
3647
1581
10985
4424
72
5018
25831
ТЕПЛОВОЙ РАСЧЕТ
Приход тепла.
С природным газом.
1Q=(1mCH4*1cCH4+1mC2H6*1cC2H6+1mN2*1cN2)*1t,
1Q=(3745*3,159+74*2,786+275*1,078)*600=7399200кдж/ч.
Здесь 1с – теплоемкость компонента при 600°С,кДж/кг*град.
Теплоемкость (см. список литературы 4, табл.I.стр.500)
С паром
2Q=2m*2i=4424*3706=16395344кдж/ч.
Здесь 2i – энтальпия паров воды при 600°С и 0,8*105 н/м2 (в кДж/г).
Общее давление паро-газовой смеси около 1,6*105н/м2,содержание паров воды в ней 50% по объему. Технический кислород и воздух поступают отдельно. Данные об энтальпии воды и паров воды при разных условиях см. в список литературы 4,табл XX и XXI,стр.513,514).
С воздухом
3Q=3mсух*3i=6931*46,47=322084 кдж/ч.
Здесь 3i – энтальпия влажного воздуха (в кДж/кг), вычисленная на 1 кг сухого воздуха при 20°С и относительной влажности 70% (см.список литературы 4,табл. XIX,стр.512).
С техническим кислородом
4Q=(4mО2*4cО2+4mN2*4cN2+4mAr*4cAr)*4t,
4Q=(2872*0,920+26*1,027+37*0,519)*40=107520кдж/ч.
Здесь 4cAr=0,519 кдж/кг*град – теплоемкость аргона (не зависит от температуры).
Тепло реакции.
Тепло реакций, происходящих в конвекторе метана, рассчитываем, исходя из следующих соображений. Принимаем, что реакция в основном протекает при температуре 30 град ниже, чем температура отходящих газов, т.е. при 800°С (830-30). Так как в процессе конверсии происходят параллельные реакции, учесть которые затруднительно, а тепловой эффект процесса зависит только от начального и конечного состояний системы, то расчет ведем по количеству прореагировавших веществ. Для этого рассчитываем энтальпию образования из элементов одного килограмма каждого вещества, участвующего в реакциях. Расчет производим по формуле
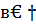 h298=
h298= 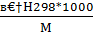 кдж/кг, [4,стр.25]
кдж/кг, [4,стр.25]
где 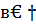 h298- энтальпия вещества при стандартных условиях, кДж/кг;
h298- энтальпия вещества при стандартных условиях, кДж/кг; 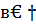 Н298-энтальпия вещества по таблицам, кДж/моль (Краткий справочник физико-химических величин, изд. 4. «Химия», 1965); 1000 – коэффициент пересчета килограммов в граммы, г/кг; М – мольная масса вещества, г/моль.
Н298-энтальпия вещества по таблицам, кДж/моль (Краткий справочник физико-химических величин, изд. 4. «Химия», 1965); 1000 – коэффициент пересчета килограммов в граммы, г/кг; М – мольная масса вещества, г/моль.
Энтальпии равны (в кДж/кг):
для метана
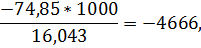
для этана
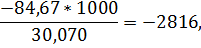
для окиси углерода
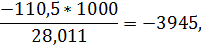
для двуокиси углерода
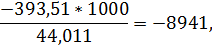
для паров воды
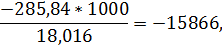
Согласно материальному балансу в процессе реакции расходуется (в кг/ч): метана 3745-74=3671, этана 74, кислорода 1607+2872=4479, паров воды 4424+72-4036=460.
При этом образуется (в кг/ч): окиси углерода 4560, двуокиси углерода 3126, водорода 998.
Для теплового эффекта при 25°С имеем
Q298= 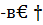 Н298-=(∑
Н298-=(∑ 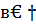 Нкон - ∑
Нкон - ∑ 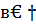 Ннач)=∑
Ннач)=∑ 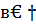 Ннач- ∑
Ннач- ∑ 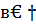 Нкон, [4,стр.26]
Нкон, [4,стр.26]
или
q298=∑ 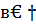 hнач*mнач=∑
hнач*mнач=∑ 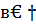 hкон*mкон,
hкон*mкон,
q298=-3671*4666-74*2816-4479*0-
-460*15866+4560*3945+998*0+3126*8941=21303136 кдж/ч.
Как известно из курса физической химии, тепловой эффект реакции при Т2 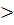 Т1 определяется уравнением
Т1 определяется уравнением
QТ2= QТ1+р(Т1- Т2)= QТ1+(∑ 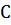 кон-∑
кон-∑ 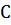 нач)(Т1-Т2)=
нач)(Т1-Т2)=
= QТ1-(∑ 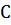 кон-∑
кон-∑ 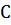 нач)(Т2-Т1), [4,стр.26]
нач)(Т2-Т1), [4,стр.26]
или
qt2= qt1-[∑(cm)кон-∑(cm)нач](t2-t1).
В приведенном расчете теплоемкости необходимо выразить в кДж/кг*град и взять средние в диапазоне 298-1073°К. Для расчета пользуемся интерполяцией табличных данных, которые приведены в «Кратком справочнике физико-химических величин» ( в кДж/моль*град).
Пересчет производим по формуле:
с= 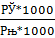 =
= 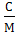 кдж/кг*град, [4,стр.26]
кдж/кг*град, [4,стр.26]
где с- теплоемкость, кдж/кг*град, С-теплоемкость, дж/моль*град; 1000 в числителе – коэффициент пересчета граммов в килограммы, г/кг; 1000 – в знаменателе – коэффициент пересчета джоулей в килоджоули, дж/кДж; М- мольная масса, г/моль.
Тогда (в кДж/кг*град)
для метана
с= 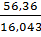 =3,513,
=3,513,
для этана
с= 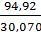 =3,157,
=3,157,
для кислорода
с= 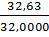 =1,020,
=1,020,
для паров воды
с= 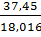 =2,079,
=2,079,
для окиси углерода
с= 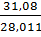 =1,110,
=1,110,
для двуокиси углерода
с= 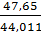 =1,083,
=1,083,
для водорода
с= 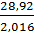 =14,345.
=14,345.
Отсюда
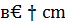 =4560*1,110+998*14,345+3126*1,083-3671*3,513-74*3,157-
=4560*1,110+998*14,345+3126*1,083-3671*3,513-74*3,157-
- 4479*1,020-460*2,079=4109кдж/град,
5Q=q298- 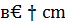 (t2-t1)=21303136-4109*(800-25)=
(t2-t1)=21303136-4109*(800-25)=
=21303136-3184475=18118661кдж/ч.
Общий приход тепла.
Qпр=7399200+16395344+322084+107520+18118661=42342809кдж/ч.
Расход тепла.
С конвертированным газом
6Q=(6mCH4*6cCH4+6mN2*6cN2+6mAr*6cAr+6mCО*6cCО+6mСО2*6cСО2+
+6mН2*6cН2)*6t+6mH2O*6iН2О,
6Q=(74*3,561+5533*1,105+129*0,519+4560*1,116+3126*1,099+
+998*14,690)*830+4036*4276=41850836кдж/ч.
Потери в окружающую среду (по разности)
7Q=Qпр-6Q=42342809-41850836=491973кдж/ч.
Таким образом, потери в окружающую среду составляют
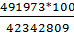 =1,2% от прихода тепла
=1,2% от прихода тепла
Табл.3
Дата: 2019-12-22, просмотров: 339.