Взаимодействие метана с водой протекает на никельсодержащем катализаторе и представлено двумя реакциями:
СН4+Н2О=СО+3Н2-Q1; (1)
СН4+Н2О=СО+3Н2+Q2; (2)
первая из которых – эндотермическая, вторая – экзотермическая. Влияние температуры на эти реакции различно: её повышение благоприятно скажется лишь на протекании первой. Поскольку сначала нужно обеспечить наиболее полное превращение метана, то температуру процесса целесообразно повышать. При этом равновесие второй реакции сдвинется влево. Конверсия метана протекает с увеличением объема, и следовательно, низкое давление будет способствовать более полному превращению метана.
Выбор давления в процессе конверсии метана. Итак, высокая температура и низкое давление термодинамически выгодны для конверсии метана. Но эти условия могут быть невыгодны для технологического процесса в целом. Конечная стадия - синтез аммиака - протекает при высоком давлении (30 МПа).
Затраты энергии пропорциональны объему газа. Если конверсию метана провести при термодинамически выгодных условиях – при атмосферном давлении, то в дальнейшем нужно будет сжать более пять объемов азотоводородной смеси. Энергетические затраты будут меньше, если конверсию провести при промежуточном давлении, сжимая один объем газа – только метан. Тогда энергия сжатия существенно уменьшится. Детальные техноэкономические расчеты показали, что на стадии конверсии оптимальным будет давление 4 МПа.
ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ ПОЛУЧЕНИЯ АЗОТО – ВОДОРОДНОЙ СМЕСИ ИЗ ПРИРОДНОГО ГАЗА
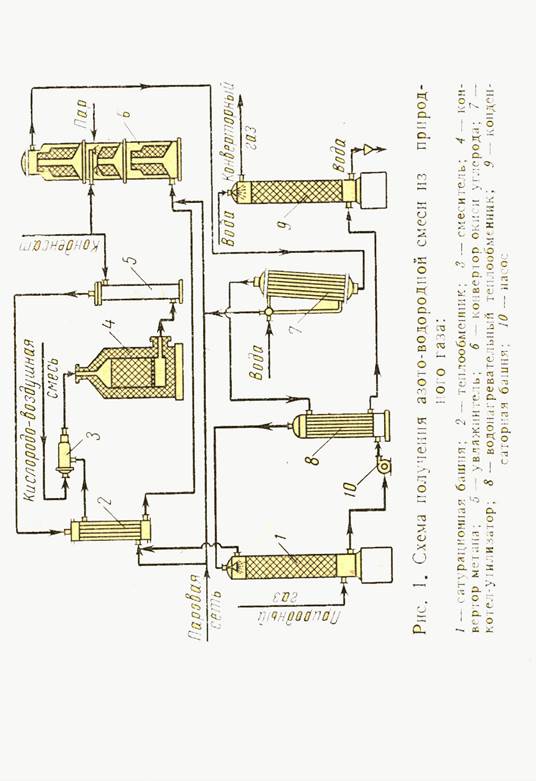
Одна из возможных схем переработки природного газа на азото – водородную смесь показана на рисунке 1. Природный газ в сатурационной башне 1 увлажняется и поступает в теплообменник 2, на входе в который к газу добавляется пар. Нагретая паро – газовая смесь поступает в смеситель 3, в котором к ней добавляется воздух и технический кислород. Затем смесь идет в конвектор метана 4. Горячий конвертируемый газ поступает в увлажнитель 5, а оттуда в теплообменник 2. Газ отдавший в теплообменнике избыток тепла, поступает в конвектор окиси углерода 6, на входе в конвектор к газу добавляется недостающее количество пара. После конвектора газ проходит в котел – утилизатор 7 и водонагревательный теплообменник 8. Охладившись в конденсаторной башне 9, газ поступает на очистку.
Очистка газа производится по разным технологическим схемам. По одной из них раньше всего освобождаются от соединений серы, причем основную часть этих соединений удаляют до конверсии метана, так как сернистые соединения отравляют применяемый катализатор. Затем удаляют двуокись углерода, для чего промывают газ под давлением. Кислород, попавший в газ при промывке, и кислород, содержащийся в азоте, добавляемом для точного соответствия стехиометрическому соотношению 3:1, удаляют вместе с остатками углекислого газа путем поглощения медно – аммиачным раствором или моноэтаноламином. Часто применяется тонкая очистка газа промывкой жидким азотом.
Получается аммиак по реакции:
N2+3H2=2NH3+92,38 кдж (3)
Промышленные системы синтеза аммиака разделяются на следующие группы: системы высокого давления (500 – 100ат) – 21% мирового производства; системы среднего давления (280 – 320ат) – 74%;
Наиболее экономичны системы среднего давления с использованием тепла синтеза аммиака для получения пара.
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Расчет производим на указанную в исходных данных производительность конвектора, то есть на 5500 нм3/ч природного газа.
Приближенный расчет производим в объемных единицах.
Приход.
1) Поступает природного газа 1v=5500нм3/ч, в том числе:
метана
1vCH4=1сСН4*1v=0,95*5500=5225нм3/ч,
(здесь и дальше 1сСН4 – содержание компонента в природном газе – в объемных долях),
этана
1vC2H6=1сСН4*1v=0,01*5500=55 нм3/ч,
азота
1vN2=1cN2*1v=0,04*5500=220 нм3/ч.
2) В конвектор метана подается воды (1:1)
2v=1v=5500 нм3/ч
3) Поступает сухого воздуха 3v нм3/ч, в том числе:
кислорода
3vО2=3сО2*3v=0,2099*3v,
азота
3vN2=3сN2*3v=0,7805*3v,
аргона
3vAr=3сAr*3v=0,0096*3v.
Плотность сухого воздуха при нормальных условиях 1,293 кг/м3, (см.литер.4 приложение XVIII,стр.510). Масса воздуха 1,293*3v кг/ч. В этом количестве воздуха при 3t=20°С, φ=70% и влагосодержание 3d=0,01042кг/кг сухого воздуха (см.литер.4 приложение XIX,стр.511) содержится паров воды
0,01042*1,293*3v кг/ч, или 0,01347*3v/0,8043=0,0167*3v нм3/ч.
4) Поступает технического кислорода 4v нм3/ч, в том числе:
кислорода
4vO2=4cO2*4v=0,98*4v,
азота
4vN2=4cN2*4v=0,01*4v,
аргона
4vAr=4cAr*4v=0,01*4v.
Расход.
1) Метан превращается в СО и Н2 не полностью. По условию степень конверсии метана 98%, то есть 2% поступившего метана переходит в отходящие газы. Таким образом, в отходящих газах метана содержится
6vCH4=0,02*1vCH4=0,02*5225=104 нм3/ч,
2) Азот, поступивший с природным газом, воздухом и техническим кислородом, полностью переходит в конвертированный газ, то есть
6vN2=1vN2+3vN2+4vN2=220+0,7805*3v+0,01*4v нм3/ч.
3) Аргон из воздуха и технического кислорода также переходит в конвертированный газ
6vAr=3vAr+4vAr=0,0096*3v+0,01*4v нм3/ч.
4) Кроме метана, азота и аргона, в конвертированных газах содержится водорода 6vН2 нм3/ч, окиси углерода 6vСО нм3/ч, двуокиси углерода 6vСО2 нм3/ч, паров воды 6vН2О нм3/ч.
При расчете необходимо найти шесть неизвестных
3v, 4v, 6vН2, 6vСО, 6vСО2, 6vН2О.
Составляем систему из шести уравнений.
По материальному балансу углерода имеем
1vCH4+2*1vC2H6=6vCH4+6vСО+6vСО2,
где 2*1vC2H6 означает что из 1 моль этана образуется 2 моль СО или СО2.
Отсюда
5225+2*55=104+6vСО+6vСО2,
5231-6vСО-6vСО2=0
По материальному балансу водорода имеем
2*1vCH4+3*1vC2H6+2v+3vH2O=2*6vCH4+6vH2+6vН2О,
где 2*1vCH4 и 2*6vCH4 означает что из 1 моль метана образуются 2 моль водорода, 3*1vCH4 – из 1 моль этана 3 моль водорода.
2*5225+3*55+5500+0,0167*3v-2*104-6vH2-6vН2О=0,
15907+0,0167*3v-6vH2-6vН2О=0.
По материальному балансу кислорода имеем
0,5*2v+3vО2+0,5*3vН2O+4vО2=0,5*6vCО+6vСО2+0,5*6vН2О,
0,5*5500+0,2099*3v+0,5*0,0167*3v+0,98*4v-0,5*6vCО-6vСО2-0,5*6vН2О=0,
2750+0,2182*3v+0,98*4v-0,5*6vCО-6vСО2-0,5*6vН2О=0.
Кроме этого, по условию общий объем кислорода составляет 0,6 объема метана, поступающего в конвектор
3vO2+4vO2=0,6*1vСН4,
Отсюда
0,2099*3v+0,98*4v=0,6*5225,
0,2099*3v+0,98*4v-3135=0.
Суммарный объем окиси углерода и водорода по условию должен быть в 3,3 раза больше, чем объем азота. Отсюда
6vСО+6vН2=3,3*1vN2=3,3*(220+0,7805*3v+0,01*4v)=
=726+2,5756*3v+0,033*4v,
Отсюда
6vСО+6vН2-726-2,5756*3v-0,033*4v=0.
Кроме этого, объемы газов связаны выражением для константы равновесия реакции конверсии окиси углерода. Для этой реакции константа может быть выражена так
Кр= 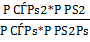 =
= 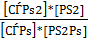 =Кс [4,стр.13]
=Кс [4,стр.13]
Так как для любого газа в смеси справедливо уравнение
Pi=Робщ 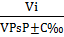 [4,стр.13]
[4,стр.13]
то заменяем в выражении для константы Рi через vi
Робщ  * Робщ*
* Робщ* 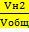 vCO2*vH2
vCO2*vH2
Робщ  * Робщ*
* Робщ*  vCO*vH2O
vCO*vH2O
Константой равновесия, выраженной через объем газов, мы будем пользоваться и в дальнейших расчетах.
Для определения значения константы равновесия К можно взять следующее уравнение
lgK= 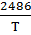 +1,565*lgT-0,066*10-3*Т-
+1,565*lgT-0,066*10-3*Т- 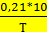 -6,93 [4,стр.14]
-6,93 [4,стр.14]
Отсюда для температуры 830°С, или 830+273=1103°К, находим:
lgK= 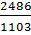 +1,565*lg1103-0,066*10-3*1103-
+1,565*lg1103-0,066*10-3*1103- 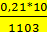 -6,93=-0,0046; К=0,9265
-6,93=-0,0046; К=0,9265
Таким образом,
vCO2*vH2
vCO*vH2O
Отсюда
6vСО2 *6vН2=0,9265*6vСО *6vН2О,
6vСО2 *6vН2 -0,9265*6vСО *6vН2О =0.
Получена система из 6 уравнений:
1) 5231-6vСО-6vСО2=0.
2) 15907+0,0167*3v-6vH2-6vН2О=0.
3) 2750+0,2182*3v+0,98*4v-0,5*6vCО-6vСО2-0,5*6vН2О=0.
4) 6vСО+6vН2-726-2,5756*3v-0,033*4v=0.
5) 0,2099*3v+0,98*4v-3135=0.
6) 6vСО2 *6vН2 -0,9265*6vСО *6vН2О =0.
Из 1-го уравнения находим 6vСО2=5231-6vСО. Подставим это выражение в последующие уравнения
2) 15907+0,0167*3v-6vH2-6vН2О=0.
3) -2481+0,2182*3v+0,98*4v+0,5*6vCО-0,5*6vН2О=0.
4) 6vСО+6vН2-726-2,5756*3v-0,033*4v=0.
5) 0,2099*3v+0,98*4v-3135=0.
6) (5231-6vСО) *6vН2 -0,9265*6vСО *6vН2О =0.
Из 2-го уравнения находим 6vH2=15907+0,0167*3v-6vН2О. Подставляем полученное выражение в последующие уравнения. Умножив 3-е уравнение на 2 (для сокращения лишних дробей), имеем
3) -4962+0,4364*3v+1,96*4v+6vCО-6vН2О=0.
4) 6vСО+15181-2,5589*3v-0,033*4v-6vН2О =0.
5) 0,2099*3v+0,98*4v-3135=0.
6) (5231-6vСО) *(15907+0,0167*3v-6vН2О) -0,9265*6vСО *6vН2О =0.
Из 3-го уравнения находим
6vН2О=6vCО+1,96*4v+0,4364*3v-4962.
Подставим полученное выражение в последующие уравнения
4)20143-2,9953*3v-1,993*4v=0.
5) 0,2099*3v+0,98*4v-3135=0.
6)(5231-6vСО)*(20869-0,4197*3v-1,96*4v-6vCО)-
-0,9265*(6vСО+1,96*4v+0,4364*3v-4962) *6vCО =0.
При решении системы произошло сокращение одного неизвестного 6vCО в 4-м уравнении, в результате 4-е и 5-е уравнение содержат всего по 2 неизвестных 3v и 4v. Решая систему из двух уравнений 4 и 5, находим значения неизвестных.
Определяем 4v из 5-го уравнения
4v=3135-0,2099*3v/0,98=3199-0,2142*3v
Подставляем найденное значение 4v в 4-е уравнение
13767,4-2,5684*3v, 3v=5360 нм3/ч,
4v= 3199-0,2142*5360=2051нм3/ч.
Далее значения 3v и 4v подставляем в 6-е уравнение:
(5231-6vСО)*(20869-0,4197*5360-1,96*2051-6vCО)-0,9265*6vСО*
*(6vСО +1,96*2051+0,4364*5360-4962)=0
Отсюда
(5231-6vСО)*(14600-6vCО)-0,9265*6vСО*(6vСО +1397)=0
76372600-5231*6vСО-14600*6vСО+6v 2СО-0,92656v 2СО-1294*6vСО=0
После приведения подобных членов имеем:
76372600-21125*6vСО+0,0735*6v 2СО=0
Делим на коэффициент при 6v 2СО, т.е. на 0,0735
6v 2СО-2874156vСО+1039082993=0
Отсюда 6vСО=+ 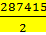 +
+  +140060
+140060
Таким образом получено два ответа:
а) 6vСО=143707-140060=3647 нм3/ч
б) 6vСО=143707+140060=283767 нм3/ч
Второй ответ явно не реальный, так как получающийся объем СО больше суммарного объема всех поступающих газов в 15 раз. Следовательно, объем окиси углерода в конвертированном газе 3647 нм3/ч.
Подставим полученные значения в выражения для объема паров воды:
6vН2О=6vCО+1,96*4v+0,4364*3v-4962=3647+1,96*2051+0,4364*5360-
-4962 =5044 нм3/ч
Находим объем водорода:
6vH2=15907+0,0167*3v-6vН2О=15907+0,0167*5360-5044=10952 нм3/ч
Для определения объема двуокиси углерода подставляем полученные данные в выражение, выведенное из 1-го уравнения:
6vСО2=5231-6vСО =5231-3647=1584 нм3/ч
Полученные числа необходимо проверить, т.е. ввести их в первоначальные выражения. Баланс углерода принимает следующий вид:
приход
5225+2*55=5335 нм3/ч
расход
104+3647+1584=5335 нм3/ч
Баланс водорода:
приход
2*5225+3*55+5500+0,0167*5360=16204 нм3/ч
расход
2*104+10952+5044=16204 нм3/ч
Баланс кислорода:
приход
0,5*5500+0,2099*5360+0,5*0,0167*5360+0,98*2051=5930 нм3/ч
расход
0,5*3647+1584+0,5*5044=5930 нм3/ч
Объем свободного кислорода составляет:
0,2099*5360+0,98*2051=3135 нм3/ч
Это составляет 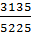 =0,6 от объема поступившего метана, что соответствует условиям.
=0,6 от объема поступившего метана, что соответствует условиям.
Суммарный объем окиси углерода и водорода
3647+10952=14599 нм3/ч
Объем азота в отходящих газах находим по равенству
6vN2=220+0,7805*5360+0,01*2051=4423 нм3/ч
Сумма объемов окиси углерода и водорода в 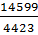 =3,3 раза больше, чем объем азота, что соответствует условию.
=3,3 раза больше, чем объем азота, что соответствует условию.
Наконец, для константы равновесия имеем
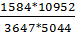 =0,9268
=0,9268
т.е. и в этом случае условие выполнено.
Из результатов проверки следует, что математические вычисления проведены правильно.
Для составления материально баланса необходимо пересчитать объемы газов на массы. Если для такого расчета использовать фактические значения плотностей газов при нормальных условиях, то материальные балансы, выраженные в килограммах, свести нельзя. Это объясняется тем, что весь вышеприведенный расчет основан на применении законов идеальных газов. Чтобы соблюсти равенство масс, необходимо пользоваться не фактической, а расчетной плотностью газов, вычисляемой по уравнению
рвыч= 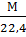 [4,стр.18]
[4,стр.18]
где рвыч – вычисленная плотность, кг/нм3; М – масса 1 кмоль газа, кг/кмоль; 22,4 – объем 1 кмоль идеального газа при нормальных условиях, нм3/кмоль.
Получаем следующие вычисленные плотности газов (кг/нм3):
рН2= 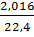 =0,0900, р С2Н6=
=0,0900, р С2Н6= 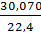 =1,3424,
=1,3424,
рО2= 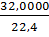 =1,4286, рСО=
=1,4286, рСО= 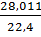 =1,2505,
=1,2505,
рAr= 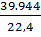 =1,7832, рСО2=
=1,7832, рСО2= 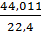 =1,9648,
=1,9648,
рN2= 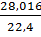 =1,2507, рН2О=
=1,2507, рН2О= 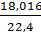 =0,8043,
=0,8043,
рСН4= 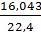 =0,7162.
=0,7162.
Пользуясь полученными плотностями пересчитываем объемы на массы и составляем таблицу материального баланса.
Приход.
Природный газ:
метан
1mСН4=1vCH4*pCH4=5225*0,7168=3745 кг/ч,
этан
1mС2Н6=1vC2H6*pC2H6=55*1,356=74кг/ч,
азот
1mN2=1vN2*pN2=220*1,25055=275кг/ч.
Общая масса природного газа
1m=3745+74+275=4094кг/ч,
Водяной пар
2m=2v*pH2О=5500*0,8043=4424кг/ч,
Воздух:
кислород
3mО2=3vО2*pО2=0,2099*3v*pО2=0,2099*5360*1,42895=1607кг/ч,
азот
3mN2=0,7805*5360*1,25055=5232кг/ч,
аргон
3mAr2=0,0096*5360*1,7837=92кг/ч,
Общая масса сухого воздуха
3mсух=1607+5232+92=6931кг/ч.
Влага воздуха. Влагосодержание воздуха, как указано выше, равна 0,01042 кг/кг сухого воздуха:
3mН2О=3mсух*3d=6931*0,01042=72кг/ч.
Масса влажного воздуха 3mвл=6931+72=7003кг/ч.
Технический кислород:
кислород
4mО2=4vО2*pО2=0,98*4v*pО2=0,98*2051*1,42895=2872кг/ч,
азот
4mN2=4vN2*pN2=0,01*2051*1,25055=26кг/ч,
аргон
3mAr=4vAr*pAr=0,01*2051*1,7837=37кг/ч,
Масса технического кислорода
4m=2872+26+37=2935кг/ч.
Расход.
метан
6mСН4=6vCH4*pCH4=104*0,7168=74 кг/ч,
азот
6mN2=1mN2+3mN2+4mN2=275+5232+26=5533кг/ч,
6mAr=3mAr+4mAr=92+37=129кг/ч,
Окись углерода
6mСО=6vСО*pСО=33647*1,2504=4560кг/ч.
Кроме метана, азота, аргона и окиси углерода, из аппарата выводятся двуокись углерода, водород и пары воды. Для определения количеств этих газов необходимо составить уравнения материального баланса по каждому элементу в отдельности.
Для упрощения дальнейших расчетов составляем таблицу содержания отдельных элементов в их соединениях (в долях единиц).
Табл.1
| Соединение | Элементы | ||
| углерод | водород | кислород | |
| Метан | 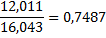
| 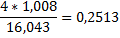
| - |
| Этан | 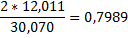
| 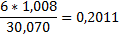
| - |
| Двуокись углерода | 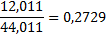
| - | 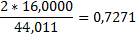
|
| Окись углерода | 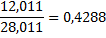
| - | 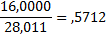
|
| Вода | - | 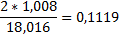
| 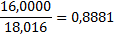
|
Материальный баланс углерода
1mCH4*0,7487+1m C2H6*0,7989=6mCH4*0,7487+6m CО*0,4288+6m CО2*0,2729,
3745*,7487+74*0,7989=74*0,7487+4560*0,4288+6m CО2*0,2729,
853=6m CО2*0,2729, 6m CО2=3126кг/ч.
Материальный баланс кислорода
2m*0,8881+3mО2*+3mН2О*0,8881+4mО2=6mCО*0,5712+6mCО2*0,7271+
+6mН2О*0,8881,
4424*0,8881+1607+72*0,8881+2872=4560*0,5712+3126*0,7271+
+6mН2О*0,8881,
3594=6mН2О*0,8881, 6mН2О=4036кг/ч
Материальный баланс водорода
mCH4*0,2513+1mC2H6*0,2011+2m*0,1119+3mН2О*0,1119=6mCH4*0,2513+
+6mН2О*0,1119+6mН2,
3745*0,2513+74*0,2011+4424*0,1119+72*0,1119=74*0,1119+
+4036*0,1119+6mН2,
6mН2=998кг/ч.
Соответственно объемы составляют (в нм3/ч)
6vCO2= 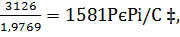
6vН2O= 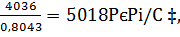
6vН2= 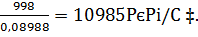
Проверка правильности расчета производится составлением сводной таблицы материального баланса (табл.2) и подстановкой объемов газов в выражение константы равновесия
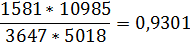
Полученная величина практически соответствует заданной.
Табл. 2
Дата: 2019-12-22, просмотров: 343.