МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ОТКРЫТЫЙ УНИВЕРСИТЕТ
ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА ТЕХНОЛОГИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ И ОБЩЕЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
КУРСОВОЙ ПРОЕКТ ПО ДИСЦИПЛИНЕ:
«ТЕХНОЛОГИЯ ХИМИЧЕСКИХ ПРОИЗВОДСТВ»
На тему: «ОТДЕЛЕНИЕ ОДНОСТУПЕНЧАТОЙ КАТАЛИТИЧЕСКОЙ ПАРОВОЗДУШНО-КИСЛОРОДНОЙ КОНВЕРСИИ МЕТАНА»
ВЫПОЛНИЛА:
ст-ка IV курса
Специальность: «080502-с»
Шифр:407201
Комарькова С.В.
ПРОВЕРИЛА:
Тарчигина Н.Ф.
Москва 2010 г.
СОДЕРЖАНИЕ
лист
1.Задание…………………………………………………………………………..3
2.Введение…………………………………………………………………………4
3.Промышленные методы производства синтетического аммиака и их технико-экономическая оценка…………………………………………………..5
4.Физико-химические свойства процесса……………………………………….8
5.Описание технологической схемы получения азото - водородной смеси из природного газа…………………………………………………………………...9
6.Материальный расчет……………………………………………...………….11
7.Тепловой расчет……………………………………………………………….22
8. Аппаратурно-технологическое оформление конверсии метана..…………27
9.Отходы и выбросы данного технологического производства……………...29
10.Техника безопасности..………………………………………………………31
11.Список литературы..…………………………………………………………32
ЗАДАНИЕ
Выполнить материальный расчет и отразить графически. По следующим данным:
Отделение одноступенчатой каталитической паровоздушно-кислородной конверсии метана; представительный аппарат – шахтный конвектор.
Производительность отделения по природному газу составляет 5500нм3/ч;
Состав природного газа
Метан – 95%
Этан – 1%
Азот – 4%
Объемное отношение пара и газа на входе в конвектор метана 1:1
Температура парогазовой смеси на входе в конвектор 600°С
Температура газовой смеси на выходе из конвектора 830°С
Степень конверсии метана 98%
Состав кислородно-воздушной смеси,
воздух об.% 65%
Кислород 35%
Состав воздуха об.%
Азот 78,005%
Кислород 20,99%
Аргон 0,96%
Состав технического кислорода об.% 98%
Азот 1%
Аргон 1%
Соотношение метана и кислорода на входе ( по объему) 1:6
Давление в конвекторе (н/м2) 1,7*105
Состав конвертированного газа соответствует равновесному составу конвертированной окиси углерода водяным паром (Н2, СО2, Н2О) при 830°С.
ВВЕДЕНИЕ
Синтетический аммиак и продукты, получаемые на его основе, имеют исключительно важное значение в развитии многих отраслей промышленности и особенно в поднятии урожайности сельскохозяйственных культур. Аммиак применяется для получения азотной кислоты, аммиачной селитры, мочевины, сульфата аммония, жидких удобрений, используется в холодильной технике, медицине и других отраслях народного хозяйства.
Основным сырьем для получения синтетического аммиака являются азот и водород, получаемые разными методами из различного сырья. Экономически наиболее выгодно получение смеси азота и водорода (синтез – газ) из природного газа или из попутных газов нефтяной промышленности.
Природный газ представляет собой смесь, состав которой колеблется в довольно широких пределах в зависимости от месторождения газа. Однако вне зависимости от месторождения основным компонентом является метан, содержание которого изменяется от 78 до 98%. Поэтому при изучении путей использования природного газа будем рассматривать его как метан.
Получить водород из метана можно тремя способами:
-конверсией с водяным паром;
-конверсией с углекислым газом;
-неполным окислением кислородом.
В том случае когда конверсию метана проводят водяным паром, нужно компенсировать расход тепла на реакцию, а азот, необходимый для синтеза аммиака, вводить извне. При конверсии углекислым газом расход тепла еще больше, а азот также нужно вводить извне. При неполном окислении метана кислородом тепло выделяется, а азот можно подавать в составе воздуха. Тепла выделяется столько, что возникает необходимость отвода его избытка.
В данном курсовом проекте рассматривается потенциальная схема синтеза аммиака, включающая в себя одноступенчатую конверсию метана водяным паром. Используемый аппарат – шахтный конвектор.
МАТЕРИАЛЬНЫЙ РАСЧЕТ
Расчет производим на указанную в исходных данных производительность конвектора, то есть на 5500 нм3/ч природного газа.
Приближенный расчет производим в объемных единицах.
Приход.
1) Поступает природного газа 1v=5500нм3/ч, в том числе:
метана
1vCH4=1сСН4*1v=0,95*5500=5225нм3/ч,
(здесь и дальше 1сСН4 – содержание компонента в природном газе – в объемных долях),
этана
1vC2H6=1сСН4*1v=0,01*5500=55 нм3/ч,
азота
1vN2=1cN2*1v=0,04*5500=220 нм3/ч.
2) В конвектор метана подается воды (1:1)
2v=1v=5500 нм3/ч
3) Поступает сухого воздуха 3v нм3/ч, в том числе:
кислорода
3vО2=3сО2*3v=0,2099*3v,
азота
3vN2=3сN2*3v=0,7805*3v,
аргона
3vAr=3сAr*3v=0,0096*3v.
Плотность сухого воздуха при нормальных условиях 1,293 кг/м3, (см.литер.4 приложение XVIII,стр.510). Масса воздуха 1,293*3v кг/ч. В этом количестве воздуха при 3t=20°С, φ=70% и влагосодержание 3d=0,01042кг/кг сухого воздуха (см.литер.4 приложение XIX,стр.511) содержится паров воды
0,01042*1,293*3v кг/ч, или 0,01347*3v/0,8043=0,0167*3v нм3/ч.
4) Поступает технического кислорода 4v нм3/ч, в том числе:
кислорода
4vO2=4cO2*4v=0,98*4v,
азота
4vN2=4cN2*4v=0,01*4v,
аргона
4vAr=4cAr*4v=0,01*4v.
Расход.
1) Метан превращается в СО и Н2 не полностью. По условию степень конверсии метана 98%, то есть 2% поступившего метана переходит в отходящие газы. Таким образом, в отходящих газах метана содержится
6vCH4=0,02*1vCH4=0,02*5225=104 нм3/ч,
2) Азот, поступивший с природным газом, воздухом и техническим кислородом, полностью переходит в конвертированный газ, то есть
6vN2=1vN2+3vN2+4vN2=220+0,7805*3v+0,01*4v нм3/ч.
3) Аргон из воздуха и технического кислорода также переходит в конвертированный газ
6vAr=3vAr+4vAr=0,0096*3v+0,01*4v нм3/ч.
4) Кроме метана, азота и аргона, в конвертированных газах содержится водорода 6vН2 нм3/ч, окиси углерода 6vСО нм3/ч, двуокиси углерода 6vСО2 нм3/ч, паров воды 6vН2О нм3/ч.
При расчете необходимо найти шесть неизвестных
3v, 4v, 6vН2, 6vСО, 6vСО2, 6vН2О.
Составляем систему из шести уравнений.
По материальному балансу углерода имеем
1vCH4+2*1vC2H6=6vCH4+6vСО+6vСО2,
где 2*1vC2H6 означает что из 1 моль этана образуется 2 моль СО или СО2.
Отсюда
5225+2*55=104+6vСО+6vСО2,
5231-6vСО-6vСО2=0
По материальному балансу водорода имеем
2*1vCH4+3*1vC2H6+2v+3vH2O=2*6vCH4+6vH2+6vН2О,
где 2*1vCH4 и 2*6vCH4 означает что из 1 моль метана образуются 2 моль водорода, 3*1vCH4 – из 1 моль этана 3 моль водорода.
2*5225+3*55+5500+0,0167*3v-2*104-6vH2-6vН2О=0,
15907+0,0167*3v-6vH2-6vН2О=0.
По материальному балансу кислорода имеем
0,5*2v+3vО2+0,5*3vН2O+4vО2=0,5*6vCО+6vСО2+0,5*6vН2О,
0,5*5500+0,2099*3v+0,5*0,0167*3v+0,98*4v-0,5*6vCО-6vСО2-0,5*6vН2О=0,
2750+0,2182*3v+0,98*4v-0,5*6vCО-6vСО2-0,5*6vН2О=0.
Кроме этого, по условию общий объем кислорода составляет 0,6 объема метана, поступающего в конвектор
3vO2+4vO2=0,6*1vСН4,
Отсюда
0,2099*3v+0,98*4v=0,6*5225,
0,2099*3v+0,98*4v-3135=0.
Суммарный объем окиси углерода и водорода по условию должен быть в 3,3 раза больше, чем объем азота. Отсюда
6vСО+6vН2=3,3*1vN2=3,3*(220+0,7805*3v+0,01*4v)=
=726+2,5756*3v+0,033*4v,
Отсюда
6vСО+6vН2-726-2,5756*3v-0,033*4v=0.
Кроме этого, объемы газов связаны выражением для константы равновесия реакции конверсии окиси углерода. Для этой реакции константа может быть выражена так
Кр= 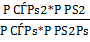 =
= 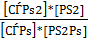 =Кс [4,стр.13]
=Кс [4,стр.13]
Так как для любого газа в смеси справедливо уравнение
Pi=Робщ 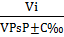 [4,стр.13]
[4,стр.13]
то заменяем в выражении для константы Рi через vi
Робщ  * Робщ*
* Робщ* 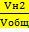 vCO2*vH2
vCO2*vH2
Робщ  * Робщ*
* Робщ*  vCO*vH2O
vCO*vH2O
Константой равновесия, выраженной через объем газов, мы будем пользоваться и в дальнейших расчетах.
Для определения значения константы равновесия К можно взять следующее уравнение
lgK= 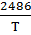 +1,565*lgT-0,066*10-3*Т-
+1,565*lgT-0,066*10-3*Т- 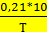 -6,93 [4,стр.14]
-6,93 [4,стр.14]
Отсюда для температуры 830°С, или 830+273=1103°К, находим:
lgK= 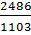 +1,565*lg1103-0,066*10-3*1103-
+1,565*lg1103-0,066*10-3*1103- 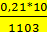 -6,93=-0,0046; К=0,9265
-6,93=-0,0046; К=0,9265
Таким образом,
vCO2*vH2
vCO*vH2O
Отсюда
6vСО2 *6vН2=0,9265*6vСО *6vН2О,
6vСО2 *6vН2 -0,9265*6vСО *6vН2О =0.
Получена система из 6 уравнений:
1) 5231-6vСО-6vСО2=0.
2) 15907+0,0167*3v-6vH2-6vН2О=0.
3) 2750+0,2182*3v+0,98*4v-0,5*6vCО-6vСО2-0,5*6vН2О=0.
4) 6vСО+6vН2-726-2,5756*3v-0,033*4v=0.
5) 0,2099*3v+0,98*4v-3135=0.
6) 6vСО2 *6vН2 -0,9265*6vСО *6vН2О =0.
Из 1-го уравнения находим 6vСО2=5231-6vСО. Подставим это выражение в последующие уравнения
2) 15907+0,0167*3v-6vH2-6vН2О=0.
3) -2481+0,2182*3v+0,98*4v+0,5*6vCО-0,5*6vН2О=0.
4) 6vСО+6vН2-726-2,5756*3v-0,033*4v=0.
5) 0,2099*3v+0,98*4v-3135=0.
6) (5231-6vСО) *6vН2 -0,9265*6vСО *6vН2О =0.
Из 2-го уравнения находим 6vH2=15907+0,0167*3v-6vН2О. Подставляем полученное выражение в последующие уравнения. Умножив 3-е уравнение на 2 (для сокращения лишних дробей), имеем
3) -4962+0,4364*3v+1,96*4v+6vCО-6vН2О=0.
4) 6vСО+15181-2,5589*3v-0,033*4v-6vН2О =0.
5) 0,2099*3v+0,98*4v-3135=0.
6) (5231-6vСО) *(15907+0,0167*3v-6vН2О) -0,9265*6vСО *6vН2О =0.
Из 3-го уравнения находим
6vН2О=6vCО+1,96*4v+0,4364*3v-4962.
Подставим полученное выражение в последующие уравнения
4)20143-2,9953*3v-1,993*4v=0.
5) 0,2099*3v+0,98*4v-3135=0.
6)(5231-6vСО)*(20869-0,4197*3v-1,96*4v-6vCО)-
-0,9265*(6vСО+1,96*4v+0,4364*3v-4962) *6vCО =0.
При решении системы произошло сокращение одного неизвестного 6vCО в 4-м уравнении, в результате 4-е и 5-е уравнение содержат всего по 2 неизвестных 3v и 4v. Решая систему из двух уравнений 4 и 5, находим значения неизвестных.
Определяем 4v из 5-го уравнения
4v=3135-0,2099*3v/0,98=3199-0,2142*3v
Подставляем найденное значение 4v в 4-е уравнение
13767,4-2,5684*3v, 3v=5360 нм3/ч,
4v= 3199-0,2142*5360=2051нм3/ч.
Далее значения 3v и 4v подставляем в 6-е уравнение:
(5231-6vСО)*(20869-0,4197*5360-1,96*2051-6vCО)-0,9265*6vСО*
*(6vСО +1,96*2051+0,4364*5360-4962)=0
Отсюда
(5231-6vСО)*(14600-6vCО)-0,9265*6vСО*(6vСО +1397)=0
76372600-5231*6vСО-14600*6vСО+6v 2СО-0,92656v 2СО-1294*6vСО=0
После приведения подобных членов имеем:
76372600-21125*6vСО+0,0735*6v 2СО=0
Делим на коэффициент при 6v 2СО, т.е. на 0,0735
6v 2СО-2874156vСО+1039082993=0
Отсюда 6vСО=+ 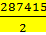 +
+  +140060
+140060
Таким образом получено два ответа:
а) 6vСО=143707-140060=3647 нм3/ч
б) 6vСО=143707+140060=283767 нм3/ч
Второй ответ явно не реальный, так как получающийся объем СО больше суммарного объема всех поступающих газов в 15 раз. Следовательно, объем окиси углерода в конвертированном газе 3647 нм3/ч.
Подставим полученные значения в выражения для объема паров воды:
6vН2О=6vCО+1,96*4v+0,4364*3v-4962=3647+1,96*2051+0,4364*5360-
-4962 =5044 нм3/ч
Находим объем водорода:
6vH2=15907+0,0167*3v-6vН2О=15907+0,0167*5360-5044=10952 нм3/ч
Для определения объема двуокиси углерода подставляем полученные данные в выражение, выведенное из 1-го уравнения:
6vСО2=5231-6vСО =5231-3647=1584 нм3/ч
Полученные числа необходимо проверить, т.е. ввести их в первоначальные выражения. Баланс углерода принимает следующий вид:
приход
5225+2*55=5335 нм3/ч
расход
104+3647+1584=5335 нм3/ч
Баланс водорода:
приход
2*5225+3*55+5500+0,0167*5360=16204 нм3/ч
расход
2*104+10952+5044=16204 нм3/ч
Баланс кислорода:
приход
0,5*5500+0,2099*5360+0,5*0,0167*5360+0,98*2051=5930 нм3/ч
расход
0,5*3647+1584+0,5*5044=5930 нм3/ч
Объем свободного кислорода составляет:
0,2099*5360+0,98*2051=3135 нм3/ч
Это составляет 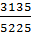 =0,6 от объема поступившего метана, что соответствует условиям.
=0,6 от объема поступившего метана, что соответствует условиям.
Суммарный объем окиси углерода и водорода
3647+10952=14599 нм3/ч
Объем азота в отходящих газах находим по равенству
6vN2=220+0,7805*5360+0,01*2051=4423 нм3/ч
Сумма объемов окиси углерода и водорода в 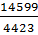 =3,3 раза больше, чем объем азота, что соответствует условию.
=3,3 раза больше, чем объем азота, что соответствует условию.
Наконец, для константы равновесия имеем
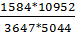 =0,9268
=0,9268
т.е. и в этом случае условие выполнено.
Из результатов проверки следует, что математические вычисления проведены правильно.
Для составления материально баланса необходимо пересчитать объемы газов на массы. Если для такого расчета использовать фактические значения плотностей газов при нормальных условиях, то материальные балансы, выраженные в килограммах, свести нельзя. Это объясняется тем, что весь вышеприведенный расчет основан на применении законов идеальных газов. Чтобы соблюсти равенство масс, необходимо пользоваться не фактической, а расчетной плотностью газов, вычисляемой по уравнению
рвыч= 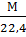 [4,стр.18]
[4,стр.18]
где рвыч – вычисленная плотность, кг/нм3; М – масса 1 кмоль газа, кг/кмоль; 22,4 – объем 1 кмоль идеального газа при нормальных условиях, нм3/кмоль.
Получаем следующие вычисленные плотности газов (кг/нм3):
рН2= 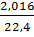 =0,0900, р С2Н6=
=0,0900, р С2Н6= 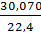 =1,3424,
=1,3424,
рО2= 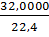 =1,4286, рСО=
=1,4286, рСО= 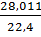 =1,2505,
=1,2505,
рAr= 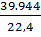 =1,7832, рСО2=
=1,7832, рСО2= 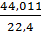 =1,9648,
=1,9648,
рN2= 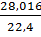 =1,2507, рН2О=
=1,2507, рН2О= 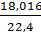 =0,8043,
=0,8043,
рСН4= 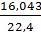 =0,7162.
=0,7162.
Пользуясь полученными плотностями пересчитываем объемы на массы и составляем таблицу материального баланса.
Приход.
Природный газ:
метан
1mСН4=1vCH4*pCH4=5225*0,7168=3745 кг/ч,
этан
1mС2Н6=1vC2H6*pC2H6=55*1,356=74кг/ч,
азот
1mN2=1vN2*pN2=220*1,25055=275кг/ч.
Общая масса природного газа
1m=3745+74+275=4094кг/ч,
Водяной пар
2m=2v*pH2О=5500*0,8043=4424кг/ч,
Воздух:
кислород
3mО2=3vО2*pО2=0,2099*3v*pО2=0,2099*5360*1,42895=1607кг/ч,
азот
3mN2=0,7805*5360*1,25055=5232кг/ч,
аргон
3mAr2=0,0096*5360*1,7837=92кг/ч,
Общая масса сухого воздуха
3mсух=1607+5232+92=6931кг/ч.
Влага воздуха. Влагосодержание воздуха, как указано выше, равна 0,01042 кг/кг сухого воздуха:
3mН2О=3mсух*3d=6931*0,01042=72кг/ч.
Масса влажного воздуха 3mвл=6931+72=7003кг/ч.
Технический кислород:
кислород
4mО2=4vО2*pО2=0,98*4v*pО2=0,98*2051*1,42895=2872кг/ч,
азот
4mN2=4vN2*pN2=0,01*2051*1,25055=26кг/ч,
аргон
3mAr=4vAr*pAr=0,01*2051*1,7837=37кг/ч,
Масса технического кислорода
4m=2872+26+37=2935кг/ч.
Расход.
метан
6mСН4=6vCH4*pCH4=104*0,7168=74 кг/ч,
азот
6mN2=1mN2+3mN2+4mN2=275+5232+26=5533кг/ч,
6mAr=3mAr+4mAr=92+37=129кг/ч,
Окись углерода
6mСО=6vСО*pСО=33647*1,2504=4560кг/ч.
Кроме метана, азота, аргона и окиси углерода, из аппарата выводятся двуокись углерода, водород и пары воды. Для определения количеств этих газов необходимо составить уравнения материального баланса по каждому элементу в отдельности.
Для упрощения дальнейших расчетов составляем таблицу содержания отдельных элементов в их соединениях (в долях единиц).
Табл.1
| Соединение | Элементы | ||
| углерод | водород | кислород | |
| Метан | 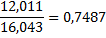
| 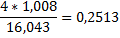
| - |
| Этан | 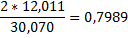
| 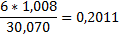
| - |
| Двуокись углерода | 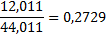
| - | 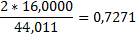
|
| Окись углерода | 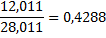
| - | 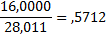
|
| Вода | - | 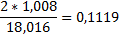
| 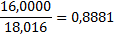
|
Материальный баланс углерода
1mCH4*0,7487+1m C2H6*0,7989=6mCH4*0,7487+6m CО*0,4288+6m CО2*0,2729,
3745*,7487+74*0,7989=74*0,7487+4560*0,4288+6m CО2*0,2729,
853=6m CО2*0,2729, 6m CО2=3126кг/ч.
Материальный баланс кислорода
2m*0,8881+3mО2*+3mН2О*0,8881+4mО2=6mCО*0,5712+6mCО2*0,7271+
+6mН2О*0,8881,
4424*0,8881+1607+72*0,8881+2872=4560*0,5712+3126*0,7271+
+6mН2О*0,8881,
3594=6mН2О*0,8881, 6mН2О=4036кг/ч
Материальный баланс водорода
mCH4*0,2513+1mC2H6*0,2011+2m*0,1119+3mН2О*0,1119=6mCH4*0,2513+
+6mН2О*0,1119+6mН2,
3745*0,2513+74*0,2011+4424*0,1119+72*0,1119=74*0,1119+
+4036*0,1119+6mН2,
6mН2=998кг/ч.
Соответственно объемы составляют (в нм3/ч)
6vCO2= 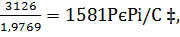
6vН2O= 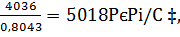
6vН2= 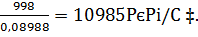
Проверка правильности расчета производится составлением сводной таблицы материального баланса (табл.2) и подстановкой объемов газов в выражение константы равновесия
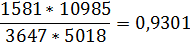
Полученная величина практически соответствует заданной.
Табл. 2
Приход
Расход
Конвертированный газ
метан
окись углерода
двуокись углерода
водород
азот
аргон
пары воды
ТЕПЛОВОЙ РАСЧЕТ
Приход тепла.
С природным газом.
1Q=(1mCH4*1cCH4+1mC2H6*1cC2H6+1mN2*1cN2)*1t,
1Q=(3745*3,159+74*2,786+275*1,078)*600=7399200кдж/ч.
Здесь 1с – теплоемкость компонента при 600°С,кДж/кг*град.
Теплоемкость (см. список литературы 4, табл.I.стр.500)
С паром
2Q=2m*2i=4424*3706=16395344кдж/ч.
Здесь 2i – энтальпия паров воды при 600°С и 0,8*105 н/м2 (в кДж/г).
Общее давление паро-газовой смеси около 1,6*105н/м2,содержание паров воды в ней 50% по объему. Технический кислород и воздух поступают отдельно. Данные об энтальпии воды и паров воды при разных условиях см. в список литературы 4,табл XX и XXI,стр.513,514).
С воздухом
3Q=3mсух*3i=6931*46,47=322084 кдж/ч.
Здесь 3i – энтальпия влажного воздуха (в кДж/кг), вычисленная на 1 кг сухого воздуха при 20°С и относительной влажности 70% (см.список литературы 4,табл. XIX,стр.512).
С техническим кислородом
4Q=(4mО2*4cО2+4mN2*4cN2+4mAr*4cAr)*4t,
4Q=(2872*0,920+26*1,027+37*0,519)*40=107520кдж/ч.
Здесь 4cAr=0,519 кдж/кг*град – теплоемкость аргона (не зависит от температуры).
Тепло реакции.
Тепло реакций, происходящих в конвекторе метана, рассчитываем, исходя из следующих соображений. Принимаем, что реакция в основном протекает при температуре 30 град ниже, чем температура отходящих газов, т.е. при 800°С (830-30). Так как в процессе конверсии происходят параллельные реакции, учесть которые затруднительно, а тепловой эффект процесса зависит только от начального и конечного состояний системы, то расчет ведем по количеству прореагировавших веществ. Для этого рассчитываем энтальпию образования из элементов одного килограмма каждого вещества, участвующего в реакциях. Расчет производим по формуле
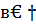 h298=
h298= 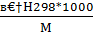 кдж/кг, [4,стр.25]
кдж/кг, [4,стр.25]
где 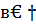 h298- энтальпия вещества при стандартных условиях, кДж/кг;
h298- энтальпия вещества при стандартных условиях, кДж/кг; 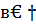 Н298-энтальпия вещества по таблицам, кДж/моль (Краткий справочник физико-химических величин, изд. 4. «Химия», 1965); 1000 – коэффициент пересчета килограммов в граммы, г/кг; М – мольная масса вещества, г/моль.
Н298-энтальпия вещества по таблицам, кДж/моль (Краткий справочник физико-химических величин, изд. 4. «Химия», 1965); 1000 – коэффициент пересчета килограммов в граммы, г/кг; М – мольная масса вещества, г/моль.
Энтальпии равны (в кДж/кг):
для метана
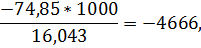
для этана
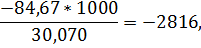
для окиси углерода
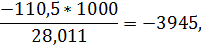
для двуокиси углерода
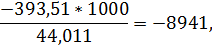
для паров воды
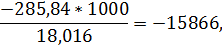
Согласно материальному балансу в процессе реакции расходуется (в кг/ч): метана 3745-74=3671, этана 74, кислорода 1607+2872=4479, паров воды 4424+72-4036=460.
При этом образуется (в кг/ч): окиси углерода 4560, двуокиси углерода 3126, водорода 998.
Для теплового эффекта при 25°С имеем
Q298= 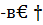 Н298-=(∑
Н298-=(∑ 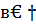 Нкон - ∑
Нкон - ∑ 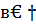 Ннач)=∑
Ннач)=∑ 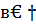 Ннач- ∑
Ннач- ∑ 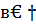 Нкон, [4,стр.26]
Нкон, [4,стр.26]
или
q298=∑ 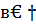 hнач*mнач=∑
hнач*mнач=∑ 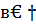 hкон*mкон,
hкон*mкон,
q298=-3671*4666-74*2816-4479*0-
-460*15866+4560*3945+998*0+3126*8941=21303136 кдж/ч.
Как известно из курса физической химии, тепловой эффект реакции при Т2 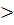 Т1 определяется уравнением
Т1 определяется уравнением
QТ2= QТ1+р(Т1- Т2)= QТ1+(∑ 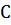 кон-∑
кон-∑ 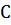 нач)(Т1-Т2)=
нач)(Т1-Т2)=
= QТ1-(∑ 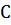 кон-∑
кон-∑ 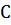 нач)(Т2-Т1), [4,стр.26]
нач)(Т2-Т1), [4,стр.26]
или
qt2= qt1-[∑(cm)кон-∑(cm)нач](t2-t1).
В приведенном расчете теплоемкости необходимо выразить в кДж/кг*град и взять средние в диапазоне 298-1073°К. Для расчета пользуемся интерполяцией табличных данных, которые приведены в «Кратком справочнике физико-химических величин» ( в кДж/моль*град).
Пересчет производим по формуле:
с= 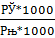 =
= 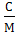 кдж/кг*град, [4,стр.26]
кдж/кг*град, [4,стр.26]
где с- теплоемкость, кдж/кг*град, С-теплоемкость, дж/моль*град; 1000 в числителе – коэффициент пересчета граммов в килограммы, г/кг; 1000 – в знаменателе – коэффициент пересчета джоулей в килоджоули, дж/кДж; М- мольная масса, г/моль.
Тогда (в кДж/кг*град)
для метана
с= 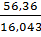 =3,513,
=3,513,
для этана
с= 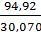 =3,157,
=3,157,
для кислорода
с= 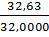 =1,020,
=1,020,
для паров воды
с= 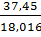 =2,079,
=2,079,
для окиси углерода
с= 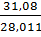 =1,110,
=1,110,
для двуокиси углерода
с= 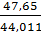 =1,083,
=1,083,
для водорода
с= 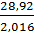 =14,345.
=14,345.
Отсюда
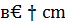 =4560*1,110+998*14,345+3126*1,083-3671*3,513-74*3,157-
=4560*1,110+998*14,345+3126*1,083-3671*3,513-74*3,157-
- 4479*1,020-460*2,079=4109кдж/град,
5Q=q298- 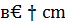 (t2-t1)=21303136-4109*(800-25)=
(t2-t1)=21303136-4109*(800-25)=
=21303136-3184475=18118661кдж/ч.
Общий приход тепла.
Qпр=7399200+16395344+322084+107520+18118661=42342809кдж/ч.
Расход тепла.
С конвертированным газом
6Q=(6mCH4*6cCH4+6mN2*6cN2+6mAr*6cAr+6mCО*6cCО+6mСО2*6cСО2+
+6mН2*6cН2)*6t+6mH2O*6iН2О,
6Q=(74*3,561+5533*1,105+129*0,519+4560*1,116+3126*1,099+
+998*14,690)*830+4036*4276=41850836кдж/ч.
Потери в окружающую среду (по разности)
7Q=Qпр-6Q=42342809-41850836=491973кдж/ч.
Таким образом, потери в окружающую среду составляют
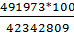 =1,2% от прихода тепла
=1,2% от прихода тепла
Табл.3
АППАРАТУРНО-ТЕХНОЛОГИЧЕСКОЕ ОФОРМЛЕНИЕ КОНВЕРСИИ МЕТАНА
Как было отмечено ранее, протеканию процесса способствует высокая температура. Катализатор в этих условиях весьма активен, и равновесие достигается быстро, поэтому достигаемое в реакторе превращение можно с достаточной точностью определить из равновесных данных. Конверсия метана - реакция эндотермическая: тепловой эффект взаимодействия метана с водой Q1=-206,4 кдж/моль и превалирует над экзотермическим эффектом другого этапа Q2=+41,0 кдж/моль. Необходимую теплоту можно подвести через стенки обогреваемых труб, в которых находится катализатор и протекает реакция, т.е. осуществить процесс в трубчатом реакторе, или, как его называют, в трубчатой печи. Обогрев осуществляется сжиганием природного газа в факельных инжекционных горелках.
Необходима вторая ступень конверсии. Она представлена адиабатическим реактором, или, как его называют, шахтным конвектором, стенки которого футерованы внутри высокотемпературным материалом (бетоном) для предохранения корпуса о перегрева. Необходимую температуру создают подачей в реактор воздуха; часть метана сгорает, и температура повышается до 1230-1280 К. Если в трубчатом реакторе теплота подводится внешним теплообменником, то в шахтном реакторе – внутренним теплообменником. В шахтном конвекторе подачей воздуха, точнее, кислорода воздуха обеспечивается нужный температурный режим процесса, но так как с воздухом вводится и азот, необходимый для синтеза аммиака, шахтный конвектор еще выполняет функцию выделения азота из воздуха. Количество подаваемого воздуха должно быть таким, чтобы соотношение водород:азот было стехиометрическим для синтеза аммиака, т.е. соответствовало 3:1.
Процесс можно провести только в шахтном конвекторе. Аппаратурно это выгодно: теплота сгорания природного газа выделяется внутри реактора, и её использование для поддержания режима эндотермической реакции будет наиболее полным (в трубчатом реакторе необходимо преодолеть термическое сопротивление стенки и зернистого слоя катализатора). В этом случае в шахтный конвектор дополнительно подают воздух, обогащенный кислородом, так как количество азота должно быть дозировано, а теплоты подвести надо достаточно много, и кислорода воздуха не хватает. Одноступенчатая парокислородовоздушная конверсия метана была распространена ранее. Вследствие затруднений, возникающих на стадиях утилизации теплоты реакционной смеси и отделения продуктов горения, оптимизация схемных решений превалировала над оптимизацией процесса в реакторе, поэтому современные производства аммиака включают двухступенчатую конверсию метана.
ТЕХНИКА БЕЗОПАСНОСТИ
Одним из наиболее неблагоприятных факторов производства аммиака является загрязнение наружного воздуха на территории предприятия и внутренних помещениях ядовитыми парами.
Во избежание чрезвычайных ситуаций необходимо заранее проводить проверку рабочего оборудования, газоводов, кислотопроводов, систем безопасности и прочего оборудования.
Основные направления создания безопасной техники, безопасных и здоровых условий труда на производстве - укрупнение и комбинирование производственных агрегатов, автоматизация и комплексная механизация процессов, внедрение автоматических систем управления (АСУ), переход на непрерывные процессы, создание принципиально новых машин и оборудования, широкое внедрение специальных средств безопасности - систем взрывозащиты и взрывоподавления, новых типов и конструкций предохранительных клапанов, мембран, быстродействующих отсекателей, огнепреградителей; санитарно-гигиенические и физиологические исследования условий и режимов труда и разработка соответствующих рекомендаций.
В связи с повышением технического уровня предприятий химической промышленности, разработкой и освоением новых, модернизацией и усовершенствованием действующих производств возрастают требования к квалификации работников химической промышленности, поэтому их подготовке должно уделяться особое внимание. Главная роль в обеспечении безопасных и безвредных условий труда на производстве принадлежит инженерно-техническим работникам, занимающимся вопросами охраны труда и техники безопасности.
СПИСОК ЛИТЕРАТУРЫ
1. Антрощенко В.И. Технология азотной кислоты. – М.: Химия, 1970
2.Бесков В.С. Общая химическая технология. – М.:ИКЦ «Академкнига», 2005
3. Дыбина П.В. и др. Расчеты по технологии неорганических веществ. – М.: Высшая школа, 1967.
4.Ксензенко В.И. и др. Общая химическая технология и основы промышленной экологии. – М.: Химия, 2001.
5.Общая химическая технология, Под ред.проф. И.П. Мухленова. –М.: Высшая школа,1984.
6.Основы химической технологии. Под ред.проф. И.П. Мухленова. –М.: Высшая школа,1991.
7. Позин Н.Е. Технология минеральных удобрений. – М.: Химия 1974.
8.Расчеты химико – технологических процессов. Под ред. И.П. Мухленова. – М.: Высшая школа, 1976.
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ОТКРЫТЫЙ УНИВЕРСИТЕТ
ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
КАФЕДРА ТЕХНОЛОГИИ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ И ОБЩЕЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
КУРСОВОЙ ПРОЕКТ ПО ДИСЦИПЛИНЕ:
«ТЕХНОЛОГИЯ ХИМИЧЕСКИХ ПРОИЗВОДСТВ»
Дата: 2019-12-22, просмотров: 350.