В отделении вакуумной сепарации применяется полусовмещенная схема получения титановой губки, при которой монтаж аппарата сепарации осуществляется без охлаждения аппарата восстановления, процесс сепарации ведется в специализированной электропечи. После процесса сепарации реторта – конденсатор с магнием с хлоридом магния отправляется на процесс восстановления. Из нее сливают хлорид магния, затем добавляют магний и подают тетрахлорид титана, образуется реакционная масса после прохождения реакции восстановления, эту реторту уже называют ретортой – конденсатором. А реторта с блоком титановой губки освобождают и монтируют на реторту – реактор, устанавливая между ними магниевую заглушку. Такая реторта становится ретортой – конденсатором. Этот метод получил название «Метод оборотных реторт». Технологическая схема отделения вакуумной сепарации представлена на рисунке 3.1
После процесса восстановления в реакторе остается спекшийся блок реакционной массы, представляющий собой титановую губку, пропитанную магнием и хлоридом магния.
Состав реакционной массы (средний по блоку) примерно следующий: (55 – 60)% титана,(25-35)% магния, (8 – 12)% хлорида магния, (0,01 – 0,1)% низших хлоридов титана. Блок прочно спаян со стенками реактора в верхней зоне, и его невозможно извлечь без разрушения места спая. Целью передела вакуумной сепарации является очистка титановой губки от магния, хлорида магния и низших хлоридов титана.
Вакуумная сепарация реакционной массы основана на различной упругости паров титана, магния и хлорида магния. Так, температуры кипения у титана, магния и хлорида магния соответственно равны 3260, 1107 и 1417 0С. Следовательно, при 1417 0С и атмосферном давлении от титана отгоняются магний и хлорид магния. Однако, при этих условиях, практически невозможно добиться полного отделения магния и хлорида магния от титана. Кроме того, при температуре 1085 0С железо стенки реторты интенсивно взаимодействует с титаном с образованием легкоплавкого вещества – эвтектики. Скорость испарения магния и хлорида магния из реакционной массы зависит от упругости паров, общего давления над реакционной массой и температуры. Как показали исследования, зависимости давления паров магния и хлорида магния от температуры [3], при 900 0С эти величины соответственно равны 0,13·105 Па. Для титана скорость испарения близка к нулю.
Это значит, что уже при 9000С над реакционной массой находятся пары магния и хлорида магния в количестве, пропорциональном давлению их паров. Если эти пары отводить, то из реакционной массы будут испаряться новые порции. Для отвода паров магния и хлорида магния в аппарате сепарации применяют конденсатор, в котором, с помощью охлаждения, создается низкая температура, следовательно, более низкое давление паров магния и хлорида магния. Таким образом, движение паров из реактора в конденсатор происходит в результате разности давления в этих зонах аппарата.
Из реакционной массы в период сепарации выделяются и другие газы (главным образом водород). Эти газы непрерывно откачиваются вакуумным насосом через конденсатор. Когда говорится о давлении в реторте в период сепарации, то под этим подразумевается давление газов (водорода, паров воды, паров хлоропроводной кислоты и другие), замеряемое на выходе из конденсатора. Измерение паров магния и хлорида магния не производят, так как в место замера давления эти вещества могут попасть только в конденсированном состоянии. Когда говорится о температуре сепарации, то под этим подразумевается температура наружной стенки реторты, реакционная масса в течение процесса прогревается от стенки к центру.

Рисунок 1 - Технологическая схема отделения вакуумной сепарации
Вакуумные насосы могут откачать газы из реторты до остаточного давления (0,13 – 13,3)Па, однако, вследствие интенсивного выделения газов в начальный период сепарации давление повышается до (133 – 1328) Па.
Процесс сепарации имеет три основные стадии. В первой стадии происходит дегазация реакционной массы и ее нагрев. В случае быстрого нагрева часть газов (в основном воды и адсорбируемого стенками реактора воздуха) поглощаются титаном. Во второй стадии происходит интенсивное испарение магния и хлорида магния с открытой поверхности и из крупных пор. В третьей стадии испаряется, в основном, хлорид магния и оставшийся в мелких порах магний. Из диаграмм сепарации [3] следует, что самым продолжительным периодом является третий. Продолжительность отгонки основного количества конденсата составляет (25 – 35)% общего времени сепарации. Продолжительность третьего периода резко увеличивается при увеличении длины пути паров с хлоридом магния. В аналогичных условиях находится губка в центральных зонах промышленного блока. Поэтому исследование процесса в третьем периоде – отгонка последних (2 – 3)% хлорида магния – является основным направлением при изучении процесса сепарации.
В первой и второй стадиях сепарации давление почти не влияет на скорость процесса.
Интенсивность испарения определяется количеством подводимого к материалу тепла и скоростью отвода массы пара. Во второй стадии испарение происходит интенсивно, следовательно, тепло подводится в достаточном количестве. В этот период удаление хлорида магния происходит путем углубления поверхности испарения внутрь тела (внутри крупных пор). В третьей стадии процесса условия для подвода тепла остаются такими же, однако, скорость испарения резко падает, процесс лимитируется возрастающим коэффициентом сопротивления переносу пара. Снижение скорости процесса происходит в результате наличия мелких пор, в которых остается (2 – 3)% хлорида магния.
Процесс сепарации резко замедляется при остаточном содержании хлорида магния около 2%.
Повышенное содержание хлора в губке, расположенной в верхней половине центральной зоны блока, объясняется не только тем, что эта зона прогревается в последнюю очередь, но главным образом, тем, что губка, формирующаяся в этой зоне, имеет структуру, неблагоприятную для сепарации. Другим существенным фактором, влияющим на скорость процесса сепарации, является расстояние от зоны испарения до поверхности блока губки. В случае, если блок имеет простую геометрическую форму: цилиндр, параллелепипед и т.п., этот фактор определяется соотношением массы блока и его поверхности.
Из изложенного следует, что продолжительность процесса сепарации определяется температурой, давлением, геометрической формой и размерами блока, структурой губки.
Остаточное давление, создаваемое в аппарате определяется возможностью вакуумных насосов. Применяемые в промышленности вакуумные насосы в сочетании с бустерными насосами создают в конце процесса остаточное давление порядка одного Паскаля. Снижение давления ниже одного Паскаля несущественно влияет на скорость процесса, создание же более низкого давления весьма сложно. Поэтому создаваемое существующим вакуумным оборудованием остаточное давление можно считать приемлемым.
Процесс сепарации заканчивается тогда, когда вся губка прогревается до температуры (940 – 960)0С. Исходя из этого, параметры для определения окончания процесса могло бы служить достижение этой температуры в той точке реакционной массы, которая прогревается в последнюю очередь. Такой точкой обычно является середина поверхности блока реакционной массы. Однако, этот параметр, во-первых, трудно замерить, во-вторых, он не всегда достаточно надежен.
Вторым, более точным методом определения окончания процесса является метод замера изменения давления газов в реторте после отключения вакуум – линии. Поворот газового потока определяет окончание процесса сепарации, он происходит вследствие того, что после прекращения выделения газов ( в основном, водорода) из губки, которое происходит в течение всего процесса, губка начинает поглощать газы, натекающие в реторту через неплотности, а также из вакуум - линии.
После окончания процесса аппарат охлаждают сначала в печи, потом транспортируют его мостовым краном в так называемый холодильник, где он охлаждается сначала воздухом, затем водой.
Металлургические расчёты
Расчет состава реакционной массы
Состав реакционной массы, которую перерабатывают в отделении вакуумной сепарации, находят из предварительного расчета процесса восстановления тетрахлорида титана магнием.
Процесс восстановления протекает по следующей реакции:
TiCl4 + 2Mg = 2MgCl2 + Ti. (5)
Процесс восстановления протекает в инертной среде, т. е. в среде аргона.
Расчет ведем на 1 тону губчатого титана с последующим пересчетом на цикловую производительность аппарата. В расчете принимается следующий состав:
- состав очищенного тетрахлорида титана, %: TiCl4 - 99,98; FeCl3- 0,003; SiCl4- 0.005; AlCl3 - 0.005; VOCl3- 0,0034; O- 0,0006.
- состав магния – восстановителя марки, %: Mg -99,832; O -0.02; Fe -0,05;N -0.02; Ni -0,05;Cl -0,008.
- примеси аргона, %: O - 0,005; N - 0,002.
Восстановление идет по реакции (5):
3960,541014,82 10003975,36
TiCl4 + 2Mg = Ti + 2MgCl2
189,72 48,61 47,9 190,42
На 47,9 кг титана потребуется 189,71 кг тетрахлорида титана
На 1000 кг титана потребуется х кг тетрахлорида титана
х = 3960,54 кг тетрахлорида титана
Находим количество тетрахлорида титана с примесями:
3960,54 / 0,99983 = 3961,21 кг,
в том числе:
FeCl3: 3961,21·3·10-5 = 0,118 кг
SiCl4: 3961,21·5·10-5 = 0,198 кг
AlCl3: 3961,21·5·10-5 = 0,198 кг
VOCl3: 3961,21·3,4·10-5 = 0,134 кг
O: 3961,21·0,6·10-5 = 0,023 кг
0,118 0,053 00,081 0,207
2FeiCl3 + 3Mg = 2Fe + 3MgCl2
162,2 72,9 111,7 285,6
0,198 0,056 0,032 0,221
SiCl4 + 2Mg = Si + 2MgCl2
169,8 48,61 28,08 190,42
0,198 0,054 0,02 0,212
AlCl3 + 3Mg = 2Al + 3MgCl2
266,66 72,9 26,98 285,6
0,134 0,009 0,106 0,036
2VOCl3 + Mg = 2VOCl2 + MgCl2
346,58 24,3 275,68 95,2
Кислород = 0,023 кг.
Общее количество магния составляет:
1014,84 + 0,053 + 0,056 + 0,054 + 0,009 = 1015,012 кг.
Количество магния с примесями:
1015,72 / 0,99832 = 1016,72 кг.
Коэффициент использования Mg принимаем равным за 60%:
1016,72 / 0,6 = 1694,533 кг.
Избыток Mg: 1694,533 - 1016,72 = 677,813 кг.
Mg = 1694,533 · 0,99832 = 1691,686 кг,
Fe = 1694,533 · 0,0005 = 0,847 кг,
Ni = 1694,533 · 0,0005 = 0,847 кг,
O = 1694,533 · 0,0002 = 0,338 кг,
N = 1694,533 · 0,0002 = 0,338 кг,
Si = 1694,533 · 0,0002 = 0,338 кг,
Cl = 1694,533 · 0,00008 = 0,135 кг.
Общее количество MgCl2 образующегося во время восстановления:
3975,36 + 0,207 + 0,221 + 0,212 + 0,036 = 3976,036 кг.
По данным практики титано – магниевых заводов для получения одной тоны губки расходуется 7 м3 аргона.
Количество примесей переходящих из аргона в титановую губку [3]:
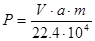 ,
,
где V – расход Ar на 1 т титановой губки;
а - содержание примесей в Ar, общий %;
т - молекулярная масса примесей.
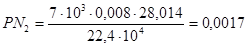 кг,
кг,
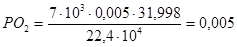 кг.
кг.
Титан имеет способность активно взаимодействовать в нагретом состоянии со многими элементами и материалами. В процессе магниетермического получения титана образуется интерметаллические соединения. Основными каналами поступления примесей является Mg, TiCl4 и Ar. Главным составляющим, загрязняющим титан железом, является магний. Железо легко извлекается из магния первыми порциями TiCl4 и концентрируется в донной и гарниссажной частях блока.
Общее количество примесей, переходящих в титановую губку:
(0,338 + 0,0017) + (0,338 + 0,023 + 0,005) + (0,338 + 0,032) + +0,135 +(0,847 + 0,081) +0,847+0,02=3,00 кг.
Количество губки вместе с примесями: 1000 + 3,005 = 1003,005 кг.
Из практики следует, что во время процесса восстановления сливается 96% MgCl2.: 3976,036 . 0,96 = 3816,994 кг.
В реакционной массе остается MgCl2:
3976,036 – 3816,994 = 159,041 кг. 
На основе получения данных составим таблицу 2 материального баланса процесса восстановления, в котором представлен состав реакционной массы.
Расчет материального баланса процесса вакуумной сепарации
Состав исходного продукта – реакционной массы – взят из предварительного расчета (таблица 3.1). В отделении, согласно проекту предполагается получать титан губчатый марки ТГ – 90, имеющий состав ГОСТ 17749-79, %: Ti – 99,74; Fe – 0,05; C – 0,02; Cl – 0,08; N2 – 0,02; O2 -0,04; Si – 0,01; Ni – 0,04.
Образуется губчатого титана: 1000 . 100 / 99,74 = 1002,606 кг.
Состав губчатого титана после сепарации, кг:
1002,606 . 0,9974 = 999,999 титана
1002,606 . 0,00005 = 0,501 железа
1002,606 . 0,0002 = 0,2 углерода
1002,606 . 0,0008 = 0,802 хлора
1002,606 . 0,0002 = 0,2 азота
1002,606 . 0,0004 = 0,401 кислорода
1002,606 . 0,0001 = 0,1 кремния
1002,606 . 0,0004 = 0,401 никеля
В конденсат полностью переходит магний, алюминий.
Состав конденсата после сепарации, кг:
Mg из MgCl2
677,813 + 40,595 = 718,408 магния,
Cl из MgCl2
0,135 + 118,445 = 118,58 хлора,
0,02 алюминия,
0,928 – 0,501 = 0,427 железа,
0,339 – 0,2 = 0,1239 азота,
0,37 – 0,1 = 0,27 кремния,
0,847 – 0,401 = 0,446 никеля.
Всего образуется конденсата 838,29 кг.
Материальный баланс вакуумной сепарации представлен в таблице 3.
Составим цикловой материальный баланс процесса сепарации который представлен в таблице 4 для аппарата производительностью 4.3 тоны за цикл.
Коэффициент пересчета 4300 / 1002,606 = 4,2888233
Тепловой расчет аппарата сепарации
Во время процесса сепарации происходит разделение компонентов Mg, MgCl2 и Ti путем конденсации их на охлажденных стенках конденсатора.
Таблица 2
Материальный баланс процесса восстановления тетрахлорида титана магнием
| Приход | Расход | |||||
| Наименование | Количество | Наименование | Количество | |||
| кг | % | кг | % | |||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Тетрахлорид титана, в том числе: TiCl4 FeCl3 SiCl4 AlCl3 VOCl3 O | 3961,21 3960,54 0,118 0,198 0,198 0,135 0,023 | 100 99,983 0,003 0,005 0,005 0,0034 0,006 | Реакционная масса, в том числе: Ti N O Si Cl Fe Ni Al | 1836,854
1000 0,339 0,366 0,370 0,135 0,928 0,847 0,02 | 100
54,44 0,018 0,019 0,02 0,007 0,05 0,046 0,001 | |
| Магний– восстанови-тель, в том числе: Mg Fe Ni O N Si Cl | 1694,533
1691,686 0,847 0,847 0,338 0,338 0,338 0,135 | 100
99,832 0,05 0,05 0,02 0,02 0,02 0,008 | ||||
| Избыток магния | 677,813 | 36.9 | ||||
| Оставшийся хлорид магния | 159,041 | 8.658 | ||||
| Слив хлорида магния, в том числе: MgCl2 VOCl2 | 3817,1
3816,994 0,106 | 100
99.997 0,003 | ||||
| Примеси аргона, в том числе: O N | 0.0067 0,0005 0,0017 | 100 74,62 25,37 | ||||
| Невязка | 1,795 | 0,03 | ||||
| Итого | 5655,749 | Итого | 5653,954 | |||
Таблица 3.
Материальный баланс вакуумной сепарации
| Приход | Получено | ||||
| Наименование | |||||
Количество
Наименование
Количество
Реакционная масса, в том числе:
Ti
N
O
Si
Cl
Fe
Ni
Al
избыток Mg
ост. MgCl2
1836,854
1000
0,339
0,336
0,370
0,135
0,928
0,847
0,020
77,813
159,041
100
54,44
0,018
0,019
0,020
0,007
0,050
0,046
0,001
36,90
8,658
1836,854 кг
1840,896 кг
Таблица 4.
Материальный баланс процесса вакуумной сепарации (цикловой)
| Приход |
Расход | |||||
|
Наименование |
Количество | Наименование |
Количество | |||
| кг | % | кг | % | |||
| Реакционная масса | 7877,942 | 100 | Губчатый титан. | 4300 | 100 | |
| В том числе: Ti N O Si Cl Fe Ni Al избыток Mg ост. MgCl2 |
4288,823 1,453 1,569 1,586 0,578 3,980 3,632 0,085 2907,020 682,098 |
54,44 0,018 0,019 0,020 0,007 0,050 0,046 0,001 36,90 8,658 | В том числе: Ti Fe C Cl N O Si Ni | 4288,820 2,150 0,800 3,440 0,860 1,720 0,430 1,720 | 99,74 0,05 0,02 0,08 0,02 0,04 0,01 0,04 | |
| Конденсат | 3595,277 | 100 | ||||
| В том числе: Mg Cl Fe N Si Ni Al |
3081,124 508,568 1,831 0,596 1,158 1,913 0,085 |
858,699 14,145 0,050 0,016 0,032 0,053 0,002 | ||||
| Невязка | 17,335 | 0,219 | ||||
| Итого | 7877,942 кг | Итого | 7895,277 кг | |||
Исходные данные для расчета.
Состав реакционной массы: 4300 кг титана, 2907 кг магния, 682 кг хлорида магния.
Температура выдержки в процессе вакуумной сепарации 1010 °С.
Аппарат поступающий в отделение сепарации имеет температуру 600 – -650 °С.
Температура стенки охлаждаемой оборотной реторты не более 100 °С. Температуры: плавления Mg — 651 °С, кипения Mg — 1102 °С, плавления MgCl2 — 718 °С, кипения MgCl2 — 1410 °С.
Тепловой расчет реактора
Рассчитываем количество тепла необходимое на испарение магния:
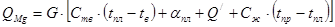 ,
,
гдеQ/ - скрытая теплота испарения Mg – 5606,5 кДж/кг °С;
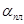 - скрытая теплота плавления Mg –361,9 кДж/кг °С;
- скрытая теплота плавления Mg –361,9 кДж/кг °С;
С - теплоемкость Mg;
G - вес Mg;
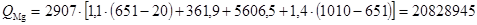 кДж.
кДж.
Определим количество тепла, необходимого на испарение MgCl2:
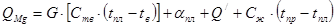 ,
,
гдеQ// - теплота возгонки MgCl2 - 1368 кДж/кг °С;
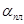 - теплота плавления MgCl2 - 452 кДж/кг °С;
- теплота плавления MgCl2 - 452 кДж/кг °С;
С - теплоемкость MgCl2 ;
G - вес MgCl2 .
QMgCl2 = 682 . [0,84 . (718 – 20) + 452 + 1368 + 0,97 . (1010 – 718) =
= 1834279 кДж.
Определим количество тепла необходимого на нагрев титановой губки:
QTi = G . C . (tпл – tг) ,
гдеС - теплоемкость титана – 0,67 кДж/кг °С
G - вес титана - 4300 кг
tг - температура губки - 700°С.
QTi = 4300 . 0,67(1010 – 700) = 893110 кДж.
Количество тепла необходимого на нагрев реактора:
Qp = G . C . (tнр – tр),
где С - теплоемкость нержавеющей стали – 0,62 кДж/кг °С;
G - вес реактора.
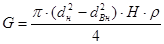 ,
,
гдеd н - наружный диаметр реактора, м;
d Вн - внутренний диаметр реактора, м;
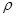 - плотность материала реактора – 7200кг/м2.
- плотность материала реактора – 7200кг/м2.
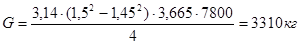 .
.
Qрет = 3310 . 0,62 . (1010 – 600) = 841402 кДж.
Расчет потерь тепла в оборотную реторту:
- потери через крышку реактора:
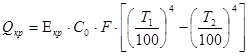 ,
,
гдеE - степень черноты крышки – 0,9;
С0 - лучеиспускание абсолютно черного тела 20,7 кДж.
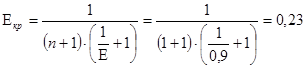 ,
,
где n - число экранов;
F - площадь экранов крышки.
Fэ = Fкр – Fц.патр. .
Fэ= 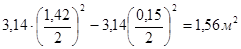 .
.
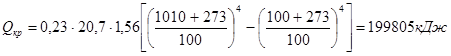 .
.
- потери через центральный патрубок:
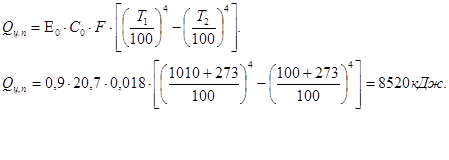
Суммарные потери в оборотную реторту: Qв.обр.рет = Qкр + Qц.п ,
Qв..обор.рет.= 199805 +8520 =208325 кДж
Расчет охлаждения оборотной реторты
Расчет охлаждения оборотной реторты производится при конденсации Mg от температуры процесса равной 1010 °С до температуры водоохлаждаемой стенки реторты равной 100 °С.
- тепловыделения при конденсации Mg:
Q1 = G . Q/,
где Q/ - скрытая теплота возгонки Mg - 5606 кДж;
G - вес Mg.
Q1 = 2907 . 5606 = 16298269 кДж.
- тепловыделения при охлаждении магния до температуры плавления 651 °С:
Q2 = G × Cж × (tпр – tпл).
Q2 = 2907 × 1,4 ×(1010 × 651) = 1458400 кДж.
где Cж - теплоемкость Mg = 1,4 кДж.
- тепловыделения при затвердении жидкого Mg:
Q3 = G × Q// .
Q3= 2907 × 362 = 1052087 кДж
гдеQ// - скрытая теплота плавления – 362 кДж.
- тепловыделения при охлаждении твердого Mg до температуры водо-охлаждаемой стенки реторты:
Q4 = G × C × (tпл × tст) .
Q4= 2907 × 1,17 × (651 – 100) = 1876490 кДж.
где С - теплоемкость Mg в интервале 651 – 100 °С – 1,17 кДж.
- Суммарные тепловыделения при конденсации Mg:
QMg = Q1 + Q2 + Q3 + Q4 .
QMg = 16298269 + 1458400 + 1052087 + 1876490 = 20685248 кДж.
Расчет тепловыделений при конденсации паров MgCl2 от температуры процесса 1010 °С до температуры конденсатора 100 °С
- тепловыделения от конденсации паров MgCl2:
Q1 = G × Q///,
где Q/// - скрытая теплота испарения MgCl2 – 1368 кДж.
Q1 = 682 × 1368 = 933090 кДж.
- тепловыделения при охлаждении от 1010 °С до температуры плавления 718 °С:
Q2 = G × Cж × (tпр – tпл) ,
гдеCж - теплоемкость MgCl2 – 0,97 кДж.
Q2 =682 × 0,97 × (1010 – 718) = 193304 кДж.
- тепловыделения при затвердевании жидкого MgCl2: Q3 = G × QIÑ .
где QIÑ - скрытая теплота плавления MgCl2 – 452 кЛж
Q3 = 682 × 452 = 308176 к Дж.
- тепловыделения при охлаждении твердого MgCl2 до температуры водоохлаждаемой стенки оборотной реторты:
Q4 = G × C × (tпл -tст) .
где С - теплоемкость MgCl2 в интервале температур 718 – 100 °С – 0,84 кДж.
Q4= 682 × 0,84 × (718 × 100) = 354451 кДж.
- общие тепловыделения при конденсации MgCl2:
Q MgCl 2 = Q1 + Q2 + Q3 + Q4 .
QMgCl2 = 933090 + 193304 + 308176 + 354451 = 1789024 кДж.
На период возгонки основного количества конденсата затрачивается примерно до 20% времени выдержки. Остальное время процесса сепарации идет на удаление оставшегося Mg и MgCl2.
На основании опытных данных об увеличении температуры выдержки на 10°С продолжительность высокотемпературной выдержки, с температурой по зонам 970, 1010, 1020, 1010, принимаем 62 часа. Определяем время интенсивной возгонки:
62—100%х = 12,4 часов.
х—20%
- часовые тепловыделения при конденсации Mg и MgCl2:
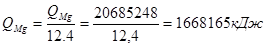 .
.
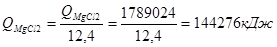 .
.
Суммарные тепловыделения в конденсатор из реактора:
Q = QMg + QMgCl 2 + Qкрыш .
Q = 166165 + 144276 + 209362 = 2021805 кДж.
Расчет водяного охлаждения оборотной реторты (конденсатора)
Охлаждение реторты – конденсатора во время процесса сепарации производится водой. Из практических данных известно, что температура воды после охлаждения порядка 70 °С. Начальная температура воды – 20 °С. Определяем количество воды, необходимое для охлаждения оборотной реторты:
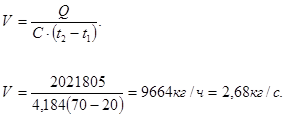
где С - теплоемкость воды = 4,184 кДж/кг×с.
Теплоотдача при стекании жидкости по вертикальной поверхности:
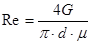 ,
,
где G - расход воды на охлаждение равен 2,68 ?
pd – периметр орошения, м
m - коэффициент динамической вязкости воды, при 20 °С m = 10-3 н×с/м2
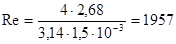 .
.
т. к. Re = 1957 < 2000, то давление можно считать ламинарным.
По упрощенной формуле толщина пленки воды: 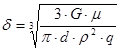 ,
,
гдеr - плотность воды при 20 °С = 0,998 × 103 кг/м3.
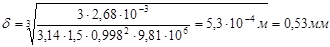
Критерий Прандтля для воды при 20 °С равен 7,02.
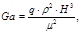
гдеH - высота с которой стекает пленка воды.
Критерий Галия:.
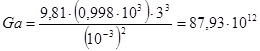
Критерий Нуссельта: Nu = 0,67 ×(Ga2 × P2 × Re)1/9 ,
Nu = 0,67 × [(87,93 × 1012)2 × 7,023 × 19,57] = 3792.
Коэффициент теплоотдачи для пленочного течения определяется из уравнения:
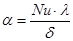 ,
,
где l - теплопроводность воды, при 20 °С = 10-2Вт/м×ч.
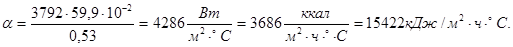
Определим необходимую поверхность орошения водой:
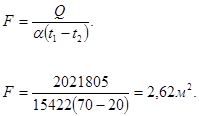
Действительная поверхность орошения реторты конденсатора:
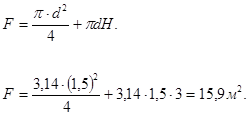
Таким образом, поверхности орошения и количества воды вполне достаточно для отвода выделяющегося тепла и конденсации всего количества MgCl2.
Тепловой расчет печи сепарации
Потери тепла в стационарном режиме.
Исходные данные: tп – рабочая температура печи – 1020 °С; tв - температура окружающей среды – 20 °С; d1 – толщина шамота легковеса ШЛБ – 10 – 0,12 м; aкоэффициент теплопроводности шамота 2,5 кДжм2 × ч × °С; d2 - толщина пенодиатомита ПД – 350 – 0,38 м; aкоэффициент теплопроводности пенодиатомита – ,62 кДжм2×ч×°С; d3 - толщина металлического кожуха – 0,02 м; aкоэффициент теплопроводности стали – 185,3 кДжм2×ч×°С.
Определим площади слоев кладки футеровки и кожуха: F = p dcp ×H .
Средняя поверхность слоя шамота: F1 = 3,14 × 2,0 ×4,85 = 30,46м2 .
Средняя поверхность слоя пенодиатомита: F2 = 3,14 × 2,46 × 4,99 = 38,55м2.
Наружная поверхность кожуха: F3 = 3,14 × 2,50 × 5,04 = 40 м2.
Определим температуру наружной поверхности кожуха печи. Для этого задаемся температурами наружной стенки печи 50, 70, 90°С. Определим коэффициент теплопередачи для этих температур:
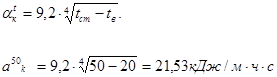
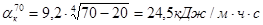 .
.
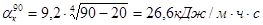 .
.
- потери тепла в окружающую среду при заданных температурах:
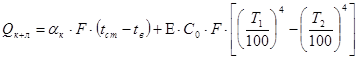 .
.
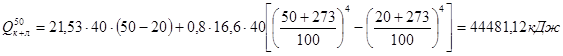
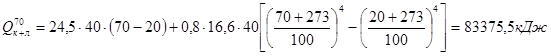
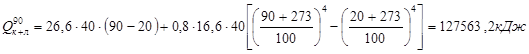
Потери тепла теплопроводностью: Qт = F × k × (tвн.ст – tн.ст),
где 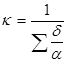 .
.
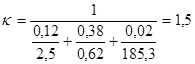 .
.
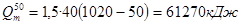 .
.
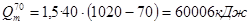 .
.
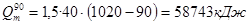 .
.
Температура наружной стенки печи сепарации равна 58 °С. Определяем коэффициент потерь тепла конвекцией и излучением: 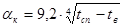
где tcт - температура наружной стенки печи сепарации; tв - температура окружающей среды.
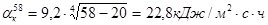 .
.
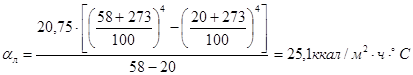 .
.
Суммарный коэффициент тепловых потерь составит:
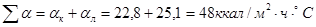 .
.
- потери тепла через боковую поверхность кожуха печи сепарации:
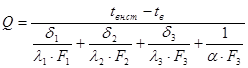 .
.
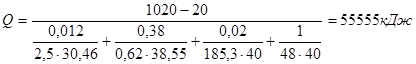 .
.
Потери через низ печи.
Исходные данные: d1 – толщина шамота легковеса ШЛБ – 1 – 0,2 м; d1 - толщина пенодиатомита ПД – 350 – 0,6 м; d3 - толщина металлического кожуха - 0,02 м; λ - коэффициент теплопроводности шамота – 2,5 кДж/м2.ч.0С; λ 2 - коэффициент теплопроводности пенодиатомита – 0,62 кДж/м2.ч.0С; λ 3 - коэффициент теплопроводности стали – 185,3 кДж/м2.ч.0С.
- поверхность слоев футеровки и кожуха:
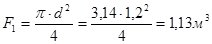 .
.
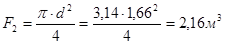 .
.
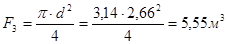 .
.
где d - средний диаметр слоев футеровки и кожуха;
- температура наружной поверхности низа печи.
Задаемся температурами наружной стенки 60, 70, 80 °С. Для поверхностей, обращенных вниз.
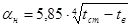 .
.
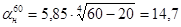 кДж/м2 × ч × °С .
кДж/м2 × ч × °С .
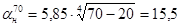 кДж/м2 × ч × °С .
кДж/м2 × ч × °С .
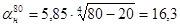 кДж/м2 × ч × °С .
кДж/м2 × ч × °С .
- потери тепла конвенцией и излучением: 
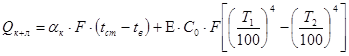 .
.
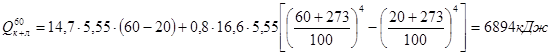
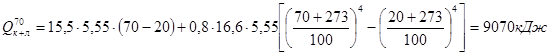
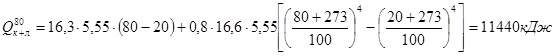
- потери теплопроводностью: 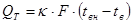 ,
,
где k - коэффициент теплопроводности
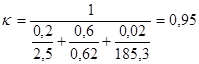 .
.
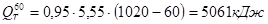 .
.
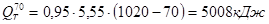 .
.
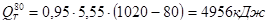 .
.
Определяем коэффициент потерь тепла конвенцией и излучением.
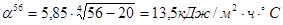
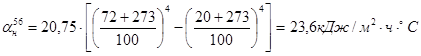
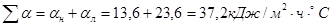
- потери тепла нижней поверхностью печи:
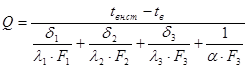 .
.
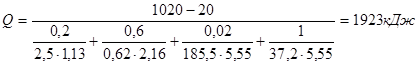 .
.
- потери тепла печью сепарации:
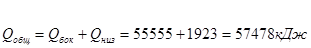
- тепло, необходимое на нагрев всей футеровки печи от 20 °С до 1020 °С.
- тепло на нагрев шамота: Q1 = G1×C2×(t1-t2) , 
гдеG1 – вес шамота – 1150 кг (по данным практики);
С1 - удельная теплоемкость шамота – 1,04 кДж/кг °С.
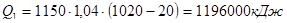 .
.
- тепло на нагрев пенодиатомита:
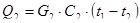 ,
,
где G2 – вес пенодиатомита – 1300 кг (по данным практики);
С2 - удельная теплоемкость пенодиатомита – 0,96 кДж/кг °С.
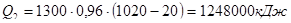 .
.
Общее количество тепла на нагрев футеровки:
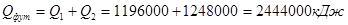 .
.
Суммарные потери тепла реактором и печью сепарации:
- часовые теплопотери:
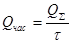 ,
,
где t - время наиболее интенсивных теплопотерь – 12,4ч.
Данные расчетов сведены в таблицу 5.
Расчет мощности печи сепарации
Необходимую мощность печи сепарации рассчитываем по формуле:
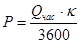 , где k - коэффициент запаса мощности, учитывающий различные незначительные потери.
, где k - коэффициент запаса мощности, учитывающий различные незначительные потери.
Для печей непрерывно действующих: k = 1,2 /1,3 .
Q – общий расход тепла в печи.
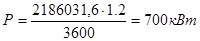 .
.
Электрический расчет печи сепарации
Напряжение печи 380 В, нагреватели питаются то сети перемененного тока через трансформатор. В качестве нагревателей применяем ленточный нихром марки Х20Н80 ГОСТ-2615-58, сечением 3,2´36 мм.
Таблица 5.
Тепловой баланс процесса вакуумной сепарации
| Приход | кДж/ч | Расход | 0 |
| Тепло получаемое за счет нагревателей |
27106792 | 1 Теплота испарения Mg | 20828945 |
| 2 Теплота испарения MgCl2 | 1834279 | ||
| 3 Тепло на нагрев: а) Титановой губки б) Реактора в) Футеровки | 892363 841402 2444000 | ||
| 4 Потери тепла в обратную реторту через крышку реактора | 208325 | ||
| 5 Потери тепла боковой и нижней поверхностью печи | 57478 | ||
| Итого | 27106792 | Итого | 27106792 |
Удельное электрическое сопротивление нихрома при рабочей температуре: r = 1,15 Ом × мм2 /м
Предельно допустимая температура для нихрома марки Х20Н80 равна 1150 °С. На основании опыта эксплуатации печей с повышенной цикловой производительностью, нагреватели печей распределяем по четырем зонам. Мощность каждой зоны 175 кВт.
Расчет нагревателей: Мощность зоныР = 175 кВт; напряжениеU = 380 В; сила тока 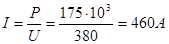 ; сопротивление
; сопротивление 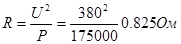 ; сечение ленты S = 3,2 × 3,6 = 115 мм2 ; длина ленты
; сечение ленты S = 3,2 × 3,6 = 115 мм2 ; длина ленты 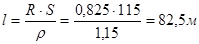 ; поверхность лентыF = 2 × (0.32 + 3.6) × 8250 = 64680см2; Ваттная нагрузка
; поверхность лентыF = 2 × (0.32 + 3.6) × 8250 = 64680см2; Ваттная нагрузка
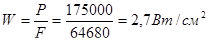
Технологический расчет основного оборудования
Количество печей сепарации
На основании данных дипломного проекта предлагается сокращенные высокотемпературные выдержки процесса сепарации на 10 часов, продолжительность печного цикла 80 часов: разогрев до температуры выдержки – 16 ч; время высокотемпературной выдержки – 62 ч; охлаждение аппарата в печи – 2 ч.
Календарное количество дней в году – 365 дней.
Печь на кап. ремонте – 12 дней.
Печь на профилактическом ремонте – 5 дней.
Итого 348 дней.
Производительность одной печи сепарации в год составит:
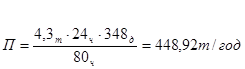
- количество печей сепарации, обеспечивающих заданную годовую производительность: 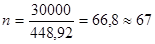
- коэффициент использования печей сепарации составляет:
k = 348/365 = 0,95.
- количество печей сепарации с учетом коэффициента использования:
n = 67/0,95 = 70,5 » 71
- резерв печей сепарации: 71 × 0,05 = 3,5
Общее количество печей сепарации составит: 71 + 4 = 75
Расчет количества холодильников
Цикл охлаждения аппарата сепарации в холодильнике принимаем 53 ч. (охлаждение воздухом – 3 ч; охлаждение водой – 50 ч..). Количество календарных дней работы холодильника в год – 365 дней.
- производительность холодильника в год: 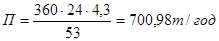 .
.
- количество холодильников, обеспечивающих заданную производительность: n = 30000 / 700,98 = 43 холодильника.
- коэффициент использования холодильников: k = 360 / 365 = 0,98
- необходимое количество холодильников с учетом коэффициента использования составит: n = 43 / 0,98 = 43,8 » 44
- резерв холодильников: 44 × 0,05 = 2,2 » 3
Общее число холодильников: n = 44 + 3 = 47
Расчет количества реторт.
- суточная производительность цеха: Псут. = 30000 / 365 = 82,19 т/сут.
- общее количество реторт необходимых для обеспечения заданной производительности отделения, из них:
- реторты, занятые на вакуумной сепарации: 75 × 2 = 150
- реторты, находящиеся на охлаждении: 47 × 2 = 94
- всего реторт: 244
- резерв реторт: 244 × 0,05 = 13
- общее количество реторт: 244 + 13 = 257
Выбор и расчет вспомогательного оборудования
Выбор вакуумных насосов
Для создания вакуума в аппарате сепарации устанавливается диффузионный насос в паре с механическим насосом. Откачиваемый объем воздуха равен сумме двух объемов –реактора, оборотной реторты и объема вакуумных проводов. Объем реторты – 4,8 м3. Объем вакуумных проводов до механического насоса – 1,5 м3, до диффузионного - 1 м3. Время откачки механическим насосом – 10 мин (600с)
Время откачки диффузионным насосом – 5 мин (300с)
Остаточное давление в системе после откачки механическим насосом 13,3 Па, после откачки диффузионным насосом 0,133 Па.
Суммарный откачиваемый объем: 4,8 + 4,8 + 1,5 = 11,1 м3
Скорость откачки от атмосферного давления до 13,3 Па определим по формуле:
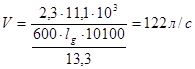 .
.
Предлагается к установке насос ВН – 6Г производительностью 155 л/с, предельным вакуумом 1,3 Па, мощность электродвигателя 20 кВт.Выбираем диффузионный насос. Суммарный откачиваемый объем: 4,8 + 4,8 +1 = 10,6 м3
Скорость откачки от давления 13,3 до 0,133 Па:
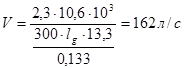
Устанавливаем насос БН – 2000 производительностью 2000 л/с, предельным вакуумом 0,06 Па, мощностью электродвигателя 7,5 кВт..
Выбираем насос для создания контрвакуума в печи.
Откачиваемый объем:
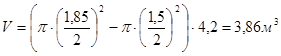 .
.
Остаточное давление в печи 664,5 Па.
Скорость откачки от атмосферного давления до 664,5 Па, время откачки 5 мин (300 с):
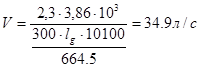 .
.
Расчет количества вакуумных насосов
Количество вакуумных насосов ВН – 6Г равно количеству печей в отделении плюс 4 насоса контрвакуумной линии. Всего ВН – 6Г: 75 + 4 = 79
Дата: 2019-12-10, просмотров: 363.