Поверочный расчет печи П-101/1,2, колонны К-62 и Т-64
Выполнил студент гр.:
Проверил преподаватель:
2010 г.
Содержание.
Введение…………………………………………………………………………….3
1. Литературный обзор………………………………………………………………..4
1.1. Способы получения этилбензола…...………………………………………........4
1.1.1. Характеристика способа получения этилбензола алкилированием бензола этиленом………………………………………………………………………………..4
1.1.2. Характеристика получения этилбензола дегидрированием этана….….….6
1.1.3. Характеристика получения этилбензола из бутадиена……….……....……7
1.1.4. Характеристика получения этилбензола из ксилольных фракций....…......8
1.2. Химизм процесса………………………………………………………………….9
1.2.1. Химизм процесса алкилирования бензола этиленом………………..……..9
1.2.2. Сущность процесса трансалкилирования….……....…......…..…….……..11
2. Технологическая часть…………………………………….……….………………12
2.1. Описание технологической схемы……………..…………..……………………12
2.1.1. Система извлечения этилбензола….…….…………….………………...….12
2.2Поверочный расчет печи П-101/1,2 ……….……….……….….………….……...13
2.2.1Расчет процесса горения……….….……...….…...........…...…….….……….13
2.2.2 Расчет КПД печи, тепловой нагрузки, расхода топлива…….….………….16
2.2.3 Расчет радиантных камер..……....……….………….…...…...………...……18
2.2.4 Расчет конвективной камеры…….………….…….……….………………...21
2.3 Расчет колонны К-62………...…………….……….….……….……….…………23
2.4 Расчет теплообменника Т-64………….…….……..………….…………………..27
Вывод………………………………………………...……….……………………29
Список использованной литературы……………………………………………..30
Введение.
Ароматические углеводороды (бензол, толуол, ксилолы, этилбензол) представляют собой важнейший вид сырья для промышленного тяжелого органического синтеза, являются высокооктановым компонентом бензинов, а также могут быть использованы как полупродукты тонкого и тяжелого органического синтеза. Поэтому необходимо, важно и перспективно развивать производство ароматических углеводородов[8].
К наиболее многотоннажным продуктам относится этилбензол.
Его практическое применение состоит почти исключительно в дальнейшем превращении в стирол, являющийся одним из важнейшим мономеров для выработки пластических масс и синтетического каучука.
Промышленное производство этилбензола в России впервые было организовано в 1936 году[3].
1. Литературный обзор.
Этилбензол - C6H5 – C2H5 – бесцветная жидкость с запахом бензола, кипящая при 136 ºC.
Обладает свойствами ароматических соединений. Содержится в сырой нефти, продуктах каталитического риформинга нефтяных фракций и легких фракциях смолы коксования угля, откуда он может быть легко выделен. ПДК в атмосферном воздухе 0,02 мг/м3 , в водоемах хозяйственно-бытового пользования 0,01 мг/л. Температура воспламенения - 15°С, самовоспламенения - 432°С[8].
Способы получения этилбензола
Характеристика способа получения этилбензола
Алкилированием бензола этиленом
Алкилирование бензола этиленом является основным способом для получения этилбензола. Синтез этого соединения протекает только в присутствии катализатора, обладающего селективными свойствами. Данный процесс осуществляется на твердом или жидком катализаторе. В качестве твердофазных катализаторов используют алюмосиликаты и цеолиты. Жидкие – готовят на основе хлорида алюминия и фторида бора. Выбор катализаторов зависит от технологического оформления процесса.
При применении твердофазных катализаторов упрощается подготовка сырья, можно отказаться от специальных операций отделения катализатора, нейтрализации и промывки реакционной массы.
В промышленной практике применяют несколько вариантов получения этилбензола на цеолитных катализаторах, которые различаются технологическим оформлением стадий. В процессе фирмы Union Oil (рис 1.1) рецикл диэтилбензолов в зону алкилирования позволяет избежать дезактивации катализатора, вызываемую полимеризацией и циклизацией олефинов. Поскольку рецикл побочных продуктов – полиалкилбензолов также уменьшает длительность пробега катализатора, диспропорционирование последних в этилбензол проводят в отдельной реакционной зоне.
Характеристика способа выделения этилбензола
Из ксилольных фракций.
Ксилольные фракции различаются соотношением изомеров ксилола и содержанием этилбензола. Примерный состав ксилольных фракций (в мас.%):
Таблица 1.1
| О-ксилол | М-ксилол | П-ксилол | Этилбензол | |
| Коксохимический ксилол | 10-12 | 52-60 | 14-20 | 8-12 |
| Нефтяной ксилол | 20-24 | 40-45 | 18-20 | 14-16 |
Разделение этих фракций состоит в четкой ректификации, обычно совмещаемой с изомеризацией ксилолов и выделением ценного п-ксилола кристаллизацией. Из смесей с ксилолами этилбензол можно выделить путем его селективной адсорбцией на Cs-форме цеолита марки X. В качестве десорбента американская фирма «UOP» рекомендует применять смесь пара – диэтилбензола и толуола[8].
Химизм процесса.
Технологическая часть.
Исходные данные
- проектная тепловая нагрузка печи: Qпр = 8 Гкал/ч = 33494400 кДж;
- топливо (природный газ) состава (в объёмных %):
СН4=89,1; С2Н6=4,4; С3Н8=1,08;; i-C4H10=0,69; С5Н12=0,43; N2=4,3; Сумма=100
Определим поверхности нагрева труб исходя из следующих данных: количество труб в обеих радиантных камерах 144, внешний диаметр труб 0,134 м, полезная длина 12 м
- поверхность нагрева радиантных труб: Hр = 727,07 м2;
Расчет процесса горения
Двухскатная печь шатрового типа с факельным сжиганием топлива работает на природном газе.
Среднестатистический природный газ имеет следующий состав (табл.2.1):
Таблица 2.1
Состав топливного газа
| Компонент | N2 | CH4 | C2H6 | C3H8 | C4H10 | i-C4H10 | C5 и выше |
| Содержание, об. % | 4,3 | 89,1 | 4,4 | 1,08 | 0,69 | 1,48 | 0,43 |
В табл.2.2 представлены теплоты сгорания компонентов топлива, необходимые для расчета его низшей теплоты сгорания:
Таблица 2.2
Теплоты сгорания компонента топлива
| Компонент | H2S | H2 | N2 | CH4 | C2H6 | C3H8 | C3H6 | n-C4H10 | i-C4H10 | C4H8 | C5 и выше |
| Объемная теплота сгорания, кДж/м3 | 25,14 | 10,8 | – | 35,84 | 63,8 | 91,32 | 86,06 | 118,73 | 109,3 | 113,5 | 146,1 |
Низшая теплота сгорания топлива:
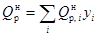
где 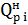 – теплота сгорания компонентов топлива, кДж/м3;
– теплота сгорания компонентов топлива, кДж/м3;
yi = объемная доля компонента.
Qнр = 37310 кДж/м3 = 47810 кДж/кг
Найдем среднюю молекулярную массу топлива:
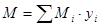
где 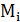 – молекулярная масса компонента топлива;
– молекулярная масса компонента топлива;
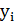 – мольная (объемная) доля компонента топлива.
– мольная (объемная) доля компонента топлива.
Mm= 16,914 г/моль
Тогда плотность газа:
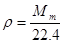
ρТ= 0,752 г\л
Рассчитываем элементарный состав топлива:
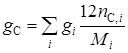
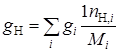
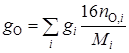
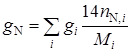
где C, H, N – объемное (мольное) процентное содержание атомов углерода, водорода, серы и азота в топливном газе соответственно;
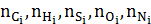 – число атомов соответственно в молекулах отдельных компонентов, входящих в состав топливного газа.
– число атомов соответственно в молекулах отдельных компонентов, входящих в состав топливного газа.
С = 72,21%; Н = 23,95%; N = 3,84%
С + Н + N = 100%
Теоретическое количество воздуха, необходимое для сжигания 1 кг топлива:
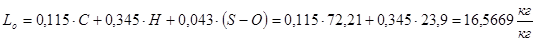
Lo = 16,5669 кг/кг
Объемный расход воздуха, необходимый для сжигания 1 кг топлива:
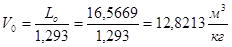
Vo = 12,8213 м3/кг
Действительный расход воздуха:
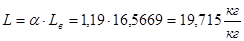
где 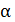 – коэффициент избытка воздуха (принимаем 1,19 согласно данным по технологическим показателям работы трубчатых печей)
– коэффициент избытка воздуха (принимаем 1,19 согласно данным по технологическим показателям работы трубчатых печей)
Массовый состав дымовых газов:
m(СО2)=0,0367·С=0,0367·72,21=2,6501(кг/кг)
m(Н2О)=0,09·Н=0,09·23,95=2,1555(кг/кг)
m(О2)=0,232·L0·(α -1)=0,232·16,5669·(1,19-1)=0,7303(кг/кг)
m(N2)=0,768·L0·α+0,01·N=(0,768·16,5669·1,19)+(0,01·3,84)=15,307(кг/кг)
Общее количество продуктов сгорания:
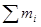 =2,6501+2,1555+0,7303+15,307=20,8429 (кг/кг)
=2,6501+2,1555+0,7303+15,307=20,8429 (кг/кг)
Объемный состав продуктов сгорания:
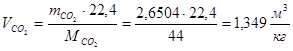
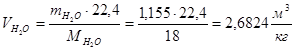
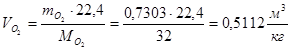
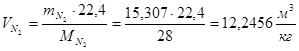
Суммарный объем дымовых газов:
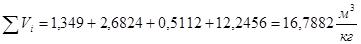
Плотность дымовых газов при нормальных условиях:
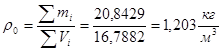
Расчет радиантных камер
Тепловая напряженность в радиантной и конвективной камерах не известна, поэтому задаемся условием (исходя из эмпирических данных), что 77% тепла передается в радиантной камере и 23% - в конвективной.
Тепло, передаваемое в камере радиации:
Qр = 0,77Qпр = 25790688кДж/ч.
Тепло, передаваемое в камере конвекции:
Qk = Qпр - Qр = 7703712кДж/ч.
Полезное количество тепла:
Qпол = Qр + Qk = 33494400 кДж/ч.
Плоская поверхность, эквивалентная поверхности радиатных труб для одного ряда:
Н = 2* Нр/π = 463,104 м2
Фактор формы, учитывающий неравномерность облучения поверхности труб и их затенение друг другом определяется по графику Хоттеля [7]:
К = 0,9.
Эффективная лучевоспринимающая поверхность:
Hл = H ∙ K = 416,8 м2.
Задаемся степенью экранирования кладки φ = 0,5 и рассчитываем суммарную неэкранированную поверхность кладки:
F = (1/φ - 1)·Нл = (1/0,5 -1)416,8 = 416,8м2
Максимальная расчетная температура горения вычисляется при средней теплоемкости продуктов горения:
tмакс = t0 + (Qрн ×hТ)/Cp ,
где ×hТ – КПД топки –принимаем 0,95.
tмакс = 20 + (47810 × 0,95)/26,35 = 1743,70С
Тмакс. = 2016,7 К
Значение эквивалентной абсолютно черной поверхности HS определяется, если известны степень черноты экрана εH и кладки εF, которые могут быть приняты равными 0,9 [1], а степень черноты поглощаемой среды εV вычисляют по уравнению, где α - коэффициент избытка воздуха:
εV = 2/(1+2,15 ·α)
εV = 0,473.
Функция y(t), используемая в формуле, в среднем равна 0,85[1]. Коэффициент b вычисляем по уравнению:
β =1/[1+ εV /(1- εV) ·εH ·ψ(t)]
b = 0,45.
Таким образом:
Нs = εV / φ(Т) · (εH · Нл + β · εF · F)
Hs = 302,678 м2
Рассчитаем коэффициент теплоотдачи к радиантным трубам. Для этого задаемся средней температурой наружной поверхности радиантных труб (с последующей проверкой): tcт = 250°С (523 К). Коэффициент теплоотдачи:
ак = 2,1 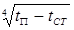 = 2,1
= 2,1 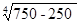 = 9,93 Вт/(м2 ·°С)
= 9,93 Вт/(м2 ·°С)
Величина температурной поправки теплопередачи в топке:
∆T = ак · Hр.тр·(tмакс – tст) – σ·Hs·t0·10-8 / B*Cp+ак· Hр.тр= 323,6 K,
где σ - постоянная Стефана-Больцмана, σ = 5,67 Вт/(м2 ∙ К4);
Для расчета температуры на перевале необходимо вычислить характеристику излучения bS и аргумент излучения x:
Х= [10·HsCs/(BCp+ак·Нр)]· [ (tмакс – t0)/1000)3]
x = 2,407;
βs = 1/(0,25+[0,1875+(0,141+x)0,5]0,5) = 0,63
Тогда расчетная температура перевала tпр составит:
Тп = bs · ( tмакс – t0) = 0,63 · (2016,7 – 323,6) = 1066,65 К = 793,65°С
Невязка по температуре перевала:
Δt = 5,5 %
Коэффициент прямой отдачи:
m = ( tмакс – tп) / ( tмакс – t0) = 0,55
Количество тепла, полученного радиантными трубами:
Qр=В·Qрн·ηт·μ= 25954973 кДж/ч = 7209714 Вт
Невязка по количеству тепла:
Δ = 0,63%
Теплонапряженность радиантных труб:
qр.тр=Qр/Нр.тр=7209714/727,07= 9916,12 Вт/м2
Полезная поверхность одной трубы:
Fтр=π d l = 3,14· 14,6 · 0,152 = 5,05 м2
Число труб:
n = Нр.тр/ Fтр= 727,07 / 5,05 = 143,97 = 144 шт.
Расчет теплообменника Т-64.
Теплообменник Т-64 предназначен для охлаждения дистиллята колонны К-62.
Поток входит в теплообменник с температурой 140°С. Требуемая температура на выходе – 135оС. Охлаждающий агент – вода с начальной температурой – 110 оС.
Расчет был произведен в программе Design II for Windows. Характеристики теплообменника Т-64 представлены в табл. 2.8.
Таблица 2.8
Характеристика конденсатора Т-64
| Наименование показателя | Ед. изм. | Значение |
| Коэффициент теплопередачи | Ккал/ч/м2/с | 38,45 |
| Расход охлаждающей воды | кг/ч | 2000 |
| Тепловая нагрузка | ккал/ч | 5,2760*104 |
| Дифференциальная разница температур | °С | 11,01 |
| Температура воды на входе | °С | 110 |
| Температура воды на выходе | °С | 136 |
| Температура дистиллята на входе | °С | 140 |
| Температура дистиллята на выходе | °С | 135 |
| Геометрическая поверхность | м2 | 282,11 |
| Требуемая поверхность | м2 | 124,23 |
Существующий конденсатор имеет поверхность теплообмена 400 м2, таким образом, аппарат справляется с нагрузкой и имеет запас по поверхности 29,47 %.
Таблица 2.9
Конструктивные характеристики теплообменника.
| Кожух | Трубное пространство | ||||
| Наименование показателя | Ед.изм. | Значение | Наименование показателя | Ед. изм. | Значение |
| Внутренний диаметр. | мм | 1200 | Размер труб диаметр*толщина | мм | 25*2 |
| Расстояние между перегородками | мм | 400 | Шаг трубы | мм | 25 |
| Расположение труб в трубной решетке | ∆ | ||||
| Число ходов по трубному пространству | 2 | ||||
| Движение теплоносителей (прямоток, противоток) | противоток | ||||
| Количество труб | шт. | 898 | |||
| Длина холодильника | мм | 5400 | |||
Заключение.
В данном курсовом проекте рассмотрена установка получения этилбензола. Рассчитана ректификационная колонна выделения товарного этилбензола из алкилата. Рассчитанная колонна имеет диаметр 2.2 м и высоту 46030 мм, что соответствует реально существующей колонне на производстве.
Также был произведен поверочный расчет печи П-101/1,2, которая является ребойлером для данной колонны. Расчет показал, что аппарат справляется с нагрузкой. Был выбран стандартный кожухотрубчатый теплообменник с площадью теплообмена 400 м2 в качестве конденсатора и произведен и его расчет с помощью программы Design II for Windows.
Список использованной литературы.
1. Ширкунов А.С., Кудинов А.В., Рябов В.Г. Технологический расчет трубчатых печей с применением ЭВМ. Изд – во Перм. гос. техн. ун-та, 2009. – 150 с.
2. Касаткин А. Г. Основные процессы и аппараты химической технологии. М.: Химия, 1971.
3. Регламент установки этилбензола ЗАО “Сибур-Химпром”
4. Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органического и нефтехимического синтеза. Москва «Высшая школа», 2003
5. Методические указания к курсовому проектированию по курсу "Процессы и аппараты химической технологии", кафедра МАПП, Пермь, 1992.
6. Основные процессы и аппараты химической технологии: Пособие по проектированию/ Под ред. Ю. И. Дытнерского. М.: Химия, 1983.
7. Сарданашвили А.Г. Примеры и задачи по технологии переработки нефти и газа. Издание 3-е, 2007. – 272с.
8. Этилбензол: технологические аспекты производства. Некоторая конъюнктурная ситуация на мировом и региональных рынках. Составитель: Булеца О.К., 2001
Поверочный расчет печи П-101/1,2, колонны К-62 и Т-64
Выполнил студент гр.:
Проверил преподаватель:
2010 г.
Содержание.
Введение…………………………………………………………………………….3
1. Литературный обзор………………………………………………………………..4
1.1. Способы получения этилбензола…...………………………………………........4
1.1.1. Характеристика способа получения этилбензола алкилированием бензола этиленом………………………………………………………………………………..4
1.1.2. Характеристика получения этилбензола дегидрированием этана….….….6
1.1.3. Характеристика получения этилбензола из бутадиена……….……....……7
1.1.4. Характеристика получения этилбензола из ксилольных фракций....…......8
1.2. Химизм процесса………………………………………………………………….9
1.2.1. Химизм процесса алкилирования бензола этиленом………………..……..9
1.2.2. Сущность процесса трансалкилирования….……....…......…..…….……..11
2. Технологическая часть…………………………………….……….………………12
2.1. Описание технологической схемы……………..…………..……………………12
2.1.1. Система извлечения этилбензола….…….…………….………………...….12
2.2Поверочный расчет печи П-101/1,2 ……….……….……….….………….……...13
2.2.1Расчет процесса горения……….….……...….…...........…...…….….……….13
2.2.2 Расчет КПД печи, тепловой нагрузки, расхода топлива…….….………….16
2.2.3 Расчет радиантных камер..……....……….………….…...…...………...……18
2.2.4 Расчет конвективной камеры…….………….…….……….………………...21
2.3 Расчет колонны К-62………...…………….……….….……….……….…………23
2.4 Расчет теплообменника Т-64………….…….……..………….…………………..27
Вывод………………………………………………...……….……………………29
Список использованной литературы……………………………………………..30
Введение.
Ароматические углеводороды (бензол, толуол, ксилолы, этилбензол) представляют собой важнейший вид сырья для промышленного тяжелого органического синтеза, являются высокооктановым компонентом бензинов, а также могут быть использованы как полупродукты тонкого и тяжелого органического синтеза. Поэтому необходимо, важно и перспективно развивать производство ароматических углеводородов[8].
К наиболее многотоннажным продуктам относится этилбензол.
Его практическое применение состоит почти исключительно в дальнейшем превращении в стирол, являющийся одним из важнейшим мономеров для выработки пластических масс и синтетического каучука.
Промышленное производство этилбензола в России впервые было организовано в 1936 году[3].
1. Литературный обзор.
Этилбензол - C6H5 – C2H5 – бесцветная жидкость с запахом бензола, кипящая при 136 ºC.
Обладает свойствами ароматических соединений. Содержится в сырой нефти, продуктах каталитического риформинга нефтяных фракций и легких фракциях смолы коксования угля, откуда он может быть легко выделен. ПДК в атмосферном воздухе 0,02 мг/м3 , в водоемах хозяйственно-бытового пользования 0,01 мг/л. Температура воспламенения - 15°С, самовоспламенения - 432°С[8].
Способы получения этилбензола
Характеристика способа получения этилбензола
Дата: 2019-12-10, просмотров: 499.