Мета роботи: вивчити хімічні властивості елементів ІІ-А групи та деяких сполук, що вони утворюють; визначити тимчасову та загальну жорсткість природної води титриметричними методами
Прилади та реактиви:пробірки, спиртівка, шпатель, металічний магній та кальцій, дист. вода, фенолфталеїн. Розчини: хлороводневої кислоти, гідроксиду Натрію, хлоридів амонію, кальцію, магнію, стронцію, барію, карбонатів Натрію, кальцію, сульфату Натрію.
Техніка небезпеки:Кальцій брати лише за допомогою пінцету. При виконанні дослідів використовуються отруйні солі стронцію та барію. Не допускати попадання цих розчинів на столи та руки. По закінченні роботи вимити поверхню стола та руки.
ДОСЛІД 1. Взаємодія магнію та кальцію з водою
До двох пробірок внести кусочок магнієвої стрічки, попередньо зачищеної від оксидної плівки та кальцію. Додати 1-2 мл води. Відмітити у якій з пробірок відбувається реакція за умов кімнатної температури. Пробірку з магнієм нагріти. Додати краплю фенолфталеїну до пробірок.
Завдання. Написати рівняння реакцій утворення гідроксидів кальцію та магнію.
ДОСЛІД 2. Отримання та властивості гідроксиду магнію
До пробірки налити близько 1 мл розчину хлориду магнію і додати по краплям гідроксид Натрію до випадіння осаду. Вміст пробірки розділити на три пробірки. При перемішуванні до першої прилити розчин хлороводневої кислоти, до другої – гідроксид Натрію, до третьої – хлорид Амонію.
Завдання. відмітити колір осаду гідроксиду магнію та написати рівняння реакцій його взаємодії з хлороводневою кислотою, гідроксидом Натрію, хлоридом Амонію в молекулярному та іонно-молекулярному вигляді. Зробити висновок про властивості гідроксиду Магнію.
ДОСЛІД 3. Отримання оксиду кальцію та його гідратація
Кусочок мармуру або крейди покласти до пробірки і додати декілька крапель води. Внести 1 краплю фенолфталеїну. Чи з’являється червоне забарвлення? Інший кусочок крейди або мармуру сильно прожарити у полум’ї протягом 3-4 хвилин. Прожарений кусочок перенести до фарфорової чашки з водою і додати краплю фенолфталеїну. Що спостерігаєте?
Завдання. Скласти рівняння реакції розкладення карбонату кальцію. Чи розчиняється гідроксид кальцію у воді? Дайте промислову назву розчин гідроксиду кальцію у воді.
ДОСЛІД 4. Взаємодія солей магнію та лужноземельних металів з Карбонатом Натрію
Взяти чотири пробірки. Внести по 3-4 краплі: в першу – хлориду Магнію, в другу – хлорид кальцію, в третю – хлорид стронцію, в четверту – хлорид Барію. До кожної пробірки додати 3-4 краплі карбонату Натрію. Відмітити утворення осадів. Додати до кожної пробірки ще декілька крапель хлороводневої кислоти.
Завдання. Скласти рівняння реакції взаємодії досліджуваних солей з карбонатом Натрію та хлороводневої кислоти з гідроксокарбонатом Магнію, карбонатами Кальцію, Стронцію І Барію. Зробити висновок про властивості карбонатів лужноземельних металів.
ДОСЛІД 5. Сульфати лужноземельних металів
До трьох пробірок внести 3-4 краплі розчинів солей: 1 – хлориду кальцію, 2 – хлориду стронцію, 3 – хлориду барію. До кожної пробірки додати 3-4 краплі сульфату Натрію. Відмітити різну швидкість утворення осадів. Додати до кожної пробірки ще декілька крапель хлороводневої кислоти.
Завдання. Скласти рівняння реакції взаємодії хлоридів лужноземельних металів з сульфатом Натрію у молекулярному та іонно-молекулярному вигляді. Зробити висновок про властивості сульфатів лужноземельних металів.
ДОСЛІД 6. Визначення тимчасової жорсткості води
Відміряти піпеткою 100 – 50 мл досліджуваної води і перенести її до конічної колби для титрування. Додати 2-3 краплі метилового оранжевого. В підготовлену заздалегідь бюретку налити 0,1 н. титрований розчин хлороводневої кислоти. Встановити рівень на нульове значення і по краплям приливати кислоту у воду до зміни забарвлення розчину від жовтого до оранжево-рожевого. Визначити об’єм хлороводневої кислоти, що пішла на титрування і записати до таблиці. Титрування повторити ще два рази, кожного разу доливаючи в бюретку кислоти до нульового ділення і ополіскуючи колбу для титрування. Розбіг у об’ємі кислоти при титруванні не повинен перевищувати 0,05 -0,1 мл. Результати записати в таблиці.
| № титрування | Об'єм води V1, мл | Об'єм розчину НCl, що пішов на титрування, мл | Середній об'єм розчину НCl V2, мл | Нормальність розчину НCl, NHCl |
Тимчасову жорсткість води розраховувати за формулою:
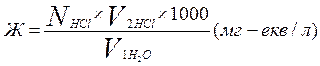
ДОСЛІД 7. Визначення загальної жорсткості води
Заповнити бюретку титрованим розчином ЕДТА (0,02н.). Відміряти піпеткою 100 – 50 мл досліджуваної води і перенести її до конічної колби для титрування. Додати дистильованої води до загального об’єму 100 мл при необхідності та додати 5 мл буферного розчину для підтримки рН в межах 9-10 од. та 2-3 краплі еріохрому чорного, при цьому розчин забарвлюється у червоний колір. Перемішати розчин і одразу титрувати розчином ЕДТА до переходу червоного забарвлення до синього. Титрування повторити три рази, як в попередньому досліді. Результати записати в таблицю.
Загальну жорсткість розраховують за формулою:

Завдання. Розрахувати постійну жорсткість, як різницю між загальною та тимчасовою жорсткістю. Зробити висновок до якого типу жорсткості відноситься досліджувана вода.
Контрольні питання
1. Які метали ІІ групи називають лужноземельними, чому вони отримали таку назву?
2. Напишіть електронні формули атомів елементів – металів ІІ групи головної підгрупи.
3. Складіть рівняння реакцій магнію з Оксигеном, Гідрогеном, Хлором, водою.
4. Поясніть, чому магній розчиняється у воді значно швидше у присутності хлориду амонію? Складіть рівняння реакцій магнію з хлоридом амонію.
5. Як змінюються властивості оксидів елементів ІІ групи головної підгрупи?
6. Якими властивостями володіють гідроксиди берилію та барію?
7. Які хімічні процеси протікають при твердінні на повітрі гашеного вапна?
8. Здійсніть перетворення та назвіть речовини:
Ba → BaO → Ba(OH)2 → BaCO3 → Ba(HCO3)2 → BaCl2 → BaSO4
9. Які катіони називають іонами жорсткості?
10. Який технологічний показник якості води називають жорсткістю?
11. Який метод пом'якшення води називають термічним? Які хімічні реакції протікають при пом'якшенні води цим методом?
12. Поясніть суть хімічного методу пом'якшення води.
13. Який процес потрібно проводити для пом'якшення води: катіонирування або аніонирування? Чому? Складіть рівняння реакцій, що протікають під час пом'якшення води методом іонного обміну.
14. Як визначають загальну, Карбонатну та не Карбонатну жорсткість води?
Задачі
1. При визначенні загальної жорсткості води на титрування 200 мл води використано 8 мл 0,1 н розчину комплексну ІІІ. Розрахуйте загальну жорсткість.
2. Обчисліть загальну, карбонатну і некарбонатну жорсткість води, якщо: на титрування 200 мл Н2О використано 7,6 мл 0,005 н розчину комплексну ІІІ; на титрування 100 мл Н2О використано 1,5 мл 0,1 н розчину хлороводневої кислоти.
3. Скільки грамів Са(ОН)2 необхідно додати до 1000 л води, щоб усунути тимчасову жорсткість, що дорівнює 2,86 м-екв/л?
4. Яку масу соди потрібно додати до 500 дм3 води, щоб знешкодити її жорсткість, яка дорівнює 5 мекв/дм3?
5. Розрахувати карбонатну жорсткість води, якщо на титрування 100 см3 цієї води, яка містить гідрокарбонат кальцію, знадобився 0,08 н розчин НСІ об’ємом 6,25 см3.
Лабораторна робота №10.
Дата: 2016-10-02, просмотров: 334.