Три стальні пластини зачищають наждачним папером, знежирюють за допомогою Са(ОН)2, або органічного розчинника і промивають проточною і дистильованою водою, сушать, потім пластини зважують з точністю до 0,0002 г. Наливають у три стакани за вибором викладача або розчини кислот (НCl і H2SO4) і натрій хлориду однакової концентрації, або ж розчини різної концентрації однієї сполуки і витримують сталеві пластини, які підвішують на капронових підвісках, в цих розчинах протягом 2-3 год. Після цього пластини виймають із розчину, промивають водою, протирають м’якою гумкою, знову промивають водою та, висушивши фільтрувальним папером, зважують. Швидкість корозії розраховують за формулою:
V = (m1 – m0)/Sτ
- де m0 та m1 – маса зразка до та після досліду відповідно, г;
S – площа поверхні зразка, м2; τ – час проведення досліду, год.
Дані дослідів та обрахунки записують до таблиці:
| № досліду | Матеріал зразка | Електроліт | Розмір зразка, мм | Площа зразка, м2 | Час досліду, (год.) | Маса зразка (г) | Швидкість корозії, г/м2·год. | |
| до досліду | після досліду | |||||||
На основі отриманих результатів будують графіки залежності зміни маси зразка від часу корозії і залежність швидкості корозії від часу. Розгляньте поверхню зразка після корозії за допомогою лупи і визначте тип корозії (точкова, місцева тощо). Зробіть відповідні висновки.
Поки проводиться експеримент виконати наступне завдання: скласти схему гальванічного елемента, записати рівняння катодного та анодного процесів хімічної реакції при атмосферній корозії сталі:
- яка має домішки силіцію чи марганцю;
- яка покрита шаром міді.
V. Контрольні запитання
1. Поясніть суть явища корозії. Назвіть види корозії.
2. В чому полягає відмінність хімічної корозії від електрохімічної?
3. Що являє собою гравіметричний метод?
4. Який фазовий склад продукту корозії стальних виробів у випадку нелегованої і легованої сталі? Відповідь аргументуйте.
Лабораторна робота №4
Одержання сплаву Sn-Ni електрохімічним методом та дослідження виходу за струмом
І. Елементи теорії
Сумісне відновлення іонів двох металів можливе, коли потенціали їх розряду (Е1 і Е2) рівні або близькі, тобто коли:
Е10 + RT/z1F×lna1 + η1 = Е20 + RT/z2F×lna2 + η2
Де - Е10 і Е20 — стандартні потенціали металів; а1 і а2 - активності іонів металів; η1 і η2 - перенапруга; z1 і z2 — ступені окиснення іонів.
Якщо потенціали виділення двох металів різні, то для їх зближення застосовують наступні методи. При близьких значеннях стандартних потенціалів і перенапружень двох металів (у розчинах простих солей) потенціали їх виділення зближують шляхом зменшення активності іонів більш електропозитивного металу і збільшення активності іонів менш електропозитивного металу. Коли стандартні потенціали металів помітно розрізняються, зближення потенціалів виділення таким шляхом практично неможливо, оскільки при зміні активності в 10 разів значення рівноважного потенціалу зрушується всього на 0,058 В для одновалентних іонів і на 0,029 В — для двовалентних. Найбільш ефективним методом зближення потенціалів є утворення міцних комплексних з'єднань іонів металів, що виділяються. Підбирають такі комплексоутворюючи ліганди, які дозволяють отримати комплекси електропозитивного металу міцнішими, ніж електрозаперечувачданого металу, і, отже, зменшують активність іонів більш електропозитивного металу більшою мірою, чим активність іонів менш електропозитивного металу. Це приводить до зближення потенціалів виділення металів як за рахунок зближення їх рівноважних потенціалів, так і за рахунок зміни значень перенапруженні, які залежать від природи комплексного іона і надлишку лиганда в розчині. Як таких комплексообразователей широкого поширення набули ціаниди, дифосфаты, аміакати, фториди, станати, цинкати. Використовують також добавки таких ПАВ, які викликають сильніше гальмування реакції розряду іонів електропозитивного металу в порівнянні з електронегативним металом. При електроосадженні сплаву можливо як підвищення швидкості розряду іонів, тобто полегшення процесу утворення сплаву (деполяризація), так і зменшення швидкості — утруднення розряду іонів (надполяризація). Ефект деполяризації виявляється в результаті взаємодії компонентів сплаву при утворенні кристалічної решітки твердого розчину або хімічної сполуки. В цьому випадку полегшення виділення сплаву пояснюється зменшенням парціальної молярної енергії утворення компонентів осаду. Такий вплив наголошується при електроосадженні сплавів Sn – Ni, Sn – Pb, Cu – Zn, Cu – Sn і ін. Физико-хімічні властивості сплаву залежать від відносного вмісту в нім компонентів. Тому, якщо склад сплаву сильно змінюється залежно від щільності струму, то на рельєфній поверхні виробів унаслідок нерівномірного розподілу струму осідання сплаву будуть різними по складу, структурі і іншим властивостям. При електроосадженні сплавів застосовують аноди з термічного сплаву (латунь, бронза, олово-свинець), а також з окремих металів, що входять до складу сплаву, з роздільним або загальним підведенням струму до них. У разі використання анодів з одного металу спад іонів другого металу компенсується додаванням в електролит його солі. Сплав на основі Sn і Ni представляє собою однофазну систему інтерметалевої сполуки NiSn, що містить (30,91 – 42,9)% нікелю, і яку можна отримати тільки електрохімічним способом. Осади цього сплаву мають густину 8,83 г/см3. Покриття сплавом, що містять менше 30,91% Ni є двофазними. Підвищення вмісту нікелю у сплаві призводить до збільшення внутрішньої напруги. Прожарювання осадів при температурі 250°C за 150 годин призводить до розпаду метастабільної фази з гексагональною решіткою. Цей процес прискорюється при температурі 300°C. У результаті відбувається рекристалізація сплаву з утворенням двохфазної системи незалежно від вмісту у ньому нікелю. Поверхня осадів сплаву SnNi складається зі сфероїдних утворень, при цьому у випадку нестаціонарного електролізу з ростом анодної складової розмір частинок, що створюють рельєф поверхні, зменшується, а шорсткість збільшується. Покриття сплавом SnNi отримують блискучими безпосередньо з електроліту. Вони мають достатньо високу твердість (5000 – 6000 МПа), немагнітні, легко поліруються, гарно паяються і не піддаються голкоутворенню. В результаті високої корозійної стійкості покриття сплавом SnNi гарно захищають сталь з підшаром міді від корозії в жорстких умовах експлуатації, а міді і її сплавів – в дуже жорстких умовах. Покриття сплавом SnNi широко застосовується для захисно-декоративної обробки мідних й обміднених стальних виробів, в якості заключного покриття на друкованих схемах (замість сріблення і паладіювання), а також як підшарок під золото. Із електролітів, які містять тільки NH4F отримують блискучі покриття, крихкі, зі слабо помітними дефектами, кількість яких підвищується зі збільшенням концентрації йону NH4+ і густини струму. З електролітів, що містять тільки NaF отримують матові покриття без дефектів. Одночасне знаходження в електроліті NH4F і NaF знижує внутрішню напругу покриттів. Інтервал робочих густин струму при отриманні блискучих покриттів залежить від температури й рН електроліту (табл.1)
Таблиця 1. Вплив температури та рН електроліту на робочі густини струму
| Температура, °C | Густина струму, А/дм2 | |
| рН=4,5 | рН=2,5 | |
| 1,0 – 3,5 | 1,0 – 3,5 | |
| 1 – 4 | 1 – 4 | |
| 2,5 – 4,0 | 1 – 4 | |
| ¾ | 1,0 – 4,5 | |
| ¾ | 1,0 –4,5 |
При зниженні густини струму нижче вказаної межі (табл.1) утворюються напівблискучі покриття; при підвищенні її вище вказаної верхньої межі покриття мають матову поверхню. В електроліти для отримання сплаву SnNi для одержання блискучих осадів вводять також ПАР.
II. Мета:одержання покриття сплаву Sn-Ni та встановлення виходу за струмом.
Реактиви:електроліт №1 (NiCl2 × 6H2O, SnCl2 × 2 H2O, NH4F), дистильована вода, HNO3 (r=1,4 г/мл), HCl (конц.), CrO3, Ca(OH)2.
Обладнання:2 нікелевих, 3 мідних (латунних) пластинки, наждачний папір, прилад для електролізу, пінцет.
ІІI. Самостійна робота
Опрацювати відповідний теоретичний матеріал та стисло описати хід роботи в зошиті.
ІV. Порядок виконання роботи
Якщо немає готового електроліту №1, то його готують і для його приготування треба розчинити 38 г NiCl2×6H2O, 7г SnCl2×2 H2O, 9г NH4F в 150мл дистильованої води. Кожен компонент електроліту розчиняють окремо. Перед розчиненням SnCl2×2 H2O до води (для підкислення) додають декілька крапель HCl(конц.). Якщо розчин повністю не розчинився, його треба відфільтрувати. Потім усі компоненти електроліту змішують, ретельно перемішуючи скляною паличкою.
Перед електролізом проводять підготовку мідних (латунних) пластин, які будуть покриватися сплавом SnNi. Для цього пластини зачищають наждачним папером з обох сторін, полірують оксидом хрому (ІІІ). Потім за допомогою лінійки визначають площу пластини, яка буде знаходитися в розчині електроліту. Знежирення пластин проводять порошком гідроксиду кальцію. Після цього пластини занурюють у розчин для травлення (HNO3, r=1,4г/мл), який наливають у скляний стакан. Травлення проводять протягом 3 - 5 хвилин (до появи блакитного кольору розчину кислоти), а потім пінцетом виймають пластини з розчину, промиваємо дистильованою водою, сушать за допомогою фільтрувального паперу. Перед тим, як помістити пластини в електролізер (стакан з електролітом), пластини зважують.
Електроліз проводять при густині струму 100, 200 і 300 А/м2 протягом 40, 20, 10 хвилин відповідно (тобто покривають три пластинки окремо). Розраховують силу струму за густиною струму та площею пластини, що буде занурена у розчин електроліту. Мідну (латунну) пластинку закріплюють на гачок (2) катоду в електролізері (див. рис.1), а по краях підвішують нікелеві аноди на гачки 1, 3. З’єднують провідниками електролізер з випрямлячем і вмикають установку в електромережу. За допомогою ручки реостату встановлюємо розрахункову силу струму за амперметром і відмічають початок електролізу за годинником. Потім установку вимикають, пластину знімають, промивають дистильованою водою, сушать, зважують.
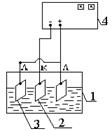
Рисунок 1 – Схема установки для одержання сплаву Sn-Ni.
1-електролізер; 2-катод; 3-аноди з нікелю; 4-випрямляч
Одержані данні вносимо до таблиці
| Сила струму, А | Напруга, В | Час електрол., год | Маса пластини, г | Доважок,г | |
| До досліду | Після досліду | ||||
На основі закону Фарадея обчислюють теоретичне значення маси сплаву SnNi, який повинен осадитися. Потім, використовуючи доважок у масі пластини (практично одержаний сплав SnNi), розраховують вихід за струмом.
Записати електрохімічні реакції, які протікають на катоді та аноді. Поясніть можливість сумісного електровідновлення Sn і Ni на основі їх електрохімічних потенціалів. Розрахуйте рівноважні потенціали електровідновлення Sn і Ni в умовах лабораторного досліду. Зробіть відповідні висновки.
V Контрольні запитання
1. Сформулювати закони Фарадея.
2. Які фактори впливають на вихід за струмом?
3. Назвіть види перенапруги та причини її виникнення.
4. Назвіть умови сумісного відновлення двох (або декількох) катіонів металів на катоді.
5. Які фактори впливають на якість покриття (адгезію з поверхнею підкладки, рівномірність шару покриття по поверхні і по товщині, однорідність тощо).
6. З якою метою в електроліт для нанесення електрохімічного покриття вносяться електропровідні добавки? Наведіть приклади.
7. Який вплив на якість покриття здійснює відстань між анодом та катодом, а також внутрішні розміри гальванічної ванни?
8. Який з параметрів при нанесенні електрохімічного покриття є важливішим: вихід по струму металу або розсіююча здатність електроліту?
9. Які чинники впливають на мікророзсіюючу здатність електроліту? Яку роль при цьому грає тип електроліту (простій, комплексний) і чи ідентична вона впливу на розсіюючу здатність того ж електроліту?
10. Чи ідентичні поняття «Захисна здатність» і «антикорозійна стійкість» електрохімічного покриття?
11. З яких передумов виходять при виборі товщини захисного або захисно-декоративного покриття?
Лабораторна робота № 5
Дата: 2016-10-02, просмотров: 306.