Сучасні технології
Хімічного виробництва
Методичні вказівки до лабораторних та практичних занять з курсу „Сучасні технології хімічного виробництва”
для студентів спеціальності „Хімія та основи інформатики”
Суми
СумДПУ ім. А.С. Макаренка
УДК 66.0 (075.8)
ББК 35 я 73
Х 46
Рекомендовано до друку рішенням редакційно-видавничої ради Сумського державного педагогічного університету
ім. А.С. Макаренка
Укладач: к.х.н., доцент З.М. Проценко;
Рецензент: доцент кафедри хімії СумДПУ ім. А.С. Макаренка
С Сучасні технології хімічного виробництва:Методичні вказівки долабораторних і практичних занятьз курсу„Сучасні технології хімічного виробництва”.
Для студентів спеціальності „Хімія та основи інформатики” /Укл. З.М. Проценко – Суми: СумДПУ ім. А.С. Макаренка, 2010.– 32 с.
Методичні вказівки складено відповідно до програми курсу Сучасні технології хімічного виробництвадля студентів спеціальності „Хімія та основи інформатики”.
УДК 66.0 (075.8)
ББК 35 я 73
ПЕРЕДМОВА
Методичні вказівки до лабораторних та практичних занять з сучасних технологіій хімічного виробництва адресовані студентам хімічних спеціальностей.
Курс „Сучасні технології хімічного виробництва” завершує хімічну освіту студентів і дозволяє систематизувати, поглибити та зміцнити знання, які вони одержали під час вивчення інших курсів хімії, а також побачити їх практичне застосування.
Методичні вказівки містять елементи теорії, порядок виконання лабораторних робіт і контрольні завдання та запитання. До лабораторних та практичних занять включені задачі з виробничим змістом.
Методичні вказівки допоможуть студентам у підготовці до лабораторних та практичних занять з сучасних технологій хімічного виробництва , кращому засвоєнню теоретичних основ даного курсу, що сприятиме професійній підготовці майбутніх вчителів хімії.
У вказівках наведений список літератури для самостійної роботи студентів.
ЗМІСТ
| Стор. | ||
| 1. | Передмова...................................................................... | |
| 2. | Семінар на тему: Хімічний комплекс України. | |
| 3. | Семінар на тему: Сучасні хімічні виробництва. Перспективи розвитку хімічної промисловості України................................................. | |
| 4. | Лабораторна робота № 1 Одержання простого суперфосфату ............................................................... | |
| 5. | Лабораторна робота № 2 Одержання амонізованого суперфосфату ............................................................... | |
| 6. | Лабораторна робота № 3 Визначення швидкості корозії металів у кислих та нейтральних середовищах................................................................... | |
| 7. | Лабораторна робота № 4 Одержання сплаву олово - нікель електрохімічним методом та дослідження виходу за струмом......................................................... | |
| 8. | Лабораторна робота № 5 Одержання мінеральних в’яжучих речовин та дослідження їх властивостей... | |
| 9. | Cемінар на тему: Наноструктурні системи, фулерени, нанотехнології.................................. | |
| 10. | Література |
Семінар на тему: Хімічний комплекс України
І. Питання семінару
1. Хімічна промисловість України, її значення, принципи розміщення основних галузей.
Сировинна база хімічного комплексу України.
Виробництва мінеральних добрив, соди, сульфатної кислоти.
Виробництва полімерних матеріалів, інші виробництва.
Перспективи переоснащення і розвитку виробництв.
2 Джерела енергії і органогенна сировина.
Відновлювальні і не відновлювальні джерела енергії.
Сонячна енергія, енергія вітру, води, енергія біомаси тощо.
Кам’яне і буре вугілля, нафта, природний газ, ядерна енергія.
Походження і еволюція розвитку твердих горючих копален.
Походження нафти і газу, різні гіпотези, їх характеристика.
ІІ. Контрольні запитання та завдання.
1. За якими територіальними принципами розміщуються хімічні виробництва?
2. За рахунок яких реакцій при сухій перегонці деревини утворюються оксиди карбону (ІІ) і (ІV)?
3. Для отримання активованого вугілля деревне вугілля нагрівають з водяною парою. Які фізичні процеси і хімічні реакції при цьому протікають?
4. Чому підвищення тиску під час крекінгу нафтопродуктів знижує вихід газоподібних продуктів?
5. Напишіть рівняння реакції дегідрування бутану при крекінгу.
6. Які відновлювальні джерела енергії мають перспективу застосування в Україні?
7. Які, на ваш погляд, найважливіші екологічні проблеми хімічної промисловості України, шляхи їх розв’язання.
8. Які хімічні виробництва розташовані в Сумській області.
Семінар на тему: Сучасні хімічні виробництва. Перспективи розвитку хімічної промисловості України
І. Питання семінару
1. Загальні проблеми та шляхи переробки відпрацьованого ядерного палива.
1.1. Короткі відомості про ядерний процес.
1.2. Загальна характеристика проблеми ВЯП.
1.3. Паливні проблеми ядерної енергетики України
1.4. Регенерація урану та плутонію відпрацьованих твелів ядерних реакторів (газофлуоридна технологія).
1.5. Концепція багатоваріантності при поводженні з опроміненим ядерним паливом
1.6. Проблема виділення цирконію із ВЯП
2. Сучасна промисловість мінеральних добрив.
2.1. Виробництво амонізованого суперфосфату, хімізм процесу і технологічні особливості.
2.2. Виробництво амофосу, сульфату амонію, N:P:K. Хімізм процесів, технологічні схеми і їх особливості.
2.3. Екологічні проблеми виробництва мінеральних добрив.
ІІ. Контрольні запитання та завдання.
1. Які процеси протікають в ядерному реакторі?
2. Які основні проблеми збереження і переробки ВЯП.
3. Пояснити суть газофлуоридної технології регенерації урану та плутонію.
4. Обґрунтувати перспективи застосування сольових розплавів в ядерній енергетиці.
5. Охарактеризувати проблеми і перспективи розвитку ядерної енергетики України.
6. Охарактеризувати шляхи розвитку і модернізації сучасного виробництва мінеральних добрив.
7. Які основні екологічні проблеми виробництва мінеральних добрив, запропонуйте шляхи їх вирішення.
Лабораторна робота № 1
І Елементи теорії
До фосфорних добрив належать простий та подвійний суперфосфат, фосфоритне борошно, преципітат, амофоси та нітрофоска. Для виробництва цих добрив застосовують апатитові та фосфоритні руди. При обробці їх сульфатною кислотою утворюється простий суперфосфат, який містить 18-20 % Р2О5. Взаємодія фторапатиту (фосфориту) з сульфатною кислотою – є гетерогенний процес, який протікає в дифузійній області; його умовно можна розділити на дві стадії. На першій стадії утворюється фосфатна кислота, яка на другій стадії взаємодіє з фторапатитом з утворенням дигідрофосфату кальцію:
Са5(РО4)3F + 5Н2SО4 ® 5СаSО4 + 3Н3РО4 + НF
Са5F(PO4)3 + 7H3PO4 + 5H2O =5 Ca(H2PO4)2∙H2O + HF
сумарно:
2Са3F(PO4)3+7H2SO4 + 3H2O = 3Ca(H2PO4)2∙H2O+7CaSO4+2HF
Суміш гідратованого кальцію дигідрофосфату (Ca(H2PO4)2) з кальцієм сульфатом, який є баластом у даному добриві, називають простим суперфосфатом.
ІІ Мета: Одержати простий суперфосфат та визначити вміст в ньому фосфору, який засвоюється.
ІІІ Самостійна робота
Опрацювати теоретичний матеріал, стисло описати хід роботи в зошиті
Обладнання.Наважки, технічні терези, аналітичні терези, фарфорова чашка, термометр, електроплитка, скляна паличка, сушильна шафа, фарфорова ступка, товкачик, мірний циліндр, лійка, фільтрувальний папір, беззольний фільтр, мірна колба на 250 мл (2 шт.), піпетка, пробка, термостат, колба, магнітна мішалка, тигель, муфельна піч.
Реактиви та матеріали.62-64%-ний розчин сульфатної кислоти, фосфорит, 10%-ний розчин хлоридної кислоти; розчин Патермана, 2-3%-ний розчин аміаку, 25%-ний розчин аміаку, розчин фенолфталеїну, магнезіальна суміш.
ІV Порядок виконання роботи
1 Одержання суперфосфату
За рівнянням реакції розраховують необхідну кількість сульфатної кислоти на задану викладачем наважку фосфориту. Надлишок кислоти повинен складати 5-10 % від стехіометричного. В заздалегідь зважену фарфорову чашку наливають розрахунковий об’єм Н2SО4 (62-64 % -ної) та підігрівають її до 50-600С на електричній плитці, потім порціями в чашку додають зважений фосфорит. Суміш перемішують скляною паличкою 15 хвилин, потім ставлять в сушильну шафу, де вона витримується протягом однієї години при 110-1200С. Після охолодження чашку з продуктом зважують та розраховують вихід суперфосфату.
2 Аналіз суперфосфату
2-2,5 г суперфосфату (зважують з точністю до 0,0002 г) ретельно розтирають в ступці, потім доливають 23 мл води, суміш знов розтирають та після відстоювання розчин фільтрують в мірну колбу на 250 мл. В цю колбу заздалегідь наливають 5-6 крапель 10%-ної НСl для запобігання гідролізу солей кальцію. Залишок в ступці ще 2 рази розтирають з водою по 20-25 мл та кожного разу розчини зливають на фільтр. Залишок, що розчинився, також переносять на фільтр та промивають його водою, заповнюючи колбу до риски. Розчин ретельно перемішують, він містить водорозчинний оксид фосфору (V).
Фільтр з осадом, який не розчинився, переносять до іншої мірної колби на 250 мл, додають 100 мл розчину Патермана, затикають пробкою та сильно збовтують до тих пір, поки фільтр повністю не розпадеться. Колбу витримують в термостаті при 600С протягом 15 хвилин. Потім колбу охолоджують, доливають водою до риски, ретельно перемішують і потім фільтрують через сухий фільтр в іншу колбу, причому перші порції фільтрату відкидають. Розчин містить цитраторозчинний оксид фосфору(V). Загальний вміст водо- та цитраторозчинного Р2О5 визначають так. З кожного розчину в стакан беруть по 50 мл , додають 25 мл розчину Патермана, перемішують і нейтралізують 2-3%-ним розчином аміаку за фенолфталеїном. Далі додають ще 25-38 мл магнезіальної суміші, 10-25 мл 25%-ного NH3. Вміст колби перемішують протягом 30 хвилин за допомогою магнітної мішалки. Випадає осад магнійамоній фосфату за рівнянням:
3NH4OH+H3PO4+MgCl2+3H2O=MgNH4PO4∙6H2O+2NH4Cl.
Його фільтрують крізь беззольний фільтр та промивають 2-3%- ним розчином NH3 .Фільтр з осадом переносять у тигель, висушують, прожарюють в муфелі при 800-9000С, потім зважують. При цьому осад розкладається:
2МgNH4PO4 → Mg2P2O7+2NH3+H2O
Вміст засвоюваного Р2О5 (мас. %) визначають за формулою:
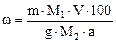 ,
,
де -m - маса осаду після прожарювання, г;
g – наважка суперфосфату, г;
М1, М2 – молярні маси Р2О5 та Mg2P2O7 відповідно ;
V –загальний об’єм цитрато– та водорозчинних витяжок, мл;
а – аліквотна частина розчину, яка взята для одержання осаду, мл.
Результати роботи заносять до таблиці:
| Маса сиро-вини, г | Маса Н2SO4,г | Об’єм розчину мл | Вихід Са(Н2РО4)2 | Наважка супер-фосфату,г | Маса залишку, г | Вміст, % | |
| Теорет, г | Практ., г, % | ||||||
V. Контрольні запитання
1 Промислове одержання простого суперфосфату.
2 Виробництво суперфосфату та амофосу на “Сумихімпром”.
3 Промислове одержання подвійного суперфосфату.
4 Промислові методи одержання фосфатної кислоти та їх порівняльна характеристика.
5 Одержання та застосування преципітату.
Лабораторна робота № 3
І Елементи теорії
Суперфосфат амонізований гранульований із алжирського фосфориту – суміш гранул від сірого до темно-сірого кольору розміром від 1 до 4 мм. Цей продукт негігроскопічний, при зберіганні не злежується. Мінералогічно суперфосфат являє собою в основному суміш мікрокристалів Ca(H2PO4)2×H2O і CaSO4×0,5H2O, а також домішки CaHPO4,×Ca4H2(P3O10)2, NH4K2PO4×(NH4)2SO4, Mg(H2PO4)2 тощо.
Процес одержання амонізованого суперфосфату із алжирських фосфоритів подібний до процесу одержання простого суперфосфату (крім декількох реакцій нейтралізації) і здійснюється в дві основні стадії:
–одержання пульпи необхідного хімічного складу;
–гранулювання і сушка пульпи, класифікація гранульованого продукту.
Одержання пульпи здійснюється в двохреакторному апараті. В реакторі І ступеня фосфорит підлягає кислотній обробці, в результаті чого одержується пульпа, яка містить в рідкій фазі кислі фосфати кальцію і магнію, а також вільну фосфатнуну кислоту. В твердій фазі пульпа містить не розкладений фосфорит і кристали малорозчинного CaSO4×0,5 H2O. Для забезпечення необхідних умов розкладання, в реактор І ступеня подають сульфатну кислоту концентрації: 72-75 %, стічну воду і фосфорит.
Пульпа в реакторі І ступеня перетікає в реактор ІІ ступеня, де нейтралізується частина вільної фосфатної кислоти. При одержанні суперфосфату амонізованого в реакторі ІІ ступеня для нейтралізації вільної кислоти подають аміачну воду.
Нейтралізована пульпа з реактора ІІ ступеня подається в апарати СГБ, де вона гранулюється і сушиться. Особливістю технології розкладу в реакторі І ступеня при виробництві суперфосфату марок «А» і «Б» є те, що процес здійснюється при невеликих нормах подачі сірчаної кислоти на одиницю маси фосфориту. Внаслідок цього в реакторі І ступеня розкладання компонентів фосфатної сировини здійснюється фосфорною кислотою, яка міститься в рідкій фазі пульпи. Температурні і концентраційні характеристики пульпи в реакторі І ступеня такі, що її рідка фаза не являє собою насичений розчин по монокальційфосфату і мономагнійфосфату. В реакторі І ступеня фосфатна кислота, насамперед, розкладає карбонатовмісні домішкифосфатної сировини – кальцит і доломіт.
CaCO3 + 2H3PO4 = Ca(H2PO4)2 + CO2 + H2O (1)
CaMg(CO3)2 +4H3PO4=Mg(H2PO4)2+Ca(H2PO4)2 +2CO2 +2H2O (2)
Вказані реакції, із за інтенсивного виділення газоподібного CO2 викликають піноутворення реакційної пульпи. При густині пульпи значно нижче регламентованої може спостерігатися витікання піни з апаратури.
Основний процес розкладання фосфатної сировини здійснюється за реакцією:
Ca10(PO4)6F2 + 14H3PO4 = 10Ca(H2PO4)2 + 2HF (3)
Введення сульфатної кислоти в реактор І ступеня призводить до розкладання монокальційфосфату і виділенню вільної фосфатної кислоти за реакцією:
Ca(H2PO4)2 + H2SO4 + 0,5 H2O = CaSO4×0,5 H2O + 2H3PO4 (4)
При регламентованих температурах і концентраційних параметрах процесу розкладання сульфат кальцію випадає в тверду фазу переважно у вигляді напівгідрату. При температурах нижче регламентованих в реакторі утворюються переважно CaSO4×2 H2O.
В реакційній пульпі протікає також ряд побічних процесів. Наявність в фосфатній сировині 2-2,5 % SiO2 дає можливість увесь фтор, виділений по реакції, зв’язати у формі іонів SiF62-:
6HF + SiO2 = H2SiF6 (5)
В той же час домішок лужних металів в фосфатній сировині достатньо, щоб іони SiF62- знаходились у пульпі у вигляді малорозчинених силіційфлуоридів калію і натрію.
Алжирські фосфорити характеризуються відносно низьким вмістом домішок заліза і алюмінію. В процесі кислотного розкладу сполуки названих елементів розчиняються, утворюючи перенасичені розчини кислих фосфатів. Із реактора розкладання І ступеня у реактор ІІ ступеня надходить пульпа з вмістом вільної фосфатної кислоти. При одержанні суперфосфату амонізованого нейтралізація вільної фосфорної кислоти ведеться аміаком з утворенням моноамонійфосфату по нижче приведеній реакції. При цьому рН пульпи підтримується в межах 3÷3,2.
H3PO4 + NH3 = NH4H2PO4 (6)
При завищенні витрати аміачної води можливе достатньо глибоке протікання реакції, що є не бажаним :
Ca(H2PO4)2 + NH3 = CaHPO4 + NH4H2PO4 (7)
CaSO4 + 2NH3 + H3PO4 = CaHPO4 + (NH4)2SO4 (8)
По реакціям 7, 8 вміст засвоєного P2O5 не змінюється, але проходить ретроградація водорозчинної форми P2O5 в менш цінну форму – цитрарозчинну. Нейтралізована пульпа із реактора ІІ ступеня подається на стадію грануляції і сушки. На цій стадії поряд з фізичним видаленням вологи здійснюється протікання ряду хімічних процесів. При cушці проходить процес більш глибокого зв'язування вільної фосфатної кислоти по реакції 4. Можливі й інші побічні процеси і реакції.
ІІ Мета: Одержати амонізований суперфосфат та визначити вміст в ньому фосфору, який засвоюється.
ІІІ Самостійна робота
Вивчити теоретичний матеріал, стисло записати хід роботи.
Обладнання.Наважки, технічні терези, аналітичні терези, фарфорова чашка, термометр, електроплитка, скляна паличка, сушильна шафа, фарфорова ступка, товкачик, мірний циліндр, лійка, фільтрувальний папір, беззольний фільтр, мірна колба на 250 мл (2 шт.), піпетка, пробка, термостат, колба, магнітна мішалка, тигель, муфельна піч.
Реактиви та матеріали.73-75% (62-64%) -вий розчин сульфатної кислоти, фосфорит із 31-33% Р2О5, 22-23% -вий розчин аміаку, 10%-вий розчин хлоридної кислоти; розчин Патермана, 2-3%-вий розчин аміаку, розчин фенолфталеїну, магнезіальна суміш.
ІV Порядок виконання роботи
1. Одержання суперфосфату амонізованого.
За рівнянням реакції розраховують необхідну кількість сульфатної кислоти на задану викладачем наважку фосфориту. В заздалегідь зважену фарфорову чашку наливають розрахунковий об’єм Н2SО4 (62-64% -вої) та підігрівають її до 50-600С на електричній плитці, потім порціями в чашку додають зважений фосфорит. Суміш перемішують скляною паличкою 15 хвилин, потім ставлять у сушильну шафу на 20-30 хвилин, достають і додають до суміші розраховану кількість 5-10 % - вого розчину аміаку з контролем рН у межах 3,0 - 3,2, потім знову суміш ставлять у сушильну шафу, де вона витримується ще протягом 40-50 хвилин при 110-1200С.
Після охолодження чашку з продуктом зважують та розраховують вихід амонізованого суперфосфату.
2. Аналіз суперфосфату.
Методика аналізу описана в попередній роботі № 1, провести аналіз згідно методики.
Результати роботи заносять до таблиці:
| Маса сиро-вини, г | Маса Н2SO4г | Об’єм розчину, мл | Вихід Са(Н2РО4)2 | Наважка супер-фосфату, г | Маса залишку, г | Вміст, % | |
| Теорет, г | Практ., г, і % | ||||||
V Контрольні запитання
1. Поясніть можливість застосування фосфату кальцію на кислому ґрунті.
2. Чому при одержанні простого суперфосфату використовують сульфатну кислоту тільки середньої концентрації ?
3. Розкажіть про розкладання фосфатної сировини нітратною кислотою, які процеси при цьому протікають (складіть рівняння реакцій) і які продукти утворюються.
4. Які реакції лежать в основі одержання складного комплексного добрива N:P:K.
5. Які переваги амонізованого суперфосфату перед простим суперфосфатом.
VІ Задачі для розв’язування
1. Визначити витрати 75 % - вої сульфатної кислоти для переробки 1 т апатитового концентрату, який містить 52,3 % СаО, якщо норма сульфатної кислоти складає 98,9 % від стехіометричної маси.
Лабораторна робота №3
I. Елементи теорії
Корозією називають процес самочинного руйнування металів і сплавів під впливом зовнішнього середовища.Кородують, як правило, метали (чорні і кольорові), що перебувають у природі не в самородному стані, а як відповідні мінерали і руди. Оскільки процес корозії призводить до регенерації вихідних сполук, термодинамічно стійкіших порівняно з чистими металами, він супроводжується зменшенням вільної енергії й тому відбувається самочинно. Метали, що перебувають у природі у чистому вигляді (золото, платина та ін.), зазвичай, не кородують, якщо умови їх використання не дуже відрізняються від природних. За механізмом процесу розрізняють такі види корозії металів:
1. Хімічна — протікає в атмосфері агресивних газів, що не містять вологу, а також у присутності неелектролітів і полягає у виникненні хімічної реакції між металом і корозійним середовищем.
2. Електрохімічна корозія виникає при контакті металу з розчином електроліту. Цей вид корозії металів зустрічається найбільш часто у водоймах, у ґрунтах, в атмосфері вологого повітря і ін. При атмосферній корозії на поверхні металу конденсується волога, в якій розчиняються гази (наприклад, СО2, SО2), утворюючи електропровідні розчини. Механізм корозії металів у електролітах обумовлений протіканням електрохімічних процесів.
3. Біохімічна корозія металів викликана життєдіяльністю різних мікроорганізмів і, зазвичай, поєднується з іншими видами корозії.
Електрохімічна корозія має виключно велике розповсюдження, вона відбувається внаслідок дії гальванічних елементів, що контактують з відповідним середовищем. Це можуть бути макрогальваноелементи, які виникають при контакті різних металів, або мікрогальваноелементи, які виникають у технічних металах внаслідок наявності в них домішок. Гальванічний елемент утворюється, якщо два метали контактують між собою і одночасно контактують з яким-небудь розчином електроліту. На негативному електроді такого елемента відбувається окиснення металу (наприклад, цинку, за реакцією Zn → Zn2+ + 2 ē). На позитивному електроді, якщо середовище має кислу реакцію, відбувається розряд йонів гідрогену (2Н+ + 2 ē → Н2). В нейтральному або лужному середовищі відбувається реакція О2 + 2Н20 + 4 ē → 40Н-. У першому випадку процес називається корозією з водневою деполяризацією, у другому випадку процес називається корозією з кисневою деполяризацією. Таким чином, анодний процес - це процес, при якому безпосередньо відбувається руйнування (розчинення) металу. Анодний і катодний процеси взаємопов'язані - це спряжені процеси. Тому гальмування катодного процесу веде до гальмування анодного процесу, тобто до гальмування корозії. Процеси електрохімічної корозії, підкоряються законам Фарадея, тому швидкість розчинення пропорційна сумарному корозійному струму І, який приблизно пропорційний кількості мікрогальвано-елементів: І = n j,
- де n - число мікрогальваноелементів, j - середня величина струму одного мікрогальваноелемента.
Якщо в процесі роботи корозійного елемента ефективна різниця електродних потенціалів рівна Ееф, а опір електроліту рівний R, то величину струму такого елемента I можна розрахувати за законом Ома:
І =Ееф./R.
Таким чином, чим більша ефективна різниця потенціалів Ееф, тим більша швидкість корозії. Ця різниця потенціалів залежить від величини оборотних електродних потенціалів металів, що утворюють корозійний гальванічний елемент, і від величини поляризації, яка залежить від складу корозійного середовища.
ІІ. Мета:визначення швидкості корозії сталі у кислих і нейтральних середовищах гравіметричним методом.
Реактиви:розчин хлоридної кислоти концентрації (1:3) та 5 моль/л, сульфатної кислоти – 0,5; 1,5; 2,5 моль/л, натрій хлориду – 1,3 та 5 моль/л.
Обладнання:сталеві пластини (3 шт.), лабораторні стакани (3 шт.) на 100-150 мл; наждачний папір, тримачі і капронові підвіски (шнури).
ІІІ. Самостійна робота
Опрацювати відповідний теоретичний матеріал та стисло описати хід роботи в зошиті.
Лабораторна робота №4
Одержання сплаву Sn-Ni електрохімічним методом та дослідження виходу за струмом
І. Елементи теорії
Сумісне відновлення іонів двох металів можливе, коли потенціали їх розряду (Е1 і Е2) рівні або близькі, тобто коли:
Е10 + RT/z1F×lna1 + η1 = Е20 + RT/z2F×lna2 + η2
Де - Е10 і Е20 — стандартні потенціали металів; а1 і а2 - активності іонів металів; η1 і η2 - перенапруга; z1 і z2 — ступені окиснення іонів.
Якщо потенціали виділення двох металів різні, то для їх зближення застосовують наступні методи. При близьких значеннях стандартних потенціалів і перенапружень двох металів (у розчинах простих солей) потенціали їх виділення зближують шляхом зменшення активності іонів більш електропозитивного металу і збільшення активності іонів менш електропозитивного металу. Коли стандартні потенціали металів помітно розрізняються, зближення потенціалів виділення таким шляхом практично неможливо, оскільки при зміні активності в 10 разів значення рівноважного потенціалу зрушується всього на 0,058 В для одновалентних іонів і на 0,029 В — для двовалентних. Найбільш ефективним методом зближення потенціалів є утворення міцних комплексних з'єднань іонів металів, що виділяються. Підбирають такі комплексоутворюючи ліганди, які дозволяють отримати комплекси електропозитивного металу міцнішими, ніж електрозаперечувачданого металу, і, отже, зменшують активність іонів більш електропозитивного металу більшою мірою, чим активність іонів менш електропозитивного металу. Це приводить до зближення потенціалів виділення металів як за рахунок зближення їх рівноважних потенціалів, так і за рахунок зміни значень перенапруженні, які залежать від природи комплексного іона і надлишку лиганда в розчині. Як таких комплексообразователей широкого поширення набули ціаниди, дифосфаты, аміакати, фториди, станати, цинкати. Використовують також добавки таких ПАВ, які викликають сильніше гальмування реакції розряду іонів електропозитивного металу в порівнянні з електронегативним металом. При електроосадженні сплаву можливо як підвищення швидкості розряду іонів, тобто полегшення процесу утворення сплаву (деполяризація), так і зменшення швидкості — утруднення розряду іонів (надполяризація). Ефект деполяризації виявляється в результаті взаємодії компонентів сплаву при утворенні кристалічної решітки твердого розчину або хімічної сполуки. В цьому випадку полегшення виділення сплаву пояснюється зменшенням парціальної молярної енергії утворення компонентів осаду. Такий вплив наголошується при електроосадженні сплавів Sn – Ni, Sn – Pb, Cu – Zn, Cu – Sn і ін. Физико-хімічні властивості сплаву залежать від відносного вмісту в нім компонентів. Тому, якщо склад сплаву сильно змінюється залежно від щільності струму, то на рельєфній поверхні виробів унаслідок нерівномірного розподілу струму осідання сплаву будуть різними по складу, структурі і іншим властивостям. При електроосадженні сплавів застосовують аноди з термічного сплаву (латунь, бронза, олово-свинець), а також з окремих металів, що входять до складу сплаву, з роздільним або загальним підведенням струму до них. У разі використання анодів з одного металу спад іонів другого металу компенсується додаванням в електролит його солі. Сплав на основі Sn і Ni представляє собою однофазну систему інтерметалевої сполуки NiSn, що містить (30,91 – 42,9)% нікелю, і яку можна отримати тільки електрохімічним способом. Осади цього сплаву мають густину 8,83 г/см3. Покриття сплавом, що містять менше 30,91% Ni є двофазними. Підвищення вмісту нікелю у сплаві призводить до збільшення внутрішньої напруги. Прожарювання осадів при температурі 250°C за 150 годин призводить до розпаду метастабільної фази з гексагональною решіткою. Цей процес прискорюється при температурі 300°C. У результаті відбувається рекристалізація сплаву з утворенням двохфазної системи незалежно від вмісту у ньому нікелю. Поверхня осадів сплаву SnNi складається зі сфероїдних утворень, при цьому у випадку нестаціонарного електролізу з ростом анодної складової розмір частинок, що створюють рельєф поверхні, зменшується, а шорсткість збільшується. Покриття сплавом SnNi отримують блискучими безпосередньо з електроліту. Вони мають достатньо високу твердість (5000 – 6000 МПа), немагнітні, легко поліруються, гарно паяються і не піддаються голкоутворенню. В результаті високої корозійної стійкості покриття сплавом SnNi гарно захищають сталь з підшаром міді від корозії в жорстких умовах експлуатації, а міді і її сплавів – в дуже жорстких умовах. Покриття сплавом SnNi широко застосовується для захисно-декоративної обробки мідних й обміднених стальних виробів, в якості заключного покриття на друкованих схемах (замість сріблення і паладіювання), а також як підшарок під золото. Із електролітів, які містять тільки NH4F отримують блискучі покриття, крихкі, зі слабо помітними дефектами, кількість яких підвищується зі збільшенням концентрації йону NH4+ і густини струму. З електролітів, що містять тільки NaF отримують матові покриття без дефектів. Одночасне знаходження в електроліті NH4F і NaF знижує внутрішню напругу покриттів. Інтервал робочих густин струму при отриманні блискучих покриттів залежить від температури й рН електроліту (табл.1)
Таблиця 1. Вплив температури та рН електроліту на робочі густини струму
| Температура, °C | Густина струму, А/дм2 | |
| рН=4,5 | рН=2,5 | |
| 1,0 – 3,5 | 1,0 – 3,5 | |
| 1 – 4 | 1 – 4 | |
| 2,5 – 4,0 | 1 – 4 | |
| ¾ | 1,0 – 4,5 | |
| ¾ | 1,0 –4,5 |
При зниженні густини струму нижче вказаної межі (табл.1) утворюються напівблискучі покриття; при підвищенні її вище вказаної верхньої межі покриття мають матову поверхню. В електроліти для отримання сплаву SnNi для одержання блискучих осадів вводять також ПАР.
II. Мета:одержання покриття сплаву Sn-Ni та встановлення виходу за струмом.
Реактиви:електроліт №1 (NiCl2 × 6H2O, SnCl2 × 2 H2O, NH4F), дистильована вода, HNO3 (r=1,4 г/мл), HCl (конц.), CrO3, Ca(OH)2.
Обладнання:2 нікелевих, 3 мідних (латунних) пластинки, наждачний папір, прилад для електролізу, пінцет.
ІІI. Самостійна робота
Опрацювати відповідний теоретичний матеріал та стисло описати хід роботи в зошиті.
ІV. Порядок виконання роботи
Якщо немає готового електроліту №1, то його готують і для його приготування треба розчинити 38 г NiCl2×6H2O, 7г SnCl2×2 H2O, 9г NH4F в 150мл дистильованої води. Кожен компонент електроліту розчиняють окремо. Перед розчиненням SnCl2×2 H2O до води (для підкислення) додають декілька крапель HCl(конц.). Якщо розчин повністю не розчинився, його треба відфільтрувати. Потім усі компоненти електроліту змішують, ретельно перемішуючи скляною паличкою.
Перед електролізом проводять підготовку мідних (латунних) пластин, які будуть покриватися сплавом SnNi. Для цього пластини зачищають наждачним папером з обох сторін, полірують оксидом хрому (ІІІ). Потім за допомогою лінійки визначають площу пластини, яка буде знаходитися в розчині електроліту. Знежирення пластин проводять порошком гідроксиду кальцію. Після цього пластини занурюють у розчин для травлення (HNO3, r=1,4г/мл), який наливають у скляний стакан. Травлення проводять протягом 3 - 5 хвилин (до появи блакитного кольору розчину кислоти), а потім пінцетом виймають пластини з розчину, промиваємо дистильованою водою, сушать за допомогою фільтрувального паперу. Перед тим, як помістити пластини в електролізер (стакан з електролітом), пластини зважують.
Електроліз проводять при густині струму 100, 200 і 300 А/м2 протягом 40, 20, 10 хвилин відповідно (тобто покривають три пластинки окремо). Розраховують силу струму за густиною струму та площею пластини, що буде занурена у розчин електроліту. Мідну (латунну) пластинку закріплюють на гачок (2) катоду в електролізері (див. рис.1), а по краях підвішують нікелеві аноди на гачки 1, 3. З’єднують провідниками електролізер з випрямлячем і вмикають установку в електромережу. За допомогою ручки реостату встановлюємо розрахункову силу струму за амперметром і відмічають початок електролізу за годинником. Потім установку вимикають, пластину знімають, промивають дистильованою водою, сушать, зважують.
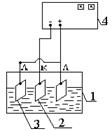
Рисунок 1 – Схема установки для одержання сплаву Sn-Ni.
1-електролізер; 2-катод; 3-аноди з нікелю; 4-випрямляч
Одержані данні вносимо до таблиці
| Сила струму, А | Напруга, В | Час електрол., год | Маса пластини, г | Доважок,г | |
| До досліду | Після досліду | ||||
На основі закону Фарадея обчислюють теоретичне значення маси сплаву SnNi, який повинен осадитися. Потім, використовуючи доважок у масі пластини (практично одержаний сплав SnNi), розраховують вихід за струмом.
Записати електрохімічні реакції, які протікають на катоді та аноді. Поясніть можливість сумісного електровідновлення Sn і Ni на основі їх електрохімічних потенціалів. Розрахуйте рівноважні потенціали електровідновлення Sn і Ni в умовах лабораторного досліду. Зробіть відповідні висновки.
V Контрольні запитання
1. Сформулювати закони Фарадея.
2. Які фактори впливають на вихід за струмом?
3. Назвіть види перенапруги та причини її виникнення.
4. Назвіть умови сумісного відновлення двох (або декількох) катіонів металів на катоді.
5. Які фактори впливають на якість покриття (адгезію з поверхнею підкладки, рівномірність шару покриття по поверхні і по товщині, однорідність тощо).
6. З якою метою в електроліт для нанесення електрохімічного покриття вносяться електропровідні добавки? Наведіть приклади.
7. Який вплив на якість покриття здійснює відстань між анодом та катодом, а також внутрішні розміри гальванічної ванни?
8. Який з параметрів при нанесенні електрохімічного покриття є важливішим: вихід по струму металу або розсіююча здатність електроліту?
9. Які чинники впливають на мікророзсіюючу здатність електроліту? Яку роль при цьому грає тип електроліту (простій, комплексний) і чи ідентична вона впливу на розсіюючу здатність того ж електроліту?
10. Чи ідентичні поняття «Захисна здатність» і «антикорозійна стійкість» електрохімічного покриття?
11. З яких передумов виходять при виборі товщини захисного або захисно-декоративного покриття?
Лабораторна робота № 5
Дата: 2016-10-02, просмотров: 279.