Карбоксильная группа (-COOH) представляет собой сочетание карбонильной (>C=O) с гидроксильной (-O-H). Эти группы в карбоксиле взаимно влияют друг на друга. Это влияние проявляется в молекулярном эффекте - p,p-сопряжение, в результате которого p-электроны атома кислорода гидроксила смещены к атому кислорода карбонила (+М-эффект):

Такое смещение электронов в карбоксильной группе приводит к повышению полярности связи O-H и соответственно к его ослаблению, а также к уменьшению частичного заряда d+ на карбонильном атоме углерода. В результате атом водорода в группе OH карбоксила становится значительно активнее, чем в OH-группе спиртов, и может отщепляться в виде протона H+. Поэтому карбоновые кислоты, в отличие от спиртов, диссоциируют в водных растворах. При диссоциации карбоновой кислоты кроме протона возникает достаточно энергетически устойчивый карбоксилат-анион, который является резонансным гибридом двух структур: II(а) и II(б). В гибридном карбоксилатном анионе осуществляется исключительно эффективная делокализация отрицательного заряда и его равномерное распределение между двумя изовалентными атомами кислорода карбоксила. Такая делокализация ведет к уменьшению внутренней энергии этого аниона и к уменьшению его тенденции связывать протон, что, в свою очередь, приводит к смещению равновесия в сторону диссоциации карбоновой кислоты (т.е. вправо). При сольватирующем действии растворителя (воды) образуется стабильный мезомерный карбоксилат-анион (III) и гидроксоний-катион:
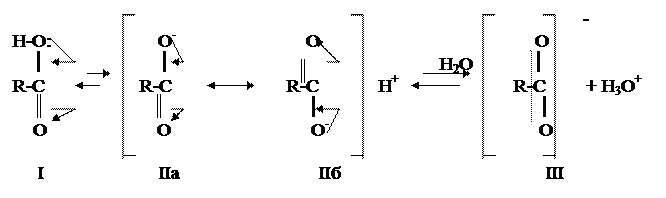
Изовалентность атомов кислорода в карбоксилат-анионе подтверждается методами рентгеноструктурного анализа и электронографии, из экспериментальных данных которых видно, что обе связи C-O в анионе (III) одинаковые. Например, в формиат-анионе они составляют 0,127 нм, тогда как в молекуле муравьиной кислоты простая связь C-O имеет длину 0,136 нм, а двойная связь C=O – 0,123 нм.
Присутствие в карбоксильной группе электроотрицательного карбонильного атома кислорода обусловливает смещение к нему электронной плотности соседних s-связей:

Таким образом, карбоксильная группа в молекулах карбоновых кислот проявляет отрицательный индукционный эффект (-I-эффект).
Химические свойства
Свойства карбоновых кислот обусловлены в первую очередь присутствием в их молекулах карбоксильной группы.
Кислотные свойства
Карбоновые кислоты в водных растворах диссоциируют:
 R-COOH + H2O R-COO- + H3O+
R-COOH + H2O R-COO- + H3O+

Однако по сравнению с минеральными кислотами, такими как HCl, HBr, HI, H2SO4, HNO3, H3PO4 и др., органические кислоты намного слабее, но более сильные, чем угольная кислота. Поэтому минеральные кислоты вытесняют карбоновые кислоты из их солей, а карбоновые кислоты в свою очередь вытесняют угольную кислоту из ее солей. Согласно теории кислот и оснований Бренстеда-Лоури, такие соединения, как вода, спирты, ацетилен, аммиак, амины, углеводороды, можно рассматривать также как кислоты. Однако они по сравнению с карбоновыми кислотами намного слабее. Относительная кислотность этих соединений изменяется в таком порядке:
HCl > R-COOH > H-OH > R-OH > HCºCH > NH3 > R-H
Так, кислотные свойства атома водорода гидроксильной группы карбоксила карбоновой кислоты за счет (-)I-эффекта и эффекта p,p-сопряжения -CO- группы значительно сильнее, чем водорода гидроксила молекулы воды. Вместе с тем, кислотные свойства водорода группы OH спирта, благодаря (+)I-эффекта алкильной группы проявляются слабее, чем у гидроксила воды. Сказанное подтверждается значением КД25 для этих веществ:

Кислотные свойства карбоновых кислот (R-COOH) зависят от природы и строения алкильного радикала (-R), присутствия заместителей в его углеродной цепи. Группы R- с положительным электронным эффектом уменьшают величину частичного заряда d+ на карбонильном C-атоме и тем самым уменьшает его электроноакцепторное действие на группу –OH. Это приводит к уменьшению силы карбоновой кислоты. Поэтому в гомологическом ряду монокарбоновых кислот муравьиная кислота, в молекуле которой рядом с карбоксильной группой нет углеводородного радикала с положительным электронным эффектом, является наиболее сильной. Уксусная кислота в сравнении с муравьиной в десять раз слабее, поскольку в ее молекуле есть метильный радикал, который проявляет (+)I-эффект. Атомы и группы атомов с отрицательным электронным эффектом увеличивают величину заряда d+ на карбонильном C-атоме и тем самым усиливают электроноакцепторное действие карбонила на группу –OH. Это обусловливает значительное повышение силы карбоновой кислоты. Поэтому хлоруксусная кислота приблизительно в 20 раз сильнее, чем уксусная. Таким образом, группы R- с положительным электронным эффектом уменьшают, а с отрицательным электронным эффектом увеличивают силу карбоновых кислот. Это убедительно подтверждает сравнение значений рКк карбоновых кислот, которые содержат R- разной электронной природы (стрелками показано смещение электронов в молекуле кислоты):
 | |
 |
По мере удаления заместителей с (-)I-эффектом от карбоксильной группы его влияние на эту группу уменьшается (затухает). Это видно из сравнения кислотных свойств хлормасляных кислот:

Как видно из значений рКк этих кислот, наиболее сильное влияние на карбоксильную группу имеет атом галогена тогда, когда он находится ближе всего к этой группе, т.е. в a-положении относительно карбоксильной группы. Поэтому a-хлормасляная кислота значительно сильнее b- и g-хлормасляных кислот, а b-хлормасляная кислота по этой же причине сильнее g-хлормасляной кислоты.
Характерной реакцией карбоновых кислот, которая проходит с участием водорода карбоксильной группы, является реакция образования солей. Соли карбоновых кислот получаются при их взаимодействии с активными металлами, основными оксидами, основаниями, солями угольной кислоты:
2CH3-COOH + Mg ---® (CH3-COO)2Mg + H2
2CH3-COOH + CaO ---® (CH3-COO)2Ca + H2O
CH3-COOH + KOH ---® CH3-COOK + H2O
CH3-COOH + NaHCO3 ---® CH3-COONa + H2O + CO2
Соли карбоновых кислот являются кристаллическими, ионно построенными, нелетучими веществами. Аммонийные соли и соли щелочных металлов органических кислот хорошо растворимы в воде, но не растворяются в неполярных растворителях.
Основные свойства
В связи с р,p-сопряжением в карбоксильной группе основные свойства гидроксила в карбоксиле карбоновых кислот очень ослаблены и данный гидроксил эти свойства проявляет только в реакциях с сильными минеральными кислотами, такими как H2SO4, HClO4. При взаимодействии карбоновых кислот с H2SO4, HClO4 протон этих сильных минеральных кислот присоединяется к карбонильному атому кислорода и образует таким образом сопряженную кислоту (I):

Протон минеральной кислоты может присоединяться также к атому кислорода гидроксила карбоксильной группы карбоновой кислоты и образовывать сопряженную кислоту (II):

Сопряженная кислота (II) энергетически менее стабильна по сравнению с ее изомером (I), у которого протон соединен с кислородом карбонила.
Характерной реакцией карбоновых кислот, которая проходит с участием гидроксильной группы карбоксила, является реакция образования сложных эфиров. Она происходит в результате взаимодействия карбоновых кислот со спиртами (в присутствии минеральных кислот – как катализатор) и называется реакцией этерификации:

Взаимодействие карбоновых кислот со спиртами – равновесный процесс.
Этерификация – хорошо изученный пример применения закона действующих масс к гомогенным жидким системам. Этерификацию изучали Н.Бертло (1862г.), Н.А.Меншуткин, Я.Вант-Гофф (1877г.) и многие другие.
В случае взаимодействия эквимолекулярных количеств уксусной кислоты и этилового спирта при 20оС для достижения равновесия потребуется 368дней, а при нагревании и каталитическом действии ионов водорода равновесие устанавливается в течение нескольких дней. При этом выход этилацетата достигает ~70%:

Для полного превращения уксусной кислоты в этилацетат, т.е. чтобы сдвинуть равновесие данной реакции вправо, спирт необходимо брать в восмикратном избытке относительно кислоты.
Интересным является вопрос о механизме реакции этерификации, т.е. вопрос об образовании воды в этой реакции, а именно: за счет какого гидроксила – кислоты или спирта – образуется вода. Используя метод «меченых атомов» (в реакцию ввели спирт, который содержал тяжелый изотоп кислорода 18О), было установлено, что после этерификации «меченый» атом кислорода входил в состав сложного эфира, а вода содержала обычный атом кислорода:
|
 |
На основе этого пришли к выводу, что вода при этерификации образуется за счет атома водорода OH-группы спирта и гидроксила –COOH группы кислоты. Таким образом, в реакции этерификации осуществляется нуклеофильное замещение OH-группы карбоксила кислоты на алкоксильную группу R`O-спирта. Но в связи с тем, что спирт является слабым нуклеофилом, а карбоновая кислота несильным электрофилом, то реакция взаимодействия карбоновой кислоты и спирта осуществляется достаточно медленно. С этой целью в реакционную смесь добавляют небольшое количество концентрированной H2SO4, или вводят газообразный HCl. Катализатором могут быть также и кислоты Льюиса, например BF3. Механизм реакции этерификации в присутствии каталитических количеств кислот можно представить в виде равновесных реакций:
 | |||
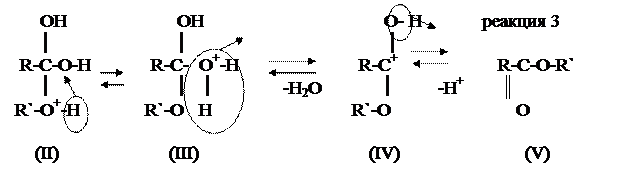 |
На медленной стадии (реакция 1) к карбонильному атому кислорода присоелиняется протон (катализатор) и образуется карбониевый ион (I), в котором значительно увеличивается положительный заряд на карбонильном атоме углерода. На второй стадии (реакция 2) катион (I) присоединяет молекулу спирта и образует связь между карбонильным атомом углерода и гидроксилом спирта за счет свободной пары электронов его атома кислорода. В результате образуется оксониевое соединение (II), которая потом перегруппировывается в гидроксониевое соединение (III), способное отщеплять воду и преобразовываться в карбкатион (IV). На последней стадии карбкатион (IV) отщепляет протон, который начинал каталитический процесс на первой стадии, и превращается (реакция 3) в конечный продукт этерификации – сложный эфир (V).
Сложные эфиры низших карбоновых кислот представляют собой жидкости с приятным запахом, легче воды.
Дата: 2016-10-02, просмотров: 396.