Кафедра химии и физики
Методические материалы по аналитической химии для студентов 2 курса фармацевтического факультета
Вопросы к промежуточному контролю
ВОПРОСЫ И ТЕСТЫ К МОДУЛЬНОМУ ЗАНЯТИЮ №1
1. Предмет и задачи аналитической химии. Качественный и количественный анализ. Применение методов аналитической химии в фармации.
2. Характеристика чувствительности и специфичности аналитических реакций.
3. Основные положения теории растворов электролитов, используемые в аналитической химии. Сильные и слабые электролиты.
4. Теория сильных электролитов Дебая-Хюккеля. Активность, коэффициент активности, ионная сила раствора.
5. Применение закона действующих масс в аналитической химии. Химическое равновесие. Константа химического равновесия. Смещение химического равновесия. Принцип Ле-Шателье-Брауна.
6. Понятие о методе и методике анализа. Классификация методов качественного анализа (дробный и систематический, макро-, полумикро-, микро-, ультромикроанализ).
7. Аналитические реакции (общие и частные) и требования, предъявляемые к ним. Способы и условия выполнения аналитических реакций.
8. Реактивы, используемые для выполнения аналитических реакций. Специфичность и селективность реакций. Использование качественного анализа в фармации.
9. Аналитическая классификация катионов по группам: сероводородная (сульфидная), аммиачно- фосфатная, кислотно-основная. Ограниченность любой классификации катионов по группам.
10. Кислотно-основная классификация катионов по группам. Систематический анализ катионов по кислотно-основному методу.
11. Аналитическая классификация анионов по группам (по способности к образованию малорастворимых соединений, по окислительно-восстановительным свойствам). Ограниченность любой классификации анионов по группам.
12. Анализ смесей катионов и анионов (качественный химический анализ вещества).
13. Характерные реакции катионов I аналитической группы по кислотно-основной классификации.
14. Характерные реакции катионов II аналитической группы по кислотно-основной классификации.
15. Характерные реакции катионов III аналитической группы по кислотно-основной классификации.
Тесты к теме: «Техника выполнения и чувствительность аналитических реакций»
1. Аналитическая химия – это раздел химической науки, изучающей:
1) состав веществ;
2) свойства веществ;
3) применение веществ;
4) превращение веществ.
Аналитическая реакция - это химическая реакция:
| a) | протекающая с образованием осадка |
| b) | протекающая с образованием цветного соединения |
| c) | протекающая с образованием слабого электролита |
| d) | протекающая с выделением газа |
| e) | при проведении которой возникает аналитический эффект |
2. Укажите, к каким методам анализа относится «экстракция»:
| a) | качественным |
| b) | разделения и концентрирования веществ |
| c) | инструментальным методам |
| d) | количественным |
| e) | маскирования |
3. К химическим методам анализа относится:
1)фотометрия;
2)гравиметрия;
3)кулонометрия;
4)кондуктометрия.
Ответ на вопрос «Из каких элементов состоит анализируемый объект?» дает:
1)элементный анализ;
2)функциональный анализ;
3)вещественный анализ;
4)молекулярный анализ.
6. Метод – это … .
10. Предел обнаружения Сmin показывает
| a) | сколько граммов вещества можно обнаружить в 1 л раствора |
| b) | сколько микрограммов вещества можно обнаружить в 1 мл раствора |
| c) | сколько микрограммов вещества можно обнаружить в 1 капле раствора |
| d) | сколько граммов вещества можно обнаружить в 1 мл раствора |
| e) | в каком количестве граммов растворителя еще можно обнаружить 1 г вещества. |
При идентификации катиона калия используют раствор натрия гексанитрокобальтата ( III). Какой катион мешает определению калия при помощи этой реакции?
| a) | Co2+ |
| b) | Na+ |
| c) | NH4+ |
| d) | Ca2+ |
| e) | Вa2+ |
Тесты к теме: « II аналитическая группа катионов»
Какие из утверждений верны?
А) Хромат-ионы и дихромат-ионы являются качественными на катионы Ва2+.
Б) Катионы Са2+ не дают осадков ни с хромат-ионами, ни с дихромат-ионами.
1) Верно только А
2) Верно только Б
3) Верны оба утверждения
4) Оба утверждения неверны.
17. Оксалат аммония ( NН4)2С2О4 образует белые осадки с группой катионов:
1) Nа+, К+ ;
2) Са2+ и Ва2+ ;
3) NН4+ и К+;
4) Zn2+ и Al3+.
18. Содержание этого катиона в костях и зубах составляет до 99%, в крови – около 1%. Он влияет на проницаемость клеточных мембран и свёртываемость крови. Это катион:
1) К+;
2) Са2+;
3) Fe3+;
4) Na+.
Какие из утверждений верны?
А) Оксалат аммония качественный реактив на катионы Са2+ и Ba2+.
Б) Растворимость оксалата кальция в воде меньше, чем оксалата бария.
1) Верно только А
2) Верно только Б
3) Верны оба утверждения
4) Оба утверждения неверны.
20. Специфической для катиона Ва2+ является реакция:
1) ВаСl2+Н2 SO4=ВаSO4↓ +2НСl;
2) ВаСl2+(NН4)2С2О4= ВаС2О4↓ +2NН4Сl;
3) 2ВаСl2+К2Сr2О7+Н2О=2ВаСrО4 + 2КСl+2НСl.
4) ВаСl2+Na2 SO4=ВаSO4↓+2NaСl.
Привести уравнение данной реакции.
ВОПРОСЫ И ТЕСТЫ К МОДУЛЬНОМУ ЗАНЯТИЮ №2
I. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ:
1. Какое равновесие является гетерогенным? Что такое гомогенная и гетерогенная системы?
2. Что такое произведение растворимости и как оно выражается?
3. Каковы основные условия образования осадков?
4. Какие факторы и как влияют на полноту осаждения?
ВОПРОСЫ И ТЕСТЫ К МОДУЛЬНОМУ ЗАНЯТИЮ №3
ТЕСТЫ
Тесты к теме: «Экстракция»
1. Из перечисленных ниже формулировок выберите правильную для определения понятия "экстрагент":
А. Раствор реагента, обычно водный, используемый для извлечения веществ из экстракта.
B. Органический растворитель в чистом виде или содержащий реагент, извлекающий вещество из водной фазы.
C. Составная часть экстракта, перешедшая из водной фазы в органическую вместе с извлекаемым веществом.
D. Отделенная водная фаза, содержащая вещество, извлекаемое из экстракта.
2. Из перечисленных ниже формулировок выберите правильную для определения понятия "экстракционный реагент".
A. Раствор реагента, обычно водный, используемый для извлечения веществ из экстракта.
B. Водная фаза, содержащая вещества, извлекаемые из экстракта.
C. Составная часть экстрагента, взаимодействующая с извлекаемым веществом с образованием экстрагирующегося соединения.
D. Органический растворитель в чистом виде или содержащий реагент, извлекающий вещество из водной фазы.
3. Из перечисленных ниже формулировок выберите правильную для определения понятия "реэкстрагент".
A. Органический растворитель в чистом виде или содержащий реагент, извлекающий вещество из водной фазы.
B. Составная часть экстрагента, взаимодействующая с извлекаемым веществом с образованием экстрагирующегося соединения.
С. Отделенная жидкая органическая фаза, содержащая экстрагируемое из водной фазы вещество.
D. Раствор реагента, обычно водный, используемый для извлечения веществ из экстракта.
4. Из перечисленных выше формулировок выберите правильную для определения понятия "экстракт".
A. Органический растворитель в чистом виде, извлекающий вещество из водной фазы.
B. Органический растворитель, содержащий реагент, извлекающий вещество из водной фазы.
C. Отделенная жидкая органическая фаза, содержащая извлеченное из водной фазы вещество.
D. Раствор реагента, обычно водный, используемый для извлечения веществ из экстракта
5. Из приведенных ниже выражений выберите правильное при описании коэффициента распределения D для процесса экстракции бензойной кислоты из водной фазы в органическую:
А. [С6Н5СООН] / [С6Н5СООН];
В. (С6Н5СООН ) 2/2 (С6Н5СООН);
C. [С6Н5СООН] + [(С6Н5СООН)2] / [С6Н5СООН] + [С6Н5СОО–];
D. [С6Н5СООН] + [С6Н5СОО–] / [С6Н5СООН] + [(С6И5СООН)2];
6. Из приведенных ниже выражений выберите правильное при описании ионных ассоциатов:
А. I2
В. К[I3]
С. H[FeCl4];
D. Дитизонат цинка;
Е. [SbСl6]*R, где R – катион красителя метилового фиолетового.
7. Укажите, к каким методам анализа относится «экстракция»:
| a) | качественным |
| b) | разделения и концентрирования веществ |
| c) | инструментальным методам |
| d) | количественным |
| e) | маскирования |
| Ответ: b |
8. Отношение суммарной (аналитической) концентрации данного вещества в органической фазе к суммарной (аналитической) концентрации его в водной фазе, это :
| a) | коэффициент разделения |
| b) | коэффициент распределения |
| c) | константа распределения |
| d) | константа разделения |
| e) | степень разделения |
| Ответ: b |
9. Из перечисленных выше формулировок выберите правильную для определения понятия "экстракт".
| a) | раствор реагента, обычно водный, используемый для извлечения веществ из экстракта |
| b) | отделенная жидкая органическая фаза, содержащая извлеченное из водной фазы вещество |
| c) | органический растворитель, содержащий реагент, извлекающий вещество из водной фазы |
| d) | органический растворитель в чистом виде, извлекающий вещество из водной фазы |
| e) | органический растворитель |
Ответ: b
10. Отношение суммарной массы (суммарного количества) экстрагируемого вещества в органической фазе к его общей массе (суммарному количеству) в обеих фазах, выраженное в процентах, это :
| a) | коэффициент разделения |
| b) | коэффициент распределения |
| c) | степень извлечения |
| d) | константа разделения |
| e) | степень разделения |
Ответ: с
11. Из перечисленных ниже формулировок выберите правильную для определения понятия "реэкстрагент".
| a) | составная часть экстрагента, взаимодействующая с извлекаемым веществом с образованием экстрагирующегося соединения |
| b) | раствор реагента, обычно водный, используемый для извлечения веществ из экстракта |
| c) | отделенная жидкая органическая фаза, содержащая экстрагируемое из водной фазы вещество |
| d) | органический растворитель в чистом виде или содержащий реагент, извлекающий вещество из водной фазы |
| e) | органический растворитель, извлекающий вещество Ответ: b |
12. Константа гетерогенного химического равновесия, устанавливающегося при экстракции, это :
| a) | коэффициент разделения |
| b) | константа экстракции |
| c) | степень извлечения |
| d) | константа разделения |
| e) | степень разделения Ответ: b |
13. Из перечисленных ниже формулировок выберите правильную для определения понятия "экстракционный реагент".
| a) | органический растворитель в чистом виде или содержащий реагент, извлекающий вещество из водной фазы |
| b) | составная часть экстрагента, взаимодействующая с извлекаемым веществом с образованием экстрагирующегося соединения |
| c) | водная фаза, содержащая вещества, извлекаемые из экстракта |
| d) | раствор реагента, обычно водный, используемый для извлечения веществ из экстракта |
| e) | органический растворитель, содержащий реагент Ответ: b |
14. Коэффициент распределения D, рассчитывается по формуле:
| a) | D = ∑Cорг / ∑Cводн |
| b) | D = ∑Cорг - ∑Cводн |
| c) | D = ∑Cорг × ∑Cводн |
| d) | D = ∑Cорг + ∑Cводн |
| e) | D = ∑Cводн / ∑Cорг Ответ: a |
15. Из перечисленных ниже формулировок выберите правильную для определения понятия "экстрагент":
| a) | составная часть экстракта, перешедшая из водной фазы в органическую вместе с извлекаемым веществом |
| b) | отделенная водная фаза, содержащая вещество, извлекаемое из экстракта |
| c) | раствор реагента, обычно водный, используемый для извлечения веществ из экстракта |
| d) | органический растворитель в чистом виде или содержащий реагент, извлекающий вещество из водной фазы |
| e) | водный раствор реагента, используемый для извлечения веществ Ответ: d |
16. Из приведенных ниже выражений выберите правильное при описании коэффициента распределения D для процесса экстракции бензойной кислоты из водной фазы в органическую:
| a) | [С6Н5СООН] + [(С6Н5СООН)2] / [С6Н5СООН] + [С6Н5СОО–] |
| b) | [С6Н5СООН] / [С6Н5СООН] + [С6Н5СОО–] |
| c) | [С6Н5СООН] + [С6Н5СОО–] / [С6Н5СООН] + [(С6Н5СООН)2] |
| d) | (С6Н5СООН)2/2 (С6Н5СООН) |
| e) | [С6Н5СОО-] / [С6Н5СООН]2 Ответ: a |
17. Экстракция вещества из одной и той же фазы, проводимая отдельными порциями экстрагента, это:
| a) | обратная экстракция |
| b) | непрерывная экстракция |
| c) | противоточная экстракция |
| d) | периодическая экстракция |
| e) | прерывистая экстракция Ответ: d |
18. В основе экстракционного равновесия лежит закон:
| a) | Фарадея |
| b) | принцип Ле-Шателье |
| c) | распределения Нернста |
| d) | Вант-Гоффа |
| e) | Ома Ответ: c |
Задачи
1. Смесь аминазина (I) и пропазина (II) разделили на пластинках «Силуфол»; при этом получили следующие результаты. Расстояния от линии старта до центра пятен (I) и (II) соответственно равны 20 мм и 56 мм; диаметр пятен (I) и (II) – 7 мм и 10 мм. Расстояние от линии старта до линии финиша 100 мм. Рассчитайте коэффициент подвижности аминазина и степень (критерий) разделения R (пропазин / аминазин).
2. Рассчитайте RS вещества X, если расстояние от линии старта до линии фронта растворителя составляет 50 мм, расстояние от линии старта до центра хроматографической зоны вещества X – 30 мм, расстояние от линии старта до центра стандартного вещества – 26 мм.
3. Смесь дипразина (I) и пропазина (II) разделили на пластинках «Силуфол»; при этом получили следующие результаты. Расстояния от линии старта до центра пятен (I) и (II) соответственно равны 40 мм и 56 мм; диаметр пятен (I) и (II) – 6 мм и 8 мм. Расстояние от линии старта до линии финиша 100 мм. Рассчитайте коэффициент подвижности пропазина и степень (критерий) разделения R (пропазин / дипразин).
4. Смесь аминазина (I) и дипразина (II) разделили на пластинках «Силуфол»; при этом получили следующие результаты. Расстояния от линии старта до центра пятен (I) и (II) соответственно равны 20 мм и 32 мм; диаметр пятен (I) и (II) – 4 мм и 3 мм. Расстояние от линии старта до линии финиша 100 мм. Рассчитайте коэффициент подвижности дипразина и степень (критерий)разделения R (дипразин / аминазин).
5. Рассчитайте Rf и RS вещества X, если расстояние от линии старта до линии фронта растворителя составляет 50 мм, расстояние от линии старта до центра хроматографической зоны вещества X – 27 мм, расстояние от линии старта до центра пятна стандартного вещества –26 мм.
ВОПРОСЫ И ТЕСТЫ К МОДУЛЬНОМУ ЗАНЯТИЮ №4
1. МЕТРОЛОГИЧЕСКИЕ ОСНОВЫ АНАЛИТИЧЕСКОЙ ХИМИИ
1. Каковы задачи метрологии и как данная наука связана с аналитикой?
2. Что такое правильность и воспроизводимость результатов?
3. Классификация ошибок количественного анализа.
4. Методы проверки правильности результатов анализа (метод градуировочного графика, метод стандартов и добавок).
5. Виды погрешностей.
6. Что такое доверительный интервал и доверительная вероятность?
Тесты к теме «Гравиметрия»
1. Укажите, к каким методам анализа относится «гравиметрия»:
А. Качественным.
В. Количественным.
С. Методам разделения и концентрирования веществ.
D. Инструментальным методам.
2. Абсолютная погрешность – это:
А. Разность между практическим выходом определяемого компонента и его теоретическим значением;
В. Отношение массы осаждаемой формы к гравиметрической;
С. Отношение массы гравиметрической формы к осаждаемой;
D. Разность между массой осаждаемой формы и массой навески.
3. Ожидаемая масса гравиметрической формы определяемого вещества, если осадок кристаллический, составляет:
А. 0,5г
В. 0,1г
С. 0,01г
D. 0,05г
4. Ожидаемая масса гравиметрической формы определяемого вещества, если осадок аморфный, составляет:
А. 0,5г
В. 0,1г
С. 0,01г
D. 0,05г
5. Точность гравиметрического анализа составляет:
А. 0,1%
В. 0,02%
С. 1%
D. 2%
6. Минимальная погрешность измерения массы вещества будет при взвешивании
А. 0,5г
В. 0,1г
С. 0,01г
D. 0,03г
7. Чувствительность аналитических весов с рейтером составляет
А. 0,0002г
В. 0,0001г
С. 0,01г
D. 0,00005г
8. Гравиметрический анализ состоит в определении:
А. массы веществ;
В. объема раствора;
С. концентрации раствора;
D. гравиметрического фактора.
9. Гравиметрический фактор вычисляется по формуле:
А. F= А(опред.в.) / М(грав.ф.);
В. F= а∙А(опред.в.) / в∙М(грав.ф.);
С. F= М(грав.ф.)∙А(опред.в.);
D. F= М(грав.ф.)∙А(опред.в.) / m(грав.ф.).
10. На какое число следует умножить молярную массу хромата бария для расчета гравиметрического фактора при определении дихромат-иона в виде осадка BaCrO4
А. 2;
В. 4;
С. 1;
D. 3
11. Какие требования предъявляются к осадительным органическим реагентам, применяемых в гравиметрии?
А. высокая константа устойчивости комплекса;
В. низкая растворимость комплекса осаждаемого металла с реагентом;
С. хорошая растворимость реагента в воде;
D. устойчивость комплекса при высушивании.
12. Кристаллические осадки получают из растворов с относительным пересыщением:
А. малым;
В. большим;
С. любым;
D. относительным.
13. Аморфные осадки получают из растворов с относительным пересыщением:
А. большим;
В. малым;
С. любым;
D. относительным.
14. Аморфные осадки получают, прибавляя осадитель:
А. быстро при энергичном перемешивании;
В. медленно без перемешивания;
С. медленно при энергичном перемешивании;
D. быстро без перемешивания.
15. Кристаллические осадки получают, прибавляя осадитель:
А. медленно при энергичном перемешивании;
В. медленно без перемешивания;
С. быстро при энергичном перемешивании;
D. быстро без перемешивания.
16. Укажите органические осадительные реагенты, применяемые для осаждения ионов при гравиметрических определениях:
А. купферон;
В. 8 – оксихинолин;
С. антраниловая кислота;
D. хлороформ.
17. Кристаллические осадки получают из растворов:
А. горячих кислых;
В. горячих нейтральных;
С. горячих щелочных;
D. холодных кислых.
18. Аморфные осадки получают из растворов:
А. горячих кислых;
В. горячих нейтральных;
С. горячих щелочных;
D. холодных кислых.
19. Осаждаемая форма - это:
А. осадок, образующийся при взаимодействии двух веществ;
В. осадитель, используемый для осаждения определяемого вещества;
С. осадок, полученный после фильтрования;
D. осадок, полученный после высушивания и прокаливания.
20. Гравиметрическая форма – это:
А. осадок, образующийся при взаимодействии двух веществ;
В. осадитель, используемый для осаждения определяемого вещества;
С. осадок, полученный после фильтрования;
D. осадок, полученный после высушивания и прокаливания.
21. Какие осадки необходимо оставлять на старение:
а) аморфные;
б) кристаллические;
в) коллоидные.
22. Окклюзия – это:
а) внутреннее загрязнение кристаллов осадка;
б) поверхностное загрязнение кристаллов осадка;
в) образование смешанных кристаллов осадка;
г) совместное осаждение.
23. Изоморфизм – это:
а) внутреннее загрязнение кристаллов осадка;
б) поверхностное загрязнение кристаллов осадка;
в) образование смешанных кристаллов осадка;
г) совместное осаждение.
24. Адсорбция – это:
а) внутреннее загрязнение кристаллов осадка;
б) поверхностное загрязнение кристаллов осадка;
в) образование смешанных кристаллов осадка;
г) совместное осаждение.
25. Послеосаждение – это:
а) внутреннее загрязнение кристаллов осадка;
б) поверхностное загрязнение кристаллов осадка;
в) образование смешанных кристаллов осадка;
г) совместное осаждение.
26. Относительная погрешность – это:
а) отношение абсолютной погрешности к его теоретическому значению;
б) отношение абсолютной погрешности к его практическому значению;
в) отношение массы гравиметрической формы к осаждаемой;
г) разность между массой осаждаемой формы и массой навески.
27. Метод, в котором определяемый компонент выделяют из анализируемой пробы в виде газообразного вещества и измеряют либо массу отогнанного вещества, либо массу остатка, это:
а) метод отгонки;
б) метод осаждения;
в) метод выделения;
г) термогравиметрия.
28. Метод, в котором определяемый компонент выделяют из анализируемой пробы свободном виде, это:
а) метод отгонки;
б) метод осаждения;
в) метод выделения;
г) термогравиметрия.
29. Метод, основанный на измерении массы анализируемого вещества при его непрерывном нагревании в заданном температурном интервале, это:
а) метод отгонки;
б) метод осаждения;
в) метод выделения;
г) термогравиметрия.
30. Декантация – это:
а) способ промывания осадка на фильтре;
б) способ количественного переноса осадка на фильтр, при котором к осадку приливают небольшую порцию промывной жидкости, взмучивают осадок стеклянной палочкой и сливают суспензию на фильтр;
в) сливание большей части раствора с осадка через фильтр;
г) способ промывания осадка, при котором к осадку в стакане приливают небольшую порцию промывной жидкости, перемешивают с осадком в стакане, дают раствору отстояться и сливают жидкость с осадка на фильтр
Тесты к теме: «ТИТРИМЕТРИЯ»
1). К инструментальным методам анализа относятся:
а) физические и физико-химические методы;
б) физические и химические методы;
в) химические и физико-химические методы;
г) только физические методы.
2). К физико-химическим методам относится:
а) гравиметрия;
б) титриметрия;
в) спектроскопия;
г) газоволюметрия.
3). В какой из приведённых ниже реакций фактор эквивалентности Н2 SO4 равен 1/8?
а) Н2SO4+2КОН=К2SO4+2Н2О;
б) Н2SO4+Zn = ZnSO4+S+Н2О;
в) Н2SO4+НI = I2+Н2S+Н2О;
г) Н2SO4+ВаCl2=ВаSO4+2HCl.
4). Укажите требования, предъявляемые к стандартным веществам:
а) химическая чистота, отсутствие кристаллизационной воды, устойчивость на воздухе;
б) отсутствие примесей, негигроскопичность, высокая плотность:
в) химическая устойчивость, небольшая молярная масса эквивалента, растворимость в воде;
г) химическая чистота, соответствие своей химической формуле, устойчивость на свету и на воздухе.
5). Аналитическим сигналом в титриметрическом анализе является:
а) объём;
б) плотность;
в) масса.
6). Титр раствора показывает количество грамм растворённого вещества, содержащегося в:
а) 1 литре раствора;
б) 100 мл раствора;
в) 1 мл раствора;
г) 5 мл раствора.
7). Фактор эквивалентности f Н3РО4 в реакции Н3РО4 + 2 NаОН= Nа2НРО4+2Н2О равен:
а) 1/2;
б) 1/3;
в) 1;
г) 1/5.
8). Укажите, что означает понятие «точка эквивалентности»:
а) момент титрования, при котором происходит резкое изменение какого-либо свойства раствора;
б) момент титрования, при котором количество прибавленного титранта химически эквивалентно количеству определяемого вещества;
в) момент титрования, при котором происходит изменение окраски индикатора;
г) момент титрования, при котором титрование заканчивается.
9). Каков титр раствора серной кислоты, если С N равна 0,5 моль/л?
а) 0,024 г/мл;
б) 0,24 г/мл;
в) 0,0024 г/мл;
г) 2,4 г/мл.
10. Укажите виды мерной посуды, используемые в титриметрическом анализе для точного измерения объема:
А. мерная колба, колба для титрования, мерный цилиндр;
В мерная колба, бюретка, градуированная пробирка;
С. мерный цилиндр, мерная колба, бюретка;
D. мерная пипетка, мерная колба, бюретка.
ВОПРОСЫ И ТЕСТЫ К МОДУЛЬНОМУ ЗАНЯТИЮ №5
Вопросы к теме: «ПЕРМАНГАНАТОМЕТРИЯ»
1. Какие реакции называют окислительно-восстановительными?
2. Дайте определение понятиям: окисление, восстановление, окислитель, восстановитель.
3. Какие из приведенных ниже уравнений реакций являются окислительно-восстановительными?
2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Mn(OH)2 + 2HCl ® MnCl2 + 2H2O
6KI + K2Cr2O7 +7H2SO4 ® 5I2 + 4K2SO4 + Cr2 (SO4)3 + 7H2O
2NaHCO3 ® Na2CO3 + CO2 + H2O
Укажите в них окислитель и восстановитель.
4. Допишите следующие реакции, расставьте в них коэффициенты, используя метод электронно-ионного баланса:
КМnО4 + Н2О2 + H2SO4 ®
KMnO4 + KNO2 + H2SO4 ®
K2Cr2O7 + KNO2 + H2SO4 ®
KMnO4 + FeSO4 + H2SO4 ®
KMnO4 + H2C2O4 + H2SO4 ®
5. Какие титранты-окислители применяются в окислительно-восстановительных методах. Их характеристика и примеры определений с использованием титрантов-окислителей.
6. Какие вещества применяют для установки характеристик раствора KMnO4? Напишите уравнения реакций стандартизации раствора KMnO4.
7. Каковы особенности приготовления стандартного раствора KMnO4 и условия его хранения?
8. Какие процессы протекают в свежеприготовленном растворе перманганата калия?
9. Какие вещества можно определять прямым перманганатометрическим титрованием?
10. От каких факторов зависит реальный потенциал окислительно-восстановительной пары? Напишите уравнения Нернста.
11. Используя метод полуреакций, составьте уравнение реакции восстановления перманганат – иона в кислой среде. Как рассчитать эквивалент MnO4- в данном случае?
12. Используя метод полуреакций, составьте уравнение реакции восстановления перманганат – иона в нейтральной среде. Как рассчитать эквивалент MnO4- в данном случае?
13. Используя метод полуреакций, составьте уравнение реакции восстановления перманганат – иона в щелочной среде. Как рассчитать эквивалент MnO4- в данном случае?
14. Для чего метод перманганатометрии используется в клиническом анализе?
15. Почему раствор перманганата калия нужно хранить в темноте? Приведите соответствующее уравнение реакции.
16. Составьте уравнение реакции взаимодействия перманганата калия с оксалатом натрия в сернокислой среде.
17. Составьте уравнение реакции взаимодействия перманганата калия с сульфатом железа (II) в сернокислой среде.
Вопросы к теме: « ЙОДОМЕТРИЯ»
1. Запишите реакцию, лежащую в основе метода йодометрии.
2. В каких случаях метод иодометрии применяется для определения окислителей, а в каких – для определения восстановителей? Приведите примеры.
3. Запишите реакцию взаимодействия йода с тиосульфатом натрия. Уравняйте, применив метод полуреакций.
4. Допишите реакции и уравняйте, применив метод полуреакций:
А) SО32- + I2 + Н2О →
Б) Sn2+ + I2 →
В) MnО42- + I- + Н+→
Г) СlО3- + Н+ + I- →
5. Какие продукты образуются при взаимодействии бихромата калия с иодидом калия в сернокислой среде? Напишите уравнение соответствующей реакции.
6. По приведенным схемам составьте полные уравнения реакций: 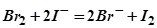 ;
;
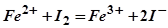 .
.
6. В каких случаях и как проводится метод прямого титрования?
7. Когда в йодометрии применяют метод обратного титрования? В чем он состоит?
8. Какой способ титрования применяют в йодометрии для определения окислителей? Опишите его.
9. Почему титрование в методе йодометрии нужно проводить на холоду?
10. Почему титрование в методе йодометрии нельзя вести в щелочной среде? Какая протекает реакция? Как образующийся гипоиодид–ион окисляет тиосульфат–ион? Приведите соответствующие уравнения реакций.
11. Объясните, почему иодометрические определения нужно вести в присутствии избытка иодида калия?
12. Почему титрованные растворы йода необходимо хранить в склянках из темного стекла? По какой реакции иодид калия окисляется кислородом воздуха?
13. Сравните точность метода йодометрии с другими окислительно–восстановительными методами.
14. Обязательно ли применение индикаторов в методе йодометрии? Почему?
15. Почему возможно применение неводных растворов в методе йодометрии?
16. Как водный раствор тиосульфат натрия разлагается под действием кислорода воздуха и оксида углерода (IV)? Допишите уравнения реакций:
Na2S2O3 + O2 →
Na2S2O3 + H2CO3→
17. Приведите формулу для расчета массы навески кристаллического тиосульфата натрия для приготовления раствора заданного объема и концентрации.
18. Как можно рассчитать нормальность и титр раствора тиосульфата натрия, используя нормальность и объем раствора йода?
Тесты к теме: « ЙОДОМЕТРИЯ»
1. Выберите метод для определения прямым титрованием Н2О2:
А. иодиметрия;
В. перманганатометрия;
С. алкалиметрия;
D. бромометрия.
2. Выберите метод для определения прямым титрованием I2:
А. дихроматометрия;
В. бромометрия;
С. тиосульфатометрия;
D. хлориодиметрия.
3. Выберите вещество, которое можно определять косвенным иодиметрическим титрованием:
A. Fe(III);
В. Fe(II);
C. Na2S2O3;
D. As(III).
4. Выберите вещество, которое можно определять косвенным иодиметрическим титрованием:
A. Sb(III);
B. K2Cr2O7;
С. Cu(I);
D. K4[Fe(CN)6] .
5. Выберите вещество, которое можно определять обратным иодиметрическим титрованием:
А. KВr;
В. KВrО3;
С. бензохинон,
D. гидрохинон.
6. Выберите вещество, которое можно определять обратным иодиметрическим титрованием:
A. Fe(III);
В. H2S;
С. сульфаниловая кислота;
D. NaNO2.
7. Какая теория индикаторов связывает изменение окраски индикатора с изменением его строения:
А. ионная;
В. хромофорная;
С. ионно-хромофорная;
D. нет такой теории?
8. Что означает понятие «интервал перехода окраски индикатора»:
A. интервал, в котором осуществляется переход 99,9 % одной формы индикатора в другую;
B. интервал, в котором наблюдается цвет смешанной окраски двух форм индикатора;
C. отрезок на кривой титрования, когда происходит резкое изменение свойства раствора;
D. интервал, в котором отношение концентраций двух форм индикатора составляет от 0,1 до 10?
- Иодометрией называется метод редоксиметрического анализа, при котором о количестве определяемого вещества судят по ……………...
- При определении восстановителей в иодометрии используют:
А) прямое титрование
Б) обратное титрование
В) титрование по методу замещения
- При определении окислителей в иодометрии используют:
А) прямое титрование
Б) обратное титрование
В) титрование по методу замещения
- При определении восстановителей методом иодометрии иод восстанавливается до ………….
- При определении окислителей методом иодометрии иодид - ион окисляется до ………….
- Дописать реакции :
А) SО32- + I2 + Н2О →
Б) Sn2+ + I2 →
В) 2MnО42- + 10I- + 16Н+→
Г) СlО3- + 6Н+ + 6I- →
- Иодометрические определения нужно проводить:
А) при повышенной температуре
Б) в щелочной среде
В) в кислой или нейтральной среде
Д) в присутствии иодида калия
15. Метод иодометрии:
А) характеризуется небольшой точностью
Б) требует титрования в присутствии индикатора
В) можно проводить в неводных средах
Г) применяют только для веществ, которые реагируют с иодом непосредственно
16. Иод реагирует с тиосульфатом натрия по уравнению………
…
17. При взаимодействии бихромата калия с иодидом калия в сернокислой среде образуются:
1) СrSО4
2) Сr2(SО4 )3
3) СrI3
4) I2
5) НI
18. В йодометрии в качестве индикатора используют:
а) лакмус;
б) фенолфталеин;
в) раствор КМnО4;
г) раствор I2.
19. Титрантом в йодометрии служит:
а) раствор йода в растворе КI;
б) тиосульфат натрия;
в) щавелевая кислота;
г) КМnO4.
20. Выберите стандартное вещество для стандартизации титранта I2:
а) Na2S2O3;
б) As2O3;
в) Н2С2О4×2Н2О;
г) Zn (метал.).
21. Титрованным раствором называется раствор с:
а) известной концентрации;
б) известной массой;
в) известной плотностью;
г) известной температурой кипения.
22. Методы определения окислителей и восстановителей в титриметрии называются:
а) редоксиметрией;
б) комплексонометрией;
в) нейтрализацией.
23. При определении восстановителей в иодометрии используют:
А) прямое титрование
Б) обратное титрование
В) титрование по методу замещения
24. При определении окислителей в иодометрии используют:
А) прямое титрование
Б) обратное титрование
В) титрование по методу замещения
25. Иодометрические определения нужно проводить:
А) при повышенной температуре
Б) в щелочной среде
В) в кислой или нейтральной среде
Д) в присутствии иодида калия
26. Метод иодометрии:
А) характеризуется небольшой точностью
Б) требует титрования в присутствии индикатора
В) можно проводить в неводных средах
Г) применяют только для веществ, которые реагируют с иодом непосредственно.
Вопросы к теме «Дихроматометрия»
1. В чем сущность метода дихроматометрии?
2. Расставьте коэффициенты, используя метод электронного баланса в реакции:
KI + K2Cr2O7 +H2SO4 ® I2 + K2SO4 + Cr2SO4)3 + H2O
Укажите окислитель и восстановитель.
3. Допишите следующие реакции, расставьте в них коэффициенты, используя метод электронно-ионного баланса:
KMnO4 + KNO2 + H2SO4 ®
K2Cr2O7 + KNO2 + H2SO4 ®
K2Cr2O7 + FeSO4 + H2SO4 ®
4. Чему равна молярная масса эквивалента дихромата калия при взаимодействии его с железом(II)?
5. В чем преимущества дихроматометрии перед перманганатометрией?
6. Что такое редокс-индикаторы?
7. Как производят хроматометрическое определение железа (II)? Что при этом служит индикатором? Зачем к раствору прибавляют ортофосфорную кислоту?
Вопросы к теме: «БРОМОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ»
1. Напишите уравнение реакции, лежащее в основе бромометрического метода анализа.
2. Что является титрантом метода и как его готовят?
3. Зависит ли окислительно-восстановительный потенциал титранта метода от pH? Дайте обоснованный ответ.
4. Чему равна молярная масса эквивалента калия бромата в бромометрических определениях?
5. Какие вещества можно определять методом бромометрического титрования?
6. Какие индикаторы можно использовать при бромометрическом титровании?
7. Как рассчитывают массу определяемых органических веществ в растворе при бромометрическом титровании?
8. Напишите уравнения реакций, лежащих в основе бромометрического определения натрия салицилата.
9. Напишите формулу, по которой рассчитывают массовую долю натрия салицилата в препарате, и объясните ее.
10. Чему равна молярная масса эквивалента натрия салицилата при бромометрическом титровании?
11. Какой индикатор используют при бромометрическом определении натрия салицилата?
12. Перечислите основные этапы методики определения натрия салицилата бромометрическим методом.
13. Какие стандартные растворы используют при выполнении этого определения?
14. Почему подкисленный раствор натрия салицилата после добавления бромид-броматной смеси закрывают часовым стеклом и выдерживают 10 мин? Напишите соответствующие уравнения реакций.
15. Объясните, почему при бромометрическом определении натрия салицилата с иодиметрическим окончанием необходимо медленно добавлять натрия тиосульфат и энергично перемешивать титруемый раствор?
16. Можно ли при этом титровании в качестве индикатора использовать раствор крахмала?
17. Как проверить отсутствие примесей калия иодата и калия бромата соответственно в растворе калия иодида и бромида?
Вопросы к теме: «НИТРИТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ»
1. Какие свойства может проявлять нитрит-ион в зависимости от природы реагирующего с ним вещества?
2. Какая реакция лежит в основе нитритометрического титрования веществ, содержащих первичную ароматическую аминогруппу? Напишите уравнение реакции в общем виде. Каковы оптимальные условия ее протекания?
3. Какие индикаторы применяют для установления точки эквивалентности в нитритометрическом титровании?
4. Напишите и объясните формулу, по которой рассчитывают массовую долю определяемого вещества в препарате по результатам нитритометрического титрования.
5. Как приготовить 0,1 моль/л раствор натрия нитрита при наличии сухой соли?
6. Какие вещества можно использовать в качестве первичных или вторичных стандартов для стандартизации раствора натрия нитрита?
7. Напишите уравнения реакций, лежащих в основе стандартизации раствора натрия нитрита с помощью вторичного стандарта обратным перманганатометрическим титрованием с иодиметрическим окончанием. Чему равны факторы эквивалентности натрия нитрита, калия перманганата и натрия тиосульфата в соответствующих реакциях?
8. По какой формуле рассчитывают массу навески натрия нитрита, необходимую для приготовления титранта?
9. Объясните целесообразность применения обратного титрования при стандартизации раствора натрия нитрита по калия перманганату.
10. Почему при стандартизации раствора натрия нитрита обратным перманганатометрическим титрованием раствор натрия нитрита прибавляют к подкисленному раствору калия перманганата, а не наоборот?
11. Напишите и объясните формулу, по которой рассчитывают молярную концентрацию эквивалента натрия нитрита в растворе при его стандартизации обратным перманганатометрическим титрованием с иодиметрическим окончанием.
12. Почему при нитритометрическом определении новокаина титрование проводят:
а) в солянокислой среде;
б) в присутствии калия бромида;
в) при температуре не выше 18 – 20° С;
г) прибавляя титрант медленно, особенно вблизи точки эквивалентности?
13. По какой формуле рассчитывают массу навески препарата новокаина, необходимую для приготовления анализируемого раствора?
14. Напишите и объясните формулы, по которым рассчитывают массу новокаина в аликвотной доле анализируемого раствора по данным нитритометрического титрования:
а) с использованием поправочного коэффициента раствора натрия нитрита и титриметрического фактора пересчета 0,1000 моль/л раствора натрия нитрита по новокаину;
б) с использованием молярной концентрации раствора натрия нитрита.
Вопросы к теме: «ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ»
1. Какие требования предъявляются к реакциям, используемым в методах осадительного титрования.
2. Какие индикаторы, применяются в методах осадительного титрования, принцип их действия, условия применения.
3. Адсорбционные индикаторы, принцип их действия и условия применения.
4. В чем сущность определение галогенидов методом Мора. Индикатор метода. Условия титрования.
5. Определение галогенид-ионов методом Фаянса-Ходакова.
6. Устойчивость растворов серебра нитрата и их хранение.
7. Определение галогенидов, тиоцианатов методом Фольгарда. Индикатор метода. Условия титрования.
8. Как проводят стандартизацию раствора аммония тиоцианата?
9. Почему в методах Мора и Фольгарда рекомендуется титровать медленно при энергичном перемешивании в отличие от метода Фаянса-Ходакова?
10. Почему определение хлоридов по методу Мора необходимо проводить в нейтральной или слабощелочной среде?
11. Почему определение йодидов по методу Фаянса-Ходакова нельзя проводить в сильнокислой среде?
12. В какой среде определяют бромиды по методу Фольгарда? Объясните почему?
13. С чем связано просветление раствора вблизи точки конца титрования при определении хлоридов методом Фаянса-Ходакова?
14. Укажите достоинства и недостатки методов Мора и Фаянса-Ходакова.
15. Напишите формулу, по которой рассчитывают содержание калия бромида в растворе по методу Фольгарда.
16. Какие галогениды можно определить по методу Мора, по методу Фаянса-Ходакова, по методу Фольгарда?
М раствора NаС l?
1)5 мл;
2)10 мл;
3) 100 мл;
4) 2 мл.
26. Количество поваренной соли NаСl в первых блюдах определяют методом Мора. Фильтрат титруют раствором АgNO3 в присутствии индикатора К2СrО4. Выпавший осадок Аg2СrО4 имеет:
1) белую окраску;
2) кирпично-красную;
3) жёлтую;
4) синюю.
Вопросы к теме: «КОМПЛЕКСОНОМЕТРИЯ»
1. Перечислите требования, предъявляемые к реакциям комплексообразования в титриметрическом анализе.
2. Какие органические вещества называются комплексонами? Перечислите наиболее известные комплексоны.
3. Дайте химическое название ЭДТА и напишите структурную формулу этого соединения.
4. Какая реакция лежит в основе метода комплексонометрического титрования?
5. Напишите в общем виде уравнения реакций взаимодействия ЭДТА с двух- и трехзарядными катионами металлов.
6. Какие органические вещества используют в качестве индикаторов в методе комплексонометрического титрования? Каков принцип их действия?
7. Перечислите наиболее важные металлохромные индикаторы и требования, предъявляемые к ним.
8. В каком случае в комплексонометрическом титровании используют метод обратного титрования?
9. Какие реакции лежат в основе прямого и обратного комплексонометрического титрования?
10. Катионы каких металлов можно определить методом комплексонометрического титрования?
11. Каково молярное соотношение атома комплексообразователя и лиганда в большинстве комплексонатов? Какова их окраска?
12. При анализе каких лекарственных веществ применяют метод комплексонометрического титрования?
13. Какой индикатор применяется при определении массы железа(III) и кальция в растворе прямым комплексонометрическим титрованием?
14. В какой среде проводят комплексонометрическое титрование железа(III) в растворе? Ответ обоснуйте. Укажите рН раствора.
15. В какой среде проводят комплексонометрическое титрование кальция в растворе? Дайте обоснованный ответ. Укажите рН раствора.
16. Каково молярное соотношение металла и лиганда в комплексонатах кальция и железа(III)? Какова окраска этих комплексонатов?
17. Каков цвет комплекса, образуемого железом(III) с сульфосалициловой кислотой в солянокислой среде?
ВОПРОСЫ И ТЕСТЫ К МОДУЛЬНОМУ ЗАНЯТИЮ №6
А - платиновый анод,
В - платиновый катод,
С - графитовый анод,
D - графитовый катод,
Е - каломельный электрод
9.Индикатором при кулонометрическом титровании кислот служит:
А - крахмал,
В - фенолфталеин,
С - метиловый оранжевый,
D - дифениламин,
Е – мурексид
10.Индикатором при кулонометрическом титровании тиосульфата натрия служит:
А - крахмал,
В - фенолфталеин,
С - метиловый оранжевый,
D - дифениламин,
Е – мурексид
11. Выражение объединенного закона Фарадея:
| a) | m = MF/nQ |
| b) | m = QM/nF |
| c) | m = nF/QM |
| d) | m = Qn/MF |
| e) | m = QF/nM |
12. Титрантом при кулонометрическом титровании тиосульфата натрия служит:
| a) | K2Cr2O7 |
| b) | H2SO4 |
| c) | K2SO4 |
| d) | KI |
| e) | I2 |
Тестовые задания по потенциометрии
1.Для какого электрода уравнение Нернста можно записать в виде: Е = Е° + 0,059 lg аН+
А - стеклянный
В - каломельный
С - хлоридсеребряный
D – серебряный
2.К электродам второго рода относятся:
А - каломельный, хлоридсеребряный
В - стеклянный, водородный
С - платиновый, серебряный
D - медный, хингидронный.
3.В качестве индикаторного при потенциометрическом определении железа ( II) можно использовать электрод:
А – серебряный
В - каломельный
С - платиновый
D – стеклянный
4.Укажите электрод, для которого уравнение Нернста можно записать в виде:
E = E°+0,059/ nIgП P/ aCl-
А - стеклянный
В - каломельный
С - хлоридсеребряный
D – серебряный
5.Электроды I рода - это:
А - металл в равновесии с насыщенным раствором малорастворимой соли
В - металл в равновесии с раствором двух малорастворимых солей с одноименным ионом
С - металл в равновесии с одноименными ионами
D - металлическая пластинка, опущенная в раствор соли
6.К мембранным электродам относится:
А - стеклянный
В - платиновый
С - хлоридсеребряный
D – водородный
7.Роль "грубого" титрования в методе потенциометрического титрования:
А - построение интегральной кривой титрования
В - проверка правильности показаний прибора
С - установление интервала объема титранта, в котором находится точка эквивалентности
D - определение приблизительного содержания вещества в растворе
8.При потенциометрическом определении веществ точку эквивалентности устанавливают по дифференциальной, а не по интегральной кривой титрования потому, что:
А - преимуществ в установлении точки эквивалентности нет
В - дифференциальная кривая позволяет более точно установить точку эквивалентности
С - предпочтение определяется выбором систем электродов
D - интегральную кривую титрования можно построить только для титрования сильных электролитов
9.Стеклянный электрод можно применять в потенциометрическом титровании при использовании реакций:
А - окислительно-восстановительных
В - комлексообразования
С - осаждения
D - кислотно-основных
10.В наибольшей степени потенциал каломельного электрода зависит от:
А - типа растворителя
В - концентрации ионов ртути
С - концентрации хлорид-ионов
D – температуры
11.Условие подготовки стеклянного электрода к работе?
А - электрод выдерживают в концентрированном растворе щелочи
В - электрод выдерживают в воде
С - электрод выдерживают в разбавленной (0,1 н.) кислоте
D - электрод предварительно не подготавливают.
12.Каломельный электрод - это электрод:
А - первого рода
В - второго рода
С - третьего рода
D - мембранный
13.Стеклянный электрод - это электрод:
А - первого рода
В - второго рода
С - третьего рода
D - мембранный
14.Хлоридсеребряный электрод - это электрод:
А- первого рода
В- второго рода
С- третьего рода
D- мембранный
Ответ А
Тестовые задания по амперометрическому титрованию
1.Координаты кривой амперометрического титрования:
A- I = f(E)
В - Е = f(V)
С - I = f(R)
D- I = f(V)
Е- Е = f(I)
2.Для амперометрического титрования можно использовать электрод:
А - платиновый
В - донную ртуть
С - водородный
D - ионселективный
Е – стеклянный
3.Потенциал индикаторного электрода при амперометрическом титровании должен быть:
А - меньше Е1 l2
В - больше E1 l2
С - равно Е1 l2
D - значительно меньше E1 l2
Е- любым
Кафедра химии и физики
Методические материалы по аналитической химии для студентов 2 курса фармацевтического факультета
Вопросы к промежуточному контролю
ВОПРОСЫ И ТЕСТЫ К МОДУЛЬНОМУ ЗАНЯТИЮ №1
1. Предмет и задачи аналитической химии. Качественный и количественный анализ. Применение методов аналитической химии в фармации.
2. Характеристика чувствительности и специфичности аналитических реакций.
3. Основные положения теории растворов электролитов, используемые в аналитической химии. Сильные и слабые электролиты.
4. Теория сильных электролитов Дебая-Хюккеля. Активность, коэффициент активности, ионная сила раствора.
5. Применение закона действующих масс в аналитической химии. Химическое равновесие. Константа химического равновесия. Смещение химического равновесия. Принцип Ле-Шателье-Брауна.
6. Понятие о методе и методике анализа. Классификация методов качественного анализа (дробный и систематический, макро-, полумикро-, микро-, ультромикроанализ).
7. Аналитические реакции (общие и частные) и требования, предъявляемые к ним. Способы и условия выполнения аналитических реакций.
8. Реактивы, используемые для выполнения аналитических реакций. Специфичность и селективность реакций. Использование качественного анализа в фармации.
9. Аналитическая классификация катионов по группам: сероводородная (сульфидная), аммиачно- фосфатная, кислотно-основная. Ограниченность любой классификации катионов по группам.
10. Кислотно-основная классификация катионов по группам. Систематический анализ катионов по кислотно-основному методу.
11. Аналитическая классификация анионов по группам (по способности к образованию малорастворимых соединений, по окислительно-восстановительным свойствам). Ограниченность любой классификации анионов по группам.
12. Анализ смесей катионов и анионов (качественный химический анализ вещества).
13. Характерные реакции катионов I аналитической группы по кислотно-основной классификации.
14. Характерные реакции катионов II аналитической группы по кислотно-основной классификации.
15. Характерные реакции катионов III аналитической группы по кислотно-основной классификации.
Тесты к теме: «Техника выполнения и чувствительность аналитических реакций»
1. Аналитическая химия – это раздел химической науки, изучающей:
1) состав веществ;
2) свойства веществ;
3) применение веществ;
4) превращение веществ.
Дата: 2019-11-01, просмотров: 1368.