1. Метод перманганатометрии:
А) основан на окислительной активности иона MnО4-
Б) проводится только в кислой среде
В) проводят с использованием индикаторов
Г) применяют в клиническом анализе
2. Продуктом восстановления перманганат – иона в кислой среде является:
А) MnО42-
Б) MnO2
В) Mn2+
Г) Mn2О3
3. Продуктом восстановления перманганат – иона в щелочной среде является:
А) MnО42-
Б) MnO2
В) Mn2+
Г) Mn2О3
4. Продуктом восстановления перманганат – иона в нейтральной среде является:
А) MnО42-
Б) MnO2
В) Mn2+
Г) Mn2О3
5. Метод перманганатометрии используют для:
А)
Б)
В)
6. Хранить раствор КМnO4 нужно в темноте, так как свет ускоряет реакцию его разложения по схеме:
7. Метода перманганатометрии:
А) применяют без индикатора
Б) позволяет определять только сильные восстановители
В) дорогостоящий метод анализа
Г) применяют для определения веществ, не обладающих окислительно – восстановительной активностью
8. В методе перманганатометрии:
А) готовят титрованный раствор КMnО4 по точной навеске
Б) титр раствора КMnО4 нужно периодически проверять
В) используют НСl для подкисления раствора
Г) желательно нагревать реакционную смесь
9. КМnO4 реагирует с оксалатом натрия в сернокислой среде согласно реакции……….
10. В основе метода определения % - ного содержания железа в растворе соли Мора лежит реакция……………
11. Окислительная активность КMnО4 наиболее высокая в ……..среде.
12. Фактор эквивалентности (fэкв) перманганата калия при титровании им в кислой среде:
| a) | 1/5 |
| b) | 2 |
| c) | 1/2 |
| d) | 1/4 |
| e) | 1 |
13. В перманганатометрии используют индикатор:
а) крахмал;
б) КМnО4;
в) лакмус;
г) фенолфталеин.
14. Эквивалент КМ nO4 в реакции М nO4-+8Н++5е→М n2++4Н2О равен:
а) 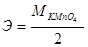 ;
;
б) 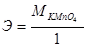 ;
;
в) 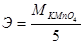 ;
;
г) 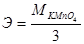 .
.
15. Выберите стандартное вещество для стандартизации титранта KМ nО4:
а) K2Сr2O7;
б) СаО;
в) Na2C2O4;
г) Na2CO3.
16. Фактор эквивалентности f окислителя в превращении MnO4- → Mn2+ равен:
а) 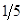 ;
;
б)  ;
;
в) 1;
г) 1/3.
17. Определить молярную массу эквивалента окислителя (г/моль) в реакции КМ n О4 + Н2О2 + H2S O 4 → O 2 + MnSO 4 + K 2 SO 4 + H 2 O
1)31,6;
2)52,67;
3)158;
4)17.
18. Определить молярную массу эквивалента окислителя (г/моль) в реакции КМ n О4 + Nа2SО3 + Н2О → MnO 2 + K O Н + Nа 2 SO 4
1)31,6;
2)52,67;
3)158;
4)63.
19. Определить молярную массу эквивалента окислителя (г/моль) в реакции КМ n О4 + Nа2SО3 + KOH → К2М n О4 + Nа2SО4 + H 2 O
1)31,6;
2)52,67;
3)158;
4)63.
20. Составить уравнение овр ионно-электронным методом и указать сумму коэффициентов у окислителя и восстановителя KMnО4 + KNО2 + H2SО4 → К NO 3 + MnSO 4 + K 2 SO 4 + H 2 O :
1) 5;
2) 7;
3) 10;
4) 2.
21. Укажите анионы, которые не обесцвечивают раствор калия перманганата в сернокислой среде:
А. сульфит–ион;
В. сульфат–ион;
С. нитрит–ион;
Д. ацетат–ион.
22. Укажите анионы, окисляющиеся раствором калия перманганата в сернокислой среде:
А. хлорид–ион;
В. бромид–ион;
С. иодид–ион;
Д. карбонат–ион.
Вопросы к теме: « ЙОДОМЕТРИЯ»
1. Запишите реакцию, лежащую в основе метода йодометрии.
2. В каких случаях метод иодометрии применяется для определения окислителей, а в каких – для определения восстановителей? Приведите примеры.
3. Запишите реакцию взаимодействия йода с тиосульфатом натрия. Уравняйте, применив метод полуреакций.
4. Допишите реакции и уравняйте, применив метод полуреакций:
А) SО32- + I2 + Н2О →
Б) Sn2+ + I2 →
В) MnО42- + I- + Н+→
Г) СlО3- + Н+ + I- →
5. Какие продукты образуются при взаимодействии бихромата калия с иодидом калия в сернокислой среде? Напишите уравнение соответствующей реакции.
6. По приведенным схемам составьте полные уравнения реакций: 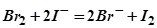 ;
;
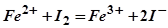 .
.
6. В каких случаях и как проводится метод прямого титрования?
7. Когда в йодометрии применяют метод обратного титрования? В чем он состоит?
8. Какой способ титрования применяют в йодометрии для определения окислителей? Опишите его.
9. Почему титрование в методе йодометрии нужно проводить на холоду?
10. Почему титрование в методе йодометрии нельзя вести в щелочной среде? Какая протекает реакция? Как образующийся гипоиодид–ион окисляет тиосульфат–ион? Приведите соответствующие уравнения реакций.
11. Объясните, почему иодометрические определения нужно вести в присутствии избытка иодида калия?
12. Почему титрованные растворы йода необходимо хранить в склянках из темного стекла? По какой реакции иодид калия окисляется кислородом воздуха?
13. Сравните точность метода йодометрии с другими окислительно–восстановительными методами.
14. Обязательно ли применение индикаторов в методе йодометрии? Почему?
15. Почему возможно применение неводных растворов в методе йодометрии?
16. Как водный раствор тиосульфат натрия разлагается под действием кислорода воздуха и оксида углерода (IV)? Допишите уравнения реакций:
Na2S2O3 + O2 →
Na2S2O3 + H2CO3→
17. Приведите формулу для расчета массы навески кристаллического тиосульфата натрия для приготовления раствора заданного объема и концентрации.
18. Как можно рассчитать нормальность и титр раствора тиосульфата натрия, используя нормальность и объем раствора йода?
Тесты к теме: « ЙОДОМЕТРИЯ»
1. Выберите метод для определения прямым титрованием Н2О2:
А. иодиметрия;
В. перманганатометрия;
С. алкалиметрия;
D. бромометрия.
2. Выберите метод для определения прямым титрованием I2:
А. дихроматометрия;
В. бромометрия;
С. тиосульфатометрия;
D. хлориодиметрия.
3. Выберите вещество, которое можно определять косвенным иодиметрическим титрованием:
A. Fe(III);
В. Fe(II);
C. Na2S2O3;
D. As(III).
4. Выберите вещество, которое можно определять косвенным иодиметрическим титрованием:
A. Sb(III);
B. K2Cr2O7;
С. Cu(I);
D. K4[Fe(CN)6] .
5. Выберите вещество, которое можно определять обратным иодиметрическим титрованием:
А. KВr;
В. KВrО3;
С. бензохинон,
D. гидрохинон.
6. Выберите вещество, которое можно определять обратным иодиметрическим титрованием:
A. Fe(III);
В. H2S;
С. сульфаниловая кислота;
D. NaNO2.
7. Какая теория индикаторов связывает изменение окраски индикатора с изменением его строения:
А. ионная;
В. хромофорная;
С. ионно-хромофорная;
D. нет такой теории?
8. Что означает понятие «интервал перехода окраски индикатора»:
A. интервал, в котором осуществляется переход 99,9 % одной формы индикатора в другую;
B. интервал, в котором наблюдается цвет смешанной окраски двух форм индикатора;
C. отрезок на кривой титрования, когда происходит резкое изменение свойства раствора;
D. интервал, в котором отношение концентраций двух форм индикатора составляет от 0,1 до 10?
- Иодометрией называется метод редоксиметрического анализа, при котором о количестве определяемого вещества судят по ……………...
- При определении восстановителей в иодометрии используют:
А) прямое титрование
Б) обратное титрование
В) титрование по методу замещения
- При определении окислителей в иодометрии используют:
А) прямое титрование
Б) обратное титрование
В) титрование по методу замещения
- При определении восстановителей методом иодометрии иод восстанавливается до ………….
- При определении окислителей методом иодометрии иодид - ион окисляется до ………….
- Дописать реакции :
А) SО32- + I2 + Н2О →
Б) Sn2+ + I2 →
В) 2MnО42- + 10I- + 16Н+→
Г) СlО3- + 6Н+ + 6I- →
- Иодометрические определения нужно проводить:
А) при повышенной температуре
Б) в щелочной среде
В) в кислой или нейтральной среде
Д) в присутствии иодида калия
15. Метод иодометрии:
А) характеризуется небольшой точностью
Б) требует титрования в присутствии индикатора
В) можно проводить в неводных средах
Г) применяют только для веществ, которые реагируют с иодом непосредственно
16. Иод реагирует с тиосульфатом натрия по уравнению………
…
17. При взаимодействии бихромата калия с иодидом калия в сернокислой среде образуются:
1) СrSО4
2) Сr2(SО4 )3
3) СrI3
4) I2
5) НI
18. В йодометрии в качестве индикатора используют:
а) лакмус;
б) фенолфталеин;
в) раствор КМnО4;
г) раствор I2.
19. Титрантом в йодометрии служит:
а) раствор йода в растворе КI;
б) тиосульфат натрия;
в) щавелевая кислота;
г) КМnO4.
20. Выберите стандартное вещество для стандартизации титранта I2:
а) Na2S2O3;
б) As2O3;
в) Н2С2О4×2Н2О;
г) Zn (метал.).
21. Титрованным раствором называется раствор с:
а) известной концентрации;
б) известной массой;
в) известной плотностью;
г) известной температурой кипения.
22. Методы определения окислителей и восстановителей в титриметрии называются:
а) редоксиметрией;
б) комплексонометрией;
в) нейтрализацией.
23. При определении восстановителей в иодометрии используют:
А) прямое титрование
Б) обратное титрование
В) титрование по методу замещения
24. При определении окислителей в иодометрии используют:
А) прямое титрование
Б) обратное титрование
В) титрование по методу замещения
25. Иодометрические определения нужно проводить:
А) при повышенной температуре
Б) в щелочной среде
В) в кислой или нейтральной среде
Д) в присутствии иодида калия
26. Метод иодометрии:
А) характеризуется небольшой точностью
Б) требует титрования в присутствии индикатора
В) можно проводить в неводных средах
Г) применяют только для веществ, которые реагируют с иодом непосредственно.
Вопросы к теме «Дихроматометрия»
1. В чем сущность метода дихроматометрии?
2. Расставьте коэффициенты, используя метод электронного баланса в реакции:
KI + K2Cr2O7 +H2SO4 ® I2 + K2SO4 + Cr2SO4)3 + H2O
Укажите окислитель и восстановитель.
3. Допишите следующие реакции, расставьте в них коэффициенты, используя метод электронно-ионного баланса:
KMnO4 + KNO2 + H2SO4 ®
K2Cr2O7 + KNO2 + H2SO4 ®
K2Cr2O7 + FeSO4 + H2SO4 ®
4. Чему равна молярная масса эквивалента дихромата калия при взаимодействии его с железом(II)?
5. В чем преимущества дихроматометрии перед перманганатометрией?
6. Что такое редокс-индикаторы?
7. Как производят хроматометрическое определение железа (II)? Что при этом служит индикатором? Зачем к раствору прибавляют ортофосфорную кислоту?
Дата: 2019-11-01, просмотров: 1339.