Содержание
1 Фотосинтез. Определение, общее уравнение, основные этапы становления учения о фотосинтезе. Историческое значение работ К.А. Тимирязева
2 Фотосинтез как основа энергетики биосферы. Космическая роль фотосинтеза. Роль фотосинтеза в процессах энергетического и пластического обмена растительного организма
3 Структурная организация фотосинтетического аппарата
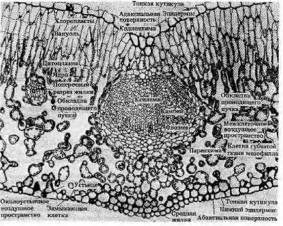
3.1 Лист как орган фотосинтеза
3.2 Состав, строение, функции, возникновение и развитие хлоропластов
4 Пигменты хлоропластов
4.1 Хлорофиллы: состав, структура, биосинтез, оптические и химические свойства, значение
4.2 Каратиноиды. Их структура функции и физиологическая роль
4.3 Фикобилины. Их структура функции и физиологическая роль
4.4 Экологическое значение спектрально-различных форм пигментов у фотосинтезирующих организмов
5 Световая фаза фотосинтеза
5.1 Фотофизический этап. Электронно-возбуждённое состояние пигментов. Представление о фотосинтетической единице. Антенные комплексы. Реакционные центры. Преобразование энергии в реакционном центре
5.2 Фотохимический этап Электронно-транспортная цепь фотосинтеза. Представления о функционировании двух фотосистем. Фотофосфорилирование. Системы фотоокисления воды и выделения кислорода при фотосинтезе. Фотофосфорилирование. Связь фотосинтетической ассимиляции СО2 с фотохимическими реакциями
6 Метаболизм углерода при фотосинтезе (темновая фаза)
6.1 Химизм реакции цикла Кальвина
6.2 Цикл Хэтча-Слэка-Карпилова, его эволюционное значение. Различные типы усвоения углекислого газа С4-растениями
6.3 САМ-тип метаболизма. Потоки метаболитов в хлоропласт и из него
7 Фотодыхание, его значение. Сравнение фотодыхания у растений с различными типами метаболизма углерода
8 Эндогенные механизмы регуляции процесса фотосинтеза
9 Зависимость процесса фотосинтеза от факторов внешней среды
Список литературы
ВВЕДЕНИЕ
Фотосинтез — это процесс трансформации поглощенной организмом энергии света в химическую энергию органических (и неорганических) соединений. Главную роль в этом процессе играет использование энергии света для восстановления С02 до уровня углеводов. Часто говорят о фототрофной функции фотосинтеза, понимая под этим использование энергии света в различных эндергонических реакциях в живом организме. Фотосинтез осуществляют высшие растения, водоросли и некоторые бактерии. Он играет определяющую роль в энергетике биосферы.
Структурная организация фотосинтетического аппарата
Лист как орган фотосинтеза
Основные функции листа зеленого растения — фотосинтез (воздушное питание), транспирация (регулируемое испарение воды) и синтез ряда органических веществ, в том числе некоторых фитогормонов (ауксина, гиббереллинов, абсцизовой кислоты).
Лист, как правило, имеет плоскую форму и дорсовентральное строение. Пластинчатая форма листа обеспечивает наибольшую поверхность на единицу объема ткани, что создает наилучшие условия для воздушного питания.
Пигменты хлоропластов
Пигменты — важнейший компонент аппарата фотосинтеза. Изучение растительных пигментов резко ускорилось благодаря работам русского физиолога растений М. С. Цвета. Пытаясь найти способ разделения пигментов на индивидуальные вещества, Цвет в 1901 — 1903 гг. открыл принципиально новый метод, который он назвал адсорбционной хроматографией. Через колонку с сорбентом пропускается растворитель с растворенными веществами. Так как вещества различаются по степени адсорбции, они перемещаются по колонке с разной скоростью. В результате происходит разделение веществ. Этот прием широко используется в современной биохимии, химии и в некоторых отраслях промышленности. С помощью хроматографического метода Цвет обнаружил два хлорофилла — а и b и разделил желтые пигменты листа на три фракции.
Пигменты пластид относятся к трем классам веществ: хлорофиллам, фикобилинам и каротиноидам.
Световая фаза фотосинтеза
5.1 Фотофизический этап. Электронно-возбужденное состояние пигментов. Представление о фотосинтетической единице. Антенные комплексы. Реакционные центры. Преобразование энергии в реакционном центре
На световой фазе фотосинтеза происходит поглощение света молекулами хлорофилла а с участием дополнительных пигментов (хлорофилла b, каротиноидов, фикобилинов) и трансформация энергии света в химическую энергию АТФ и восстановленного НАДФ. Все эти процессы осуществляются в фотохимически активных мембранах хлоропластов и представляют собой сложную систему фотофизических, фотохимических и химических реакций. В состав ламелл хлоропластов входят пять многокомпонентных белковых комплексов: светособирающий комплекс, фотосистемы I и II, цитохромный комплекс, включающий цитохромы b6 и f5 и АТФазный комплекс, участвующий в синтезе АТФ. Все они функционируют, взаимодействуя друг с другом.
Две фотосистемы. Впервые идею о существовании в хлоропластах двух фотосистем высказал Р. Эмерсон (1957), изучая влияние света на квантовый выход фотосинтеза у хлореллы. Под квантовым выходом фотосинтеза понимается количество выделившегося 02 или связанного С02 на 1 квант поглощенной энергии. Было показано, что квантовый выход высок при освещении хлореллы красными лучами с длиной волны 660-680 нм. Использование красного света с большей длиной волны приводило к снижению квантового выхода, а при 700 нм фотосинтез почти прекращался, хотя эта часть спектра еще поглощается хлорофиллом. Однако если хлореллу одновременно освещали коротковолновым (650 нм) и длинноволновым (700 нм) красным светом, то суммарный эффект (Y) был выше, чем при действии каждого красного света в отдельности.
Это явление получило название эффекта усиления Эмерсона. Отсюда возникло предположение, что в хлоропластах взаимодействуют две пигментные системы.
Предположение Эмерсона о двух пигментных системах подтвердилось в последующих работах, в которых из мембран хлоропластов с помощью детергентов (поверхностно-активных веществ, диссоциирующих гидрофобные связи) дифференциального центрифугирования в градиенте плотности сахарозы и других приемов удалось выделить и изучить белковые комплексы фотосистемы I (ФС I) и фотосистемы II (ФС II).
В состав ФС I в качестве реакционного центра входит димер пигмента П700 (хлорофилл а с максимумом поглощения 700 нм), а также хлорофиллы а675-695, играющие роль антенного компонента фотосистемы I. Первичным акцептором электронов в этой системе является мономерная форма хлорофилла а695 (Ах), вторичными акцепторами — А2 и Ав (железосерные белки — FeS). Комплекс ФС I под действием света восстанавливает водорастворимый FeS-белок ферредоксин (Фд) и окисляет медьсодержащий водорастворимый белок пластоцианин (Пц).
Белковый комплекс ФС II включает в себя реакционный центр содержащий хлорофилл а П680, а также антенные пигменты — хлорофиллы a670-673. Первичным акцептором электронов в этой фотосистеме выступает феофетин а (Фф), передающий электроны на первичный пластохинон, ассоциированный с FeS (QA) и дальше на вторичный пластохинон (Qb). В состав ФС II входят также белковый комплекс S-системы, окисляющий воду, и переносчик электронов Z, связанный с системой S и служащий донором е для П680. Этот комплекс функционирует с участием марганца, хлора и кальция. В ФС II локализован цитохром b559. ФС II восстанавливает пластохинон (PQ) и окисляет воду с выделением 02 и протонов.
Связующим звеном между ФС II и ФС I служат пул (фонд) пластохинонов, белковый цитохромный комплекс b6 — f5 и пластоцианин.
В ходе эволюции ФС I возникла раньше. Она функционирует у ныне существующих фотосинтезирующих бактерий, фотосинтез которых осуществляется без разложения воды и выделения 02 (фоторедукция). В этом случае функцию доноров электронов для световой фазы фотосинтеза выполняют легко окисляемые соединения, такие, как H2S, Н2, СН4 и др.
Антенные комплексы и миграция энергии в пигментных системах. Эмерсон и Арнольд показали, что в хлоропластах растений на каждый реакционный центр приходится от 200 до 400 молекул хлорофилла, функции которых связаны с поглощением света и передачей энергии возбужденного состояния на реакционные центры. Молекулы хлорофилла а и дополнительные пигменты — хлорофилл b, каротиноиды, фикобилины — входят в состав антенных или светособирающих комплексов (ССК). Из ламелл хлоропластов выделены светособирающий белковый комплекс с хлорофиллами а и b (ССКa-Ь ), тесно связанный с ФС II, и антенные комплексы, непосредственно входящие в фотосистемы I и II (фокусирующие антенные компоненты фотосистем).
В ССКa-Ь присутствуют хлорофилл а в двух или трех формах с максимумами поглощения между 660 и 675 нм, хлорофилл b с максимумом поглощения 650 нм и каротиноиды. В каждом ССКa-b содержится от 120 до 240 молекул хлорофиллов, причем отношение хлорофилла а к хлорофиллу b составляет 1,2—1,4. Половина белка тилакоидов и около 60% общего количества хлорофилла локализовано в ССК. У сине-зеленых и красных водорослей, у которых хлорофилл b отсутствует, роль ССК выполняют фикобилисомы, в состав которых входят фикобилины.
Антенный белковый комплекс ФС II содержит 40 молекул хлорофиллов а с максимумами поглощения 670 — 683 нм на один П680 и β-каротин.
Антенный белковый комплекс ФС I состоит из хромопротеинов, содержащих 110 молекул хлорофиллов а с максимумами поглощения 680 — 695 нм на один П700, из них 60 молекул — компоненты антенного комплекса самой фотосистемы, а 50 входят в состав комплекса, который можно рассматривать как ССК ФС I. Антенный комплекс ФС I также содержит β-каротин.
Хромопротеины антенных комплексов не обладают фотохимической и энзиматической активностью. Если бы каждая молекула хлорофилла преобразовывала поглощенную ею энергию кванта света в фотохимическую реакцию, то такая система была бы крайне нерентабельна. Продолжительность синглетного возбужденного состояния исчисляется 10-12 — 10-9 с, и даже на прямом солнечном свету 1 квант света поглощается молекулой хлорофилла не чаще одного раза за 0,1 с. Большую часть времени молекула хлорофилла «простаивает». Поэтому роль пигментов антенных комплексов состоит в том, чтобы собирать и передавать энергию квантов на небольшое количество молекул реакционных центров П680 и П700, которые и осуществляют фотохимические реакции. Аналогично отдельные капли дождя ударяют в крышу и, сливаясь, создают постоянный ток воды в водостоке.
Передача (миграция) энергии по пигментам антенных комплексов происходит по принципу индуктивного резонанса (без флуоресценции и переноса заряда). Природа индуктивного резонанса сострил в следующем. Каждая молекула хлорофилла, поглотившая квант света и перешедшая в синглетное возбужденное состояние, является молекулярным осциллятором. Возникающее вокруг возбужденной молекулы переменное электрическое поле с определенной частотой колебаний индуцирует осцилляцию диполя (электрон — ядро) соседней молекулы. При этом молекула-донор переходит в основное состояние, а молекула-акцептор — в возбужденное. Условиями для резонансного переноса энергии электронного возбуждения служат малые расстояния между молекулами, не превышающие 10 нм, и перекрытие частот колебаний у двух взаимодействующих молекул.
Флуоресценция каждой молекулы-донора имеет более длинноволновый максимум по сравнению с максимумом ее поглощения (в соответствии с правилом Стокса) и в большей или меньшей степени перекрывает зону поглощения акцепторной молекулы. Миграция энергии осуществляется от коротковолновых пигментов в сторону все более длинноволновых, т. е. пигментов с более низким уровнем синглетного возбужденного состояния.
В антенных комплексах перенос энергии осуществляется в ряду: каротин (400-550 нм)--► хлорофилл b (650 нм)--►хлорофиллы a (660-675 нм)---► П680 (ФС II). Скорость резонансного переноса энергии от молекулы к молекуле 10-10 — 10-9 с, причем эффективность переноса между молекулами хлорофилла достигает 100, а между молекулами каротина и хлорофилла — лишь 40%.
Реакционные центры. Белки, содержащие длинноволновые формы хлорофиллов (П680 в ФС II и П700 в ФС I) в количестве одна молекула на 200 — 400 молекул других хлорофиллов и способные к первичному фотохимическому разделению зарядов, называют реакционными центрами.
Первичное разделение зарядов в реакционных центрах происходит между молекулами хлорофилловой природы и связано с транспортом электронов. Функцию первичного донора электронов выполняет молекула хлорофилла, находящаяся в синглетном возбужденном состоянии. В реакционном центре ФС II, перешнуровывающем мембрану, первичным донором электронов служит П680, а первичным акцептором — феофетин. В реакционном центре ФС I первичный донор электронов— П700, а акцептор — мономерная форма хлорофилла а695 (А1).
Порядок реакций в реакционном центре ФС II определяется продолжительностью того или иного состояния молекул. Молекулы находятся в синглетном возбужденном состоянии 10-10 — 10-9 с. Первичные акцепторы (Фф или А1) получают электроны от своих доноров (П680 или П700 соответственно) за время около 10-12 с. Время обратных рекомбинаций от Фф- на П680+ и от A1- на П700+ во много раз больше (10-6 с). То же самое относится к последующим парам взаимодействующих молекул. Поэтому весь ход реакций резко сдвинут вправо. В реакционных центрах энергия возбужденного состояния хлорофилла преобразуется в энергию разделенных зарядов, т. е. превращается в химическую энергию.
Фотохимический этап. Электронно-транспортная цепь фотосинтеза. Представления о функционировании двух фотосистем. Фотофосфорилирование. Системы фотоокисления воды и выделения кислорода при фотосинтезе. Связь фотосинтетической ассимиляции С02 с фотохимическими реакциями
Нециклический и циклический транспорт электронов.
Для восстановления одной молекулы NADP+ в процессе фотосинтеза необходимы два электрона и два протона, причем донором электронов является вода. Фотоиндуцированное окисление воды осуществляет ФС II, восстановление NADP+ — фотосистема I. Следовательно, эти две фотосистемы должны функционировать во взаимодействии.
Исходя из данных о квантовом выходе фотосинтеза (необходимы 8 квантов света для выделения одной молекулы 02) из состава компонентов, входящих в ФС I и ФС II, и величин их окислительно-восстановительного потенциала была разработана схема последовательности реакций в световой фазе фотосинтеза.
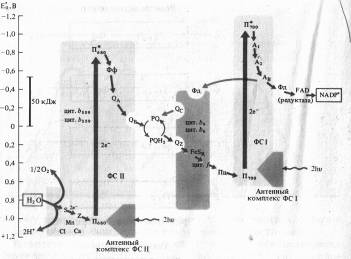
Из-за сходства с буквой Z эта схема, получила название Z-схемы. Впервые принцип Z-схемы был предложен Р. Хиллом и Ф. Бендаллом (1960) и экспериментально подтвержден работами Л. Дюйзенса (1961). В настоящее время Z-схема, или схема нециклического транспорта электронов при фотосинтезе является общепризнанной и непрерывно пополняется новыми деталями.
В ФС II димер П680, поглотив энергию, эквивалентную 2 квантам коротковолнового красного света, и перейдя в синглетное возбужденное состояние, отдает 2 электрона феофетину (Фф). От Фф электроны, теряя энергию, последовательно передаются на пластохиноны ФС 11 - QA и QB, на пул липидорастворимых молекул пластохинона (PQ), переносящих через липидную фазу мембраны электроны и протоны, на железосерный белок FeSK и цитохром цитохромного комплекса b6 — f, восстанавливая Cu-содержащий белок пластоцианин (Пц).
Вакантные места («дырки») в Пб80 заполняются двумя электронами из содержащего Мп переносчика электронов Z, который в свою очередь восстанавливается с участием системы S. Окисленный белковый комплекс S связывает воду и восстанавливается за счет электронов воды. Для осуществления этой реакции в белковом комплексе S необходимы Мп и С1-, а также Са2 + .
Однако описанная цепь реакций резко замедляется, если не возбуждена ФС I, так как в этом случае весь Пц переходит в восстановленное состояние. При возбуждении П700 в реакционном центре ФС I энергией, эквивалентной 2 квантам длинноволнового красного света, 2 электрона захватываются мономерной формой хлорофилла a (A1) и затем последовательно передаются переносчикам электронов А2 и Ав (железосерные белки FeS), ферредоксину (водорастворимый FeS-белок) и ферредоксин: NADP-оксидоредуктазе с FAD в качестве кофактора. Наконец, редуктаза восстанавливает NADP + .
На вакантные места в П700+ переходят электроны с Пц, и нециклическая цепь переноса электронов таким образом замыкается. Z-схема убедительно объясняет «эффект усиления Эмерсона», так как только при совместном использовании коротковолновых (ФС II) и длинноволновых (ФС I) лучей красного света интенсивность фотосинтеза будет оптимальной.
Энергия, освобождающаяся при движении электронов от П680 до П700, используется для синтеза АТФ из AДФ и неорганического фосфата (фотофосфорилирование).
Наряду с нециклическим в мембранах хлоропластов функционирует циклический транспорт электронов, включающий в себя только ФС I и комплекс цитохромов Ь6 — f. В этом случае возбужденные молекулы П700 последовательно отдают электроны на А1, А2, АB, Фд, PQ, цитохром b6, FeSR, цитохром f, Пц и, наконец, П700. При этом НAДФ+ не восстанавливается. Освобождающаяся энергия используется для фосфорилирования AДP.
Интересно отметить, что комплекс цитохромов Ь6 — f функционирует в системе транспорта электронов при фотосинтезе аналогично комплексу III (цит. Ь, C1) в митохондриях.
Разница в уровнях энергии между П680 и П700 (> 50 кДж) вполне достаточна для фосфорилирования AДФ, так как величина высокоэнергетической фосфатной связи АТФ равна 30,6 кДж/моль (7,3 ккал). Перепады энергии в ФС I еще значительнее. Однако само по себе освобождение энергии при нециклическом и циклическом транспорте электронов не объясняет, каким образом осуществляется фотофосфорилирование.
Механизм фосфорилирования AДФ, сопряженного с деятельностью ЭТЦ , объясняет хемиосмотическая теория, разработанная английским биохимиком П. Митчеллом (1961 — 1966). Для объяснения процессов фотофосфорилирования эта теория была впервые использована А. Ягендорфом (1967).
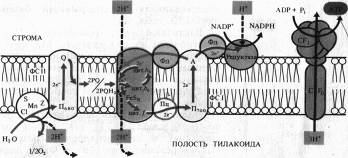
Сущность хемиосмотической теории состоит в следующем. Цепь переносчиков электронов и прогонов, действующая в соответствии с окислительно-восстановительным градиентом, перешнуровывает мембрану таким образом, что трансмембранный перенос е- и Н+ в одну сторону чередуется с переносом в обратную сторону только е-. В результате функционирования такого механизма (Н + -помпы) по одну сторону мембраны накапливается избыток Н+ и возникает электрохимический (т. е. электрический и концентрационный) потенциал ионов Н+, который служит формой запасания энергии. Обратный пассивный ток ионов Н+ через протонный канал Н+-АТФазы, получивший название сопрягающего фактор CF1, сопровождается образованием высокоэнергетической фосфатной связи АТФ.
На рис. 6.1 представлена упрощенная схема расположения переносчиков в мембране тилакоидов, объясняющая механизм фотофосфорилирования. На внутренней стороне мембраны тилакоида под действием света возбуждаются П680 и П700. Электроны от П680 захватываются акцепторами е- на наружной стороне и передаются на окисленную форму пластохинона (PQ) — липидорастворимого переносчика прогонов и электронов, выполняющего функцию челнока. Принимая два электрона, 2PQ диффундируют к цитохромному комплексу и захватывают из стромы 2Н + . Электроны с 2PQH2 поступают в цепь: F.eSR -> цит. f -> Пц,-> П700, а ионы Н + попадают в полость тилакоида. Вторая пара ионов Н+ освобождается там же при фотоокислении воды. В ФС I электроны П700 захватываются акцептором А, передаются ферредоксину и затем НAДФ+ на наружной стороне мембраны, причем 1Н+ используется на восстановление НAДФ.
Таким образом, из среды, окружающей тилакоид, при поглощении пигментами квантов света исчезают, а во внутренней полости тилакоида появляются протоны. В результате на мембране возникает электрохимический потенциал ионов Н + , который затем используется для фосфорилирования AДФ. Этот процесс называется нециклическим фотофосфорилированием.
При циклическом фотофосфорилировании, когда функционирует только ФС I, электроны от Фд поступают на цитохромный комплекс с использованием пула PQ, который действует как переносчик электронов и протонов. Затем электроны через цитохром f и Пц возвращаются на основной энергетический уровень в П700, а протоны поступают в полость тилакоида.
Белковые комплексы, участвующие в фотохимических реакциях фотосинтеза, в мембранах хлоропластов распределены неравномерно. Наибольшие различия наблюдаются между теми мембранами, которые плотно состыкованы друг с другом в гранах и теми участками мембран, которые контактируют со стромой (закругленные участки тилакоидов гран и мембраны тилакоидов стромы).
Светособирающий комплекс и пигмент-белковый комплекс ФС II находятся в основном в мембранах, плотно контактирующих друг с другом, причем ССК играет особую роль. В адгезии тилакоидных мембран.
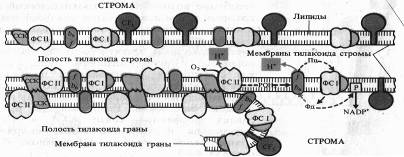
Показано, что у мутанта хламидомонады, лишенного белка, с которым связан хлорофилл Ь, граны не образуются. ФС I со своим светособирающим комплексом преимущественно, а АТФазный комплекс (CF1 + CF0), как правило, находятся на несостыкованных участках мембран. Комплекс цитохромов b6 — f равномерно распределен как в состыкованных, так и в не состыкованных мембранах. Такое распределение белковых комплексов, участвующих в световой фазе фотосинтеза, ставит вопрос о способе их взаимодействия. Показано, что это взаимодействие осуществляется с помощью легкоподвижного липофильного пластохинона PQ в липидной фазе и благодаря перемещению водорастворимого пластоцианина вдоль внутренних поверхностей ламелл и водорастворимого ферредоксина вдоль их наружных поверхностей.
К латеральным перемещениям вдоль мембраны способны и сами белковые комплексы. На это передвижение влияет величина их электрического заряда. Например, восстановление пластохинона PQ фотосистемой II приводит к активации киназы и фосфорилированию ССКа-ь. Фосфорилирование ССК увеличивает его отрицательный заряд, что способствует перемещению ССК в стромальную область мембраны и возрастанию миграции поглощенной энергии света к ФС I. Возросшая фотохимическая активность ФС I усиливает окисление PQ, что, в свою очередь, приводит к инактивации киназы, фосфатаза же дефосфорилирует ССК. Таким образом, обратимое фосфорилирование ССК представляет собой петлю обратной связи в системе взаимной регуляции активности ФС I и ФС II. Механизм такой регуляции включает латеральный транспорт белковых комплексов в мембранах хлоропластов.
6 Метаболизм углерода при фотосинтезе (темновая фаза)
В результате фотохимических реакций в хлоропластах создается необходимый уровень АТР и NADPH. Эти конечные продукты световой фазы фотосинтеза стоят на входе в темновую фазу, где С02 восстанавливается до углевода:
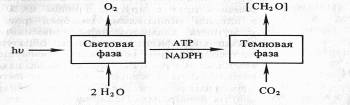
Однако сами по себе АТФ и НAДФH не в состоянии восстановить С02. Очевидно, и темновая фаза фотосинтеза — сложный процесс, включающий большое количество реакций. Кроме того, существуют различные пути восстановления С02. В настоящее время известны так называемые С3-путь и С4-путь фиксации С02, фотосинтез по типу толстянковых (САМ-метаболизм) и фотодыхание. Рассмотрим каждый из этих путей в отдельности.
Рис. 7.1
Список литературы
1. Андреева Т.Ф. Фотосинтез и азотный обмен листьев.- М: Наука, 1969
2. Клейтон Р. Фотосинтез. Физические механизмы и химические модели. - М., 1984.
3. Кретович В.Л. Биохимия растений. М., 1986
4. Овчинников Н.Н. Фотосинтез. - М: Просвещение, 1972.
5. Полевой В.В. Физиология растений. - М.: “Высшая школа”, 1989
6. Рабинович Е. Фотосинтез. - М: Издательство иностранной литературы, 1959
7. Судьина Е.Г. Фотосинтез – основа жизни. - Киев: Издательство академии наук украинской ССР, 1962
8. Якушкина Н.И. Физиология растений.- М.: Просвещение, 1993.
Содержание
1 Фотосинтез. Определение, общее уравнение, основные этапы становления учения о фотосинтезе. Историческое значение работ К.А. Тимирязева
2 Фотосинтез как основа энергетики биосферы. Космическая роль фотосинтеза. Роль фотосинтеза в процессах энергетического и пластического обмена растительного организма
3 Структурная организация фотосинтетического аппарата
3.1 Лист как орган фотосинтеза
3.2 Состав, строение, функции, возникновение и развитие хлоропластов
4 Пигменты хлоропластов
4.1 Хлорофиллы: состав, структура, биосинтез, оптические и химические свойства, значение
4.2 Каратиноиды. Их структура функции и физиологическая роль
4.3 Фикобилины. Их структура функции и физиологическая роль
4.4 Экологическое значение спектрально-различных форм пигментов у фотосинтезирующих организмов
5 Световая фаза фотосинтеза
5.1 Фотофизический этап. Электронно-возбуждённое состояние пигментов. Представление о фотосинтетической единице. Антенные комплексы. Реакционные центры. Преобразование энергии в реакционном центре
5.2 Фотохимический этап Электронно-транспортная цепь фотосинтеза. Представления о функционировании двух фотосистем. Фотофосфорилирование. Системы фотоокисления воды и выделения кислорода при фотосинтезе. Фотофосфорилирование. Связь фотосинтетической ассимиляции СО2 с фотохимическими реакциями
6 Метаболизм углерода при фотосинтезе (темновая фаза)
6.1 Химизм реакции цикла Кальвина
6.2 Цикл Хэтча-Слэка-Карпилова, его эволюционное значение. Различные типы усвоения углекислого газа С4-растениями
6.3 САМ-тип метаболизма. Потоки метаболитов в хлоропласт и из него
7 Фотодыхание, его значение. Сравнение фотодыхания у растений с различными типами метаболизма углерода
8 Эндогенные механизмы регуляции процесса фотосинтеза
9 Зависимость процесса фотосинтеза от факторов внешней среды
Список литературы
ВВЕДЕНИЕ
Фотосинтез — это процесс трансформации поглощенной организмом энергии света в химическую энергию органических (и неорганических) соединений. Главную роль в этом процессе играет использование энергии света для восстановления С02 до уровня углеводов. Часто говорят о фототрофной функции фотосинтеза, понимая под этим использование энергии света в различных эндергонических реакциях в живом организме. Фотосинтез осуществляют высшие растения, водоросли и некоторые бактерии. Он играет определяющую роль в энергетике биосферы.
Фотосинтез. Определение, общее уравнение, основные этапы становления учения о фотосинтезе. Историческое значение работ К. А. Тимирязева
С древних времен люди отмечали, что деревья могут вырастать на бесплодных скалах. Английский ботаник и химик С.Гейлс в своей книге «Статика растений» (1727) высказал предположение, что растения значительную часть «пищи» получают из воздуха. При этом он вслед за И.Ньютоном полагал, что свет, поглощаемый листьями, «облагораживает» эту «пищу». Сходные мысли находят у М.В.Ломоносова. В «Слове о явлениях воздушных» (1753) он писал: «Преизобильное ращение тучных дерев, которые на бесплодном песку корень свой утверждали, ясно изъявляет, что листами жирный тук из воздуха впитывают...». Так возникла идея о воздушном питании растений.
Началом экспериментальных работ в области фотосинтеза послужили опыты английского химика Дж.Пристли, который в 1771г. обнаружил, что растения мяты, помещенные в стеклянный кувшин, опрокинутый в сосуд с водой, «исправляют» в нем воздух, «испорченный» горением свечи или дыханием мыши. Свеча могла длительно гореть, а мышь дышать, если под стеклянным колпаком находились зеленые растения. В связи с этими и последующими опытами Пристли в 1774 г. открыл кислород. Через год независимо от него кислород был открыт во Франции А.Л.Лавуазье, который и дал название этому газу.
В 1776 г. шведский химик К.В.Шееле повторил опыты Пристли, но не получил того же эффекта, который был описан Пристли. Растения в опытах Шееле делали воздух непригодным для дыхания так же, как горящая свеча. Объяснил противоречие между результатами опытов Пристли и Шееле голландский врач Я.Л.Ингенгауз. Он обнаружил, что все зависит от света: Пристли ставил опыты при ярком свете, Шееле — в помещении с недостаточным освещением. Ингенхауз показал, что зеленые растения выделяют кислород только при действии на них света. Зеленые растения в темноте, а их незеленые органы (например, корни) в темноте и при освещении поглощают кислород точно так же, как животные в процессе дыхания.
Швейцарский естествоиспытатель Ж.Сенебье в 1782 г. установил, что растения на свету не только выделяют кислород, но и поглощают испорченный воздух, т. е. С02. Сенебье назвал поглощение С02 «углеродным питанием».Применив методы количественного анализа, швейцарский ученый Т.Соссюр в 1804 г. показал, что растения на свету действительно усваивают углерод С02, выделяя при этом эквивалентное количество кислорода. Однако нарастание сухой массы растений превышает прирост количества углерода. Это превышение было значительно большим, чем количество поглощенных минеральных веществ. Соссюр сделал вывод, что органическая масса растения образуется не только за счет С02, но и за счет воды, т. е. вода такой же необходимый элемент питания, как и диоксид углерода. Результаты этих опытов были тщательно проверены французским агрохимиком Ж.Б.Буссенго (1840), который полностью подтвердил данные Соссюра.
Французские химики П.Ж..Пельтье и Ж..Каванту в 1817 г. выделили из листьев зеленый пигмент и назвали его хлорофиллом (от греч. «chloros» — зеленый и «phyllon» — лист), который, как выяснилось позднее, целиком локализован в хлоропластах. В 1865 г. немецкий физиолог растений Ю.Сакс продемонстрировал, что на свету в листьях образуется крахмал и что он находится в хлоропластах. Опыты ставили следующим образом. Листья предварительно выдерживали в темноте, затем освещали половинку каждого листа, а другую половинку, закрытую плотным картоном, оставляли в темноте. После экспозиции листья обесцвечивали спиртом и обрабатывали раствором йода. Освещенные части листьев становились темно-фиолетовыми из-за образования комплекса крахмала с йодом, а затемненные участки оставались неокрашенными. Микроскопический анализ показал, что крахмальные зерна образуются именно в хлоропластах. Эта «проба Сакса», как ее стали называть, настолько чувствительна, что на листьях удается получить отпечатки с фотонегативов. На прямом солнечном свету для образования крахмала достаточно уже 5 мин. А.С.Фаминцын в 60-е годы прошлого столетия наблюдал образование крахмала в клетках водоросли спирогиры уже через 30 мин освещения слабым светом керосиновой лампы.
Первые опыты по выяснению места образования кислорода при фотосинтезе были сделаны немецким физиологом Т.В.Энгельманом (1881). Нить спирогиры помещали в камеру с водой или в висячую каплю. Края покровного стекла, которым закрывали ячейку, замазывали вазелином, чтобы кислород воздуха не проникал из внешней среды. В эту же камеру помещались бактерии, способные двигаться только в присутствии кислорода. В темноте водоросль дышала и кислород исчезал из камеры. Затем включается свет и в ходе фотосинтеза выделяется кислород. Оказалось, что при включении света все бактерии «оживали» и скапливались вокруг локально освещенных участков хлоропластов. Следовательно, именно хлоропласты выделяют кислород на свету.
Вопросом о роли света в процессах фотосинтеза начали заниматься с середины XIX в. Американский физик Дж.У.Дрепер в 1846 г , вслед за ним Ю.Сакс и В.Пфеффер считали, что фотосинтез лучше всего осуществляется в желтых лучах, наиболее ярких для человеческого глаза. В то же время было уже хорошо известно, что хлорофилл имеет резко выраженные максимумы поглощения в красной и синей частях спектра. Исходя из этих данных делался вывод, что процесс фотосинтеза не подчиняется закону сохранения энергии, а свет действует на зеленый лист как раздражитель. Против этого утверждения выступили Ю.Р.Майер и Г.Гельмгольц, сформулировавшие закон сохранения и превращения энергии. На основе чисто теоретических рассуждений они утверждали, что зеленые растения поглощают лучистую солнечную энергию и превращают ее в химическую, т. е. фотосинтез — это процесс трансформации энергии света в энергию химических связей. Однако экспериментальных доказательств этой точки зрения не было. Они были получены крупнейшим физиологом растений К.А.Тимирязевым, который изложил их в своей докторской диссертации «Об усвоении света растением» (1875). Тимирязев нашел, что слишком широкие щели при пропускании света, разложенного с помощью призмы, не обеспечивают его монохроматической чистоты. Этот недостаток в постановке опытов и привел Дрепера и Пфеффера к неверным выводам. Тимирязев использовал в работе очень узкие щели и помещал в полоски монохроматического света тонкие пробирки с высечками из листьев. Для этих опытов ему пришлось разработать очень чувствительные методы газового микроанализа. В результате было установлено, что интенсивность ассимиляции С02 максимальна при освещении листьев красным светом, т. е. тем светом, который в наибольшей степени поглощается хлорофиллом.
Тимирязев постулировал, что при ассимиляции С02 хлорофилл служит оптическим сенсибилизатором (т. е. веществом, увеличивающим чувствительность к свету) и что он непосредственно участвует в процессе фотосинтеза, необратимо переходя из восстановленного состояния в окисленное. Он сформулировал также идею о космической роли фотосинтеза: фотосинтез — единственный процесс, с помощью которого космическая солнечная энергия улавливается и остается на Земле, трансформируясь в другие формы энергии. Тимирязев писал, что в хлоропласте лучистая энергия солнечного света превращается в химическую энергию углеводов. Крахмал, клейковина и другие соединения, консервирующие солнечную энергию, служат нам пищей. Освобождаясь в нашем теле в процессе дыхания, эта энергия солнечного луча согревает нас, приводит в движение, поддерживает мышление.
Результаты изучения воздушного питания растений за первые сто лет после опытов Пристли нашли свое выражение в общем уравнении фотосинтеза:
свет
6СО2 + 12Н2О --- С6Н12О6 + 6СО2 + 6Н2О
хлорофилл
Происхождение 02 при фотосинтезе. В приведенном выше уравнении остается неясным, каково происхождение выделяющегося кислорода (из С02 или из Н20). Во второй половине XIX в. и в начале XX в. считалось, что при фотосинтезе происходит фоторазложение С02 с последующим восстановлением углерода до углеводов с участием воды. Немецкий химик А.Байер в 1870 г. предложил следующий порядок реакций:
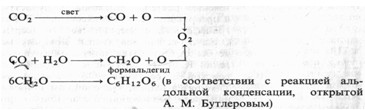
Исходя из этой гипотезы разложения диоксида углерода, можно было предположить, что для образования сахаров и крахмала растения должны усваивать промежуточные продукты — СО или формальдегид. Однако оба соединения оказались токсичными для растений, что указывало на ошибочность схемы Байера.
В 1893 г. крупнейший русский биохимик А.Н.Бах высказал мысль о том, что ассимиляция С02 при фотосинтезе связана не с отщеплением 02 от диоксида углерода, а является сопряженным окислительно-восстановительным процессом, происходящим за счет водорода и гидроксила воды, причем 02 выделяется из воды через промежуточные перекисные соединения.
 Голландский микробиолог К.Б. ван Ниль, изучая особенности бактериального фотосинтеза и сравнивая его с фотосинтезом у растений, в 1937—1941 гг. также пришел к заключению, что первичная фотохимическая реакция фотосинтеза состоит в диссоциации воды, а не в разложении С02. Способные к фотосинтетической ассимиляции С02 бактерии (за исключением цианобактерий) нуждаются в восстановителях типа H2S, Н2, СН3 и других и не выделяют в процессе фотосинтеза кислород. Такой тип фотосинтеза был назван фоторедукцией. Ван Ниль пришел к выводу, что для пурпурных или зеленых серобактерий общее уравнение фотосинтеза может быть представлено следующим образом: С02 + H2A [СН20] + H2O + 2A
Голландский микробиолог К.Б. ван Ниль, изучая особенности бактериального фотосинтеза и сравнивая его с фотосинтезом у растений, в 1937—1941 гг. также пришел к заключению, что первичная фотохимическая реакция фотосинтеза состоит в диссоциации воды, а не в разложении С02. Способные к фотосинтетической ассимиляции С02 бактерии (за исключением цианобактерий) нуждаются в восстановителях типа H2S, Н2, СН3 и других и не выделяют в процессе фотосинтеза кислород. Такой тип фотосинтеза был назван фоторедукцией. Ван Ниль пришел к выводу, что для пурпурных или зеленых серобактерий общее уравнение фотосинтеза может быть представлено следующим образом: С02 + H2A [СН20] + H2O + 2A
 где Н2А — окисляемый субстрат (донор водорода). Он предположил, что для высших растений и водорослей Н2А — это Н20, а 2А — это 02. Тогда первичным фотохимическим актом в фотосинтезе растений должно быть разложение воды на окислитель [ОН] и восстановитель [Н]. Затем первичный восстановитель [Н] восстанавливает С02, а первичный окислитель [ОН] участвует в реакции, в которой высвобождается 02 и снова образуется H20. B соответствии с этим предположением полное уравнение фотосинтеза, по ван Нилю, можно записать так: CO2 + 4H2O хлорофилл [CH2O] + 3H2O + O2 , причем эта суммарная реакцияtслагается из трех этапов:
где Н2А — окисляемый субстрат (донор водорода). Он предположил, что для высших растений и водорослей Н2А — это Н20, а 2А — это 02. Тогда первичным фотохимическим актом в фотосинтезе растений должно быть разложение воды на окислитель [ОН] и восстановитель [Н]. Затем первичный восстановитель [Н] восстанавливает С02, а первичный окислитель [ОН] участвует в реакции, в которой высвобождается 02 и снова образуется H20. B соответствии с этим предположением полное уравнение фотосинтеза, по ван Нилю, можно записать так: CO2 + 4H2O хлорофилл [CH2O] + 3H2O + O2 , причем эта суммарная реакцияtслагается из трех этапов:
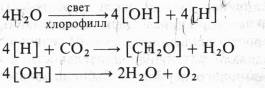
Идеи ван Ниля были поддержаны результатами опытов английского физиолога растений Р. Хилла, который в 1937 г. показал, что изолированные хлоропласты под действием света способны разлагать воду и выделять кислород в присутствии акцепторов электронов (феррицианида, бензохинона и др.). Это явление получило название реакции Хилла. Согласно Хиллу, процесс разложения воды осуществляется в три этапа:
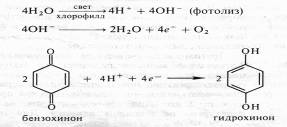
Прямые экспериментальные доказательства того, что кислород при фотосинтезе освобождается именно из воды, были получены в 1941 г. независимо в СССР и в США. А.П.Виноградов и Р.В.Тейс с помощью масс-спектрометра показали, что отношение 160:180 в кислороде, выделяющемся при фотосинтезе, соответствует соотношению этих изотопов в воде, а не в диоксиде углерода. Группа американских ученых, возглавляемая С.Рубеном и М.Каменом, одновременно проводила опыты с водорослями. В одной камере, куда помещались водоросли, вода содержала тяжелый изотоп кислорода (Н2180), а кислород С02 не метился. Во второй камере, наоборот, использовался меченый С02 (С1802), а в состав воды входил обычный кислород. При освещении водорослей в этих камерах 1802 выделялся в значительно большем количестве, если метка была у кислорода воды.
Дата: 2019-07-30, просмотров: 372.