| Поколение | Препарат | Спектр активности |
| I – нефторированные хинолоны | Налидиксиновая кислота Оксолиновая кислота Пипемидиновая кислота | В основном грамотрицательная микрофлора (семейство Enterobacteriaceae) |
| II – «грамотрицательные» фторхинолоны | Норфлоксацин Ципрофлоксацин Пефлоксацин Офлоксацин Ломефлоксацин | Грамотрицательная микрофлора, S. Aureus, низкая активность против Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlamydophila pneumoniae |
| III – «респираторные» фторхинолоны | Левофлоксацин Спарфлоксацин Темафлоксацин* | Увеличение активности против Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlamydophila pneumoniae |
| IV – «респираторные» + «антианаэробные» фторхинолоны | Тровафлоксацин* Клинафлоксацин* Моксифлоксацин Гемифлоксацин** BMS – 284756** | Увеличение активности противStreptococcus pneumoniae, Mycoplasma pneumoniae, Chlamydophila pneumoniae, анаэробов |
Отозван с рынка; ** На стадии клинических испытаний
ПРИЛОЖЕНИЕ 2
Синтез фторхинолонов
Методы построения углеродного скелета хинолоновых молекул хорошо известны, и синтез их фторированных производных не представлял бы проблемы, если бы атомы фтора можно было ввести в уже готовые хинолоновые молекулы. Поскольку прямое введение атомов фтора в ароматическое кольцо связано со значительными трудностями, совершенно очевидно, что стратегия синтеза фторхинолонов должна базироваться на использовании исходных веществ, которые уже содержат атомы фтора, причем в строго определенных положениях ароматического кольца. Ретроспективный анализ показывает, что для получения 6-фторхинолонов пригодны 3-галоген-4-фторзамещенные анилины либо 2,4-дигалоген-5-фторзамещенные бензойные кислоты.
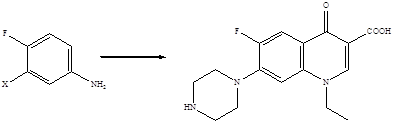
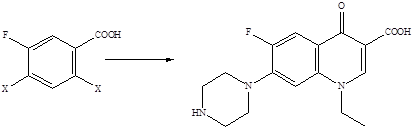
X = F, Cl, Br
4-Фторанилины и 3-фторбензойные кислоты – базовые структуры для получения 6-фторхинолонов
Для получения базовых фтораренов в промышленности чаще всего используют реакции нуклеофильного замещения галогена или диазогруппы фторид-анионом, а далее, как уже отмечалось выше, существуют две стратегии синтеза фторхинолонкарбоновых кислот.
В первом случае фторсодержащие анилины конденсируют сначала с этоксиметиленмалоновым эфиром, а затем проводят внутримолекулярную циклизацию с замыканием пиридонового цикла по реакции Гоулда-Джекобса. Далее NH-хинолон алкилируют, гидролизуют и замещают атом галогена в положении 7 на остаток пиперазина.
Второй метод построения предполагает использование в качестве исходного сырья фторсодержащих производных бензойной кислоты. Ключевым интермедиатом в этом случае является соответствующий 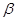 -кетоэфир, который далее конденсируют с орто-муравьиным эфиром. В полученном бензоилакрилате замещают этоксигруппу на остаток амина с последующей внутримолекулярной циклизацией
-кетоэфир, который далее конденсируют с орто-муравьиным эфиром. В полученном бензоилакрилате замещают этоксигруппу на остаток амина с последующей внутримолекулярной циклизацией 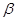 -амино-
-амино- 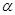 -бензоилакрилата в хинолоновый бицикл.
-бензоилакрилата в хинолоновый бицикл.
|


X = F или Cl
Принципиальные схемы синтеза фторхинолонов [5]
ПРИЛОЖЕНИЕ 3
Дата: 2019-07-30, просмотров: 305.