Наиболее изучены три механизма репарации: 1) фоторепарация (световая), 2) эксцизионная (темновая), или дорепликативная репарация, 3) пострепликативная репарация.
1) Фотореактивация
Фотореактивация заключается в устранении видимым светом димеров тимина, особенно часто возникающих в ДНК под влиянием УФ-лучей. Замена осуществляется особым фотореактивирующим ферментом, молекулы которого не обладают сродством с неповрежденной ДНК, но опознают димеры тимина и связываются с ними сразу после их образования. Этот комплекс остается стабильным, пока не подвергнется действию видимого света. Видимый свет активирует молекулу фермента, она отделяется от димера тимина и одновременно разъединяет его на два отдельных тимина, восстанавливая исходную структуру ДНК.
Темновая репарация
Темновая репарация не требует света. Она способна исправлять очень разнообразные повреждения ДНК. Темновая репарация протекает в несколько этапов при участии нескольких ферментов:
1. Молекулы эндонуклеазы постоянно обследуют молекулу ДНК, опознав повреждение, фермент разрезает вблизи него нить ДНК;
2. Эндо- или экзонуклеаза делает в этой нити второй надрез, иссекая поврежденный участок;
3. Экзонуклеаза значительно расширяет образующуюся брешь, отсекая десятки или сотни нуклеотидов;
4. Полимераза застраивает брешь в соответствии с порядком нуклеотидов во второй (неповрежденной) нити ДНК.
Механизм репарации основан на наличии в молекуле ДНК двух комплементарных цепей. Искажение последовательности нуклеотидов в одной из них обнаруживается специфическими ферментами. Затем соответствующий участок удаляется и замещается новым, синтезированным на второй комплементарной цепи ДНК. Такую репарацию называют эксцизионной, т.е. с «вырезанием» (рис. 3.15). Она осуществляется до очередного цикла репликации, поэтому ее называют также дорепликативной.
Восстановление исходной структуры ДНК требует участия ряда ферментов. Важным моментом в запуске механизма репарации является обнаружение ошибки в структуре ДНК. Нередко такие ошибки возникают во вновь синтезированной цепи в процессе репликации. Ферменты репарации должны обнаружить именно эту цепь. У многих видов живых организмов вновь синтезированная цепь ДНК отличается от материнской степенью метилирования ее азотистых оснований, которое отстает от синтеза. Репарации при этом подвергается неметилированная цепь. Объектом узнавания ферментами репарации могут также служить разрывы в цепи ДНК. У высших организмов, где синтез ДНК происходит не непрерывно, а отдельными репликонами, вновь синтезируемая цепь ДНК имеет разрывы, что делает возможным ее узнавание.
Восстановление структуры ДНК при утрате пуриновых оснований одной из ее цепей предполагает обнаружение дефекта с помощью фермента эндонуклеазы, которая разрывает фосфоэфирную связь в месте повреждения цепи. Затем измененный участок с несколькими примыкающими к нему нуклеотидами удаляется ферментом экзонуклеазой, а на его месте в соответствии с порядком оснований комплементарной цепи образуется правильная нуклеотидная последовательность (рис. 3.15).

При изменении одного из оснований в цепи ДНК в восстановлении исходной структуры принимают участие ферменты ДНК-гликозилазы числом около 20. Они специфически узнают повреждения, обусловленные дезаминированием, алкилированием и другими структурными преобразованиями оснований. Такие модифицированные основания удаляются. Возникают участки, лишенные оснований, которые репарируются, как при утрате пуринов. Если восстановление нормальной структуры не осуществляется, например в случае дезаминирования азотистых оснований, происходит замена одних пар комплементарных оснований другими —пара Ц—Г может заменяться парой Т—А и т.п. (см. разд. 3.4.2.3).
Образование в полинуклеотидных цепях под действием УФ-лучей тиминовых димеров (Т—Т) требует участия ферментов, узнающих не отдельные измененные основания, а более протяженные повреждения структуры ДНК. Репаративный процесс в этом случае также связан с удалением участка, несущего димер, и восстановлением нормальной последовательности нуклеотидов путем синтеза на комплементарной цепи ДНК.
В том случае, когда система эксцизионной репарации не исправляет изменения, возникшего в одной цепи ДНК, в ходе репликации происходит фиксация этого изменения и оно становится достоянием обеих цепей ДНК. Это приводит к замене одной пары комплементарных нуклеотидов на другую либо к появлению разрывов (брешей) во вновь синтезированной цепи против измененных участков. Восстановление нормальной структуры ДНК при этом может произойти и после репликации.
Пострепликативная репарация
Пострепликативная репарация осуществляется путем рекомбинации (обмена фрагментами) между двумя вновь образованными двойными спиралями ДНК. Примером такой пострепликативной репарации может служить восстановление нормальной структуры ДНК при возникновении тиминовых димеров (Т—Т), когда они не устраняются самопроизвольно под действием видимого света (световая репарация) или в ходе дорепликативной эксцизионной репарации.
Ковалентные связи, возникающие между рядом стоящими остатками тимина, делают их не способными к связыванию с комплементарными нуклеотидами. В результате во вновь синтезируемой цепи ДНК появляются разрывы (бреши), узнаваемые ферментами репарации. Восстановление целостности новой полинуклеотидной цепи одной из дочерних ДНК осуществляется благодаря рекомбинации с соответствующей ей нормальной материнской цепью другой дочерней ДНК. Образовавшийся в материнской цепи пробел заполняется затем путем синтеза на комплементарной ей полинуклеотидной цепи (рис. 3.16). Проявлением такой пострепликативной репарации, осуществляемой путем рекомбинации между цепями двух дочерних молекул ДНК, можно считать нередко наблюдаемый обмен материалом между сестринскими хроматидами (рис. 3.17).
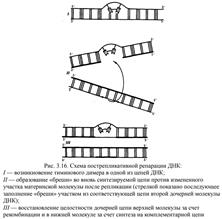
В ходе дорепликативной и пострепликативной репарации восстанавливается большая часть повреждений структуры ДНК. Однако, если в наследственном материале клетки возникает слишком много повреждений и часть из них не ликвидируется, включается система индуцируемых (побуждаемых) ферментов репарации (SOS-система). Эти ферменты заполняют бреши, восстанавливая целостность синтезируемых полинуклеотидных цепей без точного соблюдения принципа комплементарности. Вот почему иногда сами процессы репарации могут служить источником стойких изменений в структуре ДНК (мутаций). Названная реакция также относится к SOS-системе.
Если в клетке, несмотря на осуществляемую репарацию, количество повреждений структуры ДНК остается высоким, в ней блокируются процессы репликации ДНК.
Такая клетка не делится, а значит, не передает возникших изменений потомству. Вызываемая повреждениями ДНК остановка клеточного цикла в сочетании с невозможностью молекулярной репарации измененного наследственного материала может с участием белка, синтез которого контролируется геном р53, приводить к активации процесса самоликвидации (апоптоз) дефектной клетки с целью устранения ее из организма. Таким образом, обширный набор различных ферментов репарации осуществляет непрерывный «осмотр» ДНК, удаляя из нее поврежденные участки и способствуя поддержанию стабильности наследственного материала. Совместное действие ферментов репликации (ДНК-полимераза и редактирующая эндонуклеаза) и ферментов репарации обеспечивает достаточно низкую частоту ошибок в молекулах ДНК, которая поддерживается на уровне 1 · 10-9 пар измененных нуклеотидов на геном. При размере генома человека 3 · 109 нуклеотидных пар это означает появление около 3 ошибок на реплицирующийся геном. Вместе с тем даже этот уровень достаточен для образования за время существования жизни на Земле значительного генетического разнообразия в виде генных мутаций.
73. Фотореактивация.
Фотореактивация заключается в устранении видимым светом димеров тимина, особенно часто возникающих в ДНК под влиянием УФ-лучей. Замена осуществляется особым фотореактивирующим ферментом, молекулы которого не обладают сродством с неповрежденной ДНК, но опознают димеры тимина и связываются с ними сразу после их образования. Этот комплекс остается стабильным, пока не подвергнется действию видимого света. Видимый свет активирует молекулу фермента, она отделяется от димера тимина и одновременно разъединяет его на два отдельных тимина, восстанавливая исходную структуру ДНК.
74. Темновая репарация.
При световой репарации исправляются повреждения, возникшие только под воздействием ультрафиолетовых лучей, при темновой - повреждения, появившиеся под влиянием жесткой радиации, химических веществ и т.д.
Темновая репарация не требует света. Она способна исправлять очень разнообразные повреждения ДНК. Темновая репарация протекает в несколько этапов при участии нескольких ферментов:
1. Молекулы эндонуклеазы постоянно обследуют молекулу ДНК, опознав повреждение, фермент разрезает вблизи него нить ДНК;
2. Эндо- или экзонуклеаза делает в этой нити второй надрез, иссекая поврежденный участок;
3. Экзонуклеаза значительно расширяет образующуюся брешь, отсекая десятки или сотни нуклеотидов;
4. Полимераза застраивает брешь в соответствии с порядком нуклеотидов во второй (неповрежденной) нити ДНК.
Механизм репарации основан на наличии в молекуле ДНК двух комплементарных цепей. Искажение последовательности нуклеотидов в одной из них обнаруживается специфическими ферментами. Затем соответствующий участок удаляется и замещается новым, синтезированным на второй комплементарной цепи ДНК. Такую репарацию называют эксцизионной, т.е. с «вырезанием» (рис. 3.15). Она осуществляется до очередного цикла репликации, поэтому ее называют также дорепликативной.
Восстановление исходной структуры ДНК требует участия ряда ферментов. Важным моментом в запуске механизма репарации является обнаружение ошибки в структуре ДНК. Нередко такие ошибки возникают во вновь синтезированной цепи в процессе репликации. Ферменты репарации должны обнаружить именно эту цепь. У многих видов живых организмов вновь синтезированная цепь ДНК отличается от материнской степенью метилирования ее азотистых оснований, которое отстает от синтеза. Репарации при этом подвергается неметилированная цепь. Объектом узнавания ферментами репарации могут также служить разрывы в цепи ДНК. У высших организмов, где синтез ДНК происходит не непрерывно, а отдельными репликонами, вновь синтезируемая цепь ДНК имеет разрывы, что делает возможным ее узнавание.
Восстановление структуры ДНК при утрате пуриновых оснований одной из ее цепей предполагает обнаружение дефекта с помощью фермента эндонуклеазы, которая разрывает фосфоэфирную связь в месте повреждения цепи. Затем измененный участок с несколькими примыкающими к нему нуклеотидами удаляется ферментом экзонуклеазой, а на его месте в соответствии с порядком оснований комплементарной цепи образуется правильная нуклеотидная последовательность (рис. 3.15).

При изменении одного из оснований в цепи ДНК в восстановлении исходной структуры принимают участие ферменты ДНК-гликозилазы числом около 20. Они специфически узнают повреждения, обусловленные дезаминированием, алкилированием и другими структурными преобразованиями оснований. Такие модифицированные основания удаляются. Возникают участки, лишенные оснований, которые репарируются, как при утрате пуринов. Если восстановление нормальной структуры не осуществляется, например в случае дезаминирования азотистых оснований, происходит замена одних пар комплементарных оснований другими —пара Ц—Г может заменяться парой Т—А и т.п. (см. разд. 3.4.2.3).
Образование в полинуклеотидных цепях под действием УФ-лучей тиминовых димеров (Т—Т) требует участия ферментов, узнающих не отдельные измененные основания, а более протяженные повреждения структуры ДНК. Репаративный процесс в этом случае также связан с удалением участка, несущего димер, и восстановлением нормальной последовательности нуклеотидов путем синтеза на комплементарной цепи ДНК.
В том случае, когда система эксцизионной репарации не исправляет изменения, возникшего в одной цепи ДНК, в ходе репликации происходит фиксация этого изменения и оно становится достоянием обеих цепей ДНК. Это приводит к замене одной пары комплементарных нуклеотидов на другую либо к появлению разрывов (брешей) во вновь синтезированной цепи против измененных участков. Восстановление нормальной структуры ДНК при этом может произойти и после репликации.
75. Мутации, связанные с нарушением репарации и их роль в патологии.
Спонтанные повреждения ДНК встречаются довольно часто, такие события имеют место в каждой клетке. Для устранения последствий подобных повреждений имеется специальные репарационные механизмы(например, ошибочный участок ДНК вырезается и на этом месте восстанавливается исходный). Мутации возникают лишь тогда, когда репарационный механизм по каким-то причинам не работает или не справляется с устранением повреждений.
Мутации, возникающие в генах, кодирующих белки, ответственные за репарацию, могут приводить к многократному повышению (мутаторный эффект) или понижению (антимутаторный эффект) частоты мутирования других генов. Так, мутации генов многих ферментов системыэксцизионной репарацииприводят к резкому повышению частоты соматических мутаций у человека, а это, в свою очередь, приводит к развитию пигментнойксеродермыи злокачественных опухолей покровов.
n Белок р53 – «страж клеточного генома». Обнаружив мутацию, он блокирует репликацию ДНК до исправления. Если исправление невозможно, в клетке включается программа апоптоза.
Пигментная ксеродерма - группа заболеваний, при которых отмечается повышенная чувствительность кожи к солнечным лучам (покраснение.Пигментация, изъязвления, злокачественные образования). Это рецессивно аутосомное заболевание. Фибробласты кожи больных людей более чувствительны к ультрафиолетовым лучам, чем фибробласты здоровых людей. Это связано с тем, что они обладают пониженной способностью выщеплять димеры тимина, следовательно, имеет место нарушение репарации на первом ее этапе, то есть произошла мутация в гене, кодирующем синтез ультрафиолетовой специфической эндонуклеазы. Возможны нарушения и на других этапах репарации ДНК или даже на нескольких этапах.
Атаксия - телеангиоэктазия (синдром Луи Бара) - прогрессирующая атаксия мозжечка с нарушением координации движений, телеангиоэктазия склер. В этом случае сильно запаздывает второй этап репарации - удаление поврежденных оснований молекулы ДНК.
Синдром Блума - сочетание недоразвития скелета, гипофизарной карликовости, гипогонадизма с врожденной телеангиоэктатической эритермой лица, участками гиперкератоза и гиперпигментации на туловище. Эти аномалии связаны с нарушением пострепликативного восстановления - 4, 5 этапов репарации.
Синдром Коккейна – наследственное заболевание, с поражением кожи и её придатков, органов зрения, слуха и нарушением репарации. Синдром обусловлен мутациями в генах, кодирующие белки, ответственные за эксцизионную репарацию. Ребенок имеет внешний вид «старика», волосы быстро седеют, повышенная фоточувствительность может стать причиной появления на лице пигментации.
Анемия Фанкони – аутосомно-рецессивное заболевание, характеризующееся поражением всех элементов костного мозга, наблюдается нарушение вырезания пиримидиновых димеров, а также нарушение репарации межцепочечных сшивок.
76. Иммунитет как проявление генетического гомеостаза.
В настоящее время иммунитет определяют как способ защиты от всего, несущего признаки генетической чужеродности.
Биологический смысл иммунитета — обеспечение генетической целостности организма на протяжении его индивидуальной жизни.
Существует две разновидности иммунитета: клеточный и гуморальный. Пeрвый из них, в котoром используются Т-лимфоциты (тимус-зaвисимые), обеспечивает противовирусную и противоопухолeвую защиту; вторoй реализуeтся В-лимфоцитами (тимус-незaвисимыми), они вырабатывают антитела. Генетический гомеостаз на организменном уровне поддерживается неспецифическими механизмами защиты и системой иммунитета. Hеспецифические механизмы защиты противодействуют проникновению любых факторов из внешней среды, способных нарушить генетический гомеостаз, а так же нейтрализуют аномальные факторы, оказавшиеся в организме. Формы неспецифической защиты образуют две группы: клеточные и гуморальные.
Гомеостаз - это способность биологических систем противостоять изменениям и сохранять динамическое постоянство состава и свойств организма.
Болезнь - нарушение гомеостаза, результат рассогласования между реальной ситуацией и адаптивной программой организма.
В настоящее время иммунитет определяют как способ защиты от всего, несущего признаки генетической чужеродности.
Иммунная система возникла с появлением многоклеточных организмов и развилась как фактор, способствующий их выживанию
Иммунная система имеет три особенности:
а) генерализована по всему телу;
б) ее клетки постоянно циркулируют по всему телу через кровоток и лимфоток;
в) может вырабатывать сугубо специфические молекулы антител.
При формировании иммунной системы важную роль играет аппендикс. Аппендикс нам необходим в младенчестве и первые годы жизни. Наибольшего развития он достигает вскоре после рождения, а затем орган начинает регрессировать.
Все иммунокомпетент-ные клетки происходят из единой стволовой клетки костного мозга
Центральные органы иммунной системы – костный мозг и тимус.
При системной красной волчанке антитела связываются с ДНК и разрушают ее.
Лимфоциты - клетки, на которые возложены ключевые функции по осуществлению приобретённого иммунитета лейкоцитов
Т-киллеры разрушают инфицированные и злокачественные клетки.
Т-хелперы – посредники. Они вызывают превращение определенных клонов. В-лимфоцитов в плазматические клетки. Т-лимфоциты (хелперы) «инспектируют» В-лимфоцит, пытаясь обнаружить следы специфического антигена. ВИЧ поражает Т-хелперное звено иммунитета. Т-супрессоры - регулируют образование антител, подавляя Т-хелперы; накапливаются при старении, опухолевом росте, аутоиммунных заболеваниях.
Антиген – чужеродное для организма вещество, способное вызвать иммунный ответ
Антитело – белок сыворотки крови, специфически нейтрализующий антиген, вызвавший его образование. В основе многообразия антител лежит альтернативный сплайсинг
Цитокины являются молекулами-передатчиками сигнала. Они объединяют разные клетки для борьбы с инфекцией. Продуцентами цитокинов являются макрофаги. Интерлейкины - группа цитокинов, опосредующих активацию и взаимодействие иммунокомпетентных клеток в процессе иммунного ответа. ИЛ1 вызывает сонливость больного. ИЛ2 стимулирует размножение Т-хелперов. ИЛ2, ИЛ-4,-ИЛ6 включают клетки, которые убивают клетки с вирусом или раковые. ИЛ-4, 5, 6, выделяемые Т-хелперами, подключают к борьбе В-лимфоциты, которые, превращаясь в плазматические клетки, производят антитела.
Белок р53 – «страж клеточного генома». Обнаружив мутацию, он блокирует репликацию ДНК до исправления. Если исправление невозможно, в клетке включается программа апоптоза.
77. Иммунитет и старение. Иммунитет и канцерогенез.
Старение
С возрастом заметно изменяются функции иммунной системы. За гуморальный иммунитет ответственны В-лимфоциты, вырабатывающие антитела к носителям чужеродной биологической информации — антигенам. Т-лимфоциты ответственны за клеточный иммунитет, например за отторжение трансплантата, хотя могут участвовать в реакциях гуморального иммунитета. К старости наблюдается ослабление реакций как гуморального, так и клеточного иммунитета. Становление функции иммунной системы во многом связано с активностью тимуса, которая прекращается в связи с инволюцией железы по достижении половозрелого возраста (рис. 8.30). Нарушение естественного развития иммунной системы в эксперименте путем удаления вилочковой железы (например, у мышей) сокращает продолжительность жизни животных. Напротив, пересадка тимуса и костного мозга от молодой мыши к старой приводит к омоложению иммунной системы 19-месячной мыши до уровня 4-месячной. Некоторые такие животные жили на Уз дольше своего обычного срока.
В стареющем организме клетки иммунной системы ошибочно вырабатывают антитела против собственных клеток и белков. Таким образом, старение сопровождается нарастанием аутоиммунных реакций.
Канцерогенез
Канцерогенез — сложный патофизиологический процесс зарождения и развития опухоли.
Существует мнение, что в организме человека постоянно образуются потенциальные опухолевые клетки. Однако в силу своей антигенной гетерогенности они быстро распознаются и разрушаются клетками иммунной системы. Нормальное функционирование иммунной системы является основным фактором натуральной защиты от опухолей. Этот факт доказан клиническими наблюдениями за больными с ослабленной иммунной системой, у которых опухоли встречаются в десятки раз чаще, чем у людей с нормально работающей иммунной системой.
Канцерогенные факторы
На данный момент известно большое количество факторов, способствующих канцерогенезу:
Химические факторы
Вещества ароматической природы (полициклические и гетероциклические ароматические углеводороды, ароматические амины), некоторые металлы и пластмассы обладают выраженным канцерогенным свойством благодаря их способности реагировать с ДНК клеток, нарушая ее структуру (мутагенная активность). Канцерогенные вещества в больших количествах содержатся в продуктах горения автомобильного и авиационного топлива, в табачных смолах. При длительном контакте организма человека с этими веществами могут возникнуть такие заболевания, как рак легкого, рак толстого кишечника и др. Известны также эндогенные химические канцерогены(ароматические производные аминокислоты триптофана), вызывающие гормонально зависящие опухоли половых органов.
Физические факторы
Солнечная радиация (в первую очередь ультрафиолетовое излучение) и ионизирующее излучение также обладает высокой мутагенной активностью. Так, после аварии Чернобыльской АЭС отмечено резкое увеличение заболеваемости раком щитовидной железы у людей, проживающих в зараженной зоне. Длительное механическое или термическое раздражение тканей также является фактором повышенного риска возникновения опухолей слизистых оболочек и кожи(рак слизистой рта, рак кожи, рак пищевода).
Биологические факторы
Доказана канцерогенная активность вируса папиломы человека в развитии рака шейки матки[2], вируса гепатита Вв развитии рака печени,ВИЧ — в развитии саркомы Капоши. Попадая в организм человека, вирусы активно взаимодействуют с его ДНК, что в некоторых случаях вызывает трансформацию собственных протоонкогенов человека в онкогены. Геном некоторых вирусов (ретровирусы) содержит высоко активные онкогены, активирующиеся после включения ДНК вируса в ДНК клеток человека.
Дата: 2019-07-31, просмотров: 575.