Химические реакции, которые протекают со сравнимыми скоростями в обоих направлениях, называются обратимыми. В таких реакциях образуются равновесные смеси реагентов и продуктов, состав которых далее уже не меняется со временем. Например, при нагревании происходят следующие превращения:
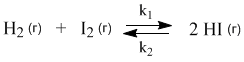
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем[1].
А2 + В2 ⇄ 2AB
Смещение химического равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие.
20
Понятие и типы гидролиза. Константа и степень гидролиза. Роль гидролиза
Гидро́лиз (от др.-греч. ὕδωρ «вода» + λύσις «разложение») — сольволиз водой. Это химическая реакция взаимодействия вещества с водой, при которой происходит разложение этого вещества и воды с образованием новых соединений. Гидролиз соединений различных классов (соли, углеводы, белки, сложные эфиры, жиры и др.) существенно различается.
Типы
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах растворимых солей. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде.
Различают обратимый и необратимый гидролиз солей:
1. 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону){\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftharpoons HCO_{3}^{-}+OH^{-}}}}
2.
3.
4. {\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}O\rightleftharpoons NaHCO_{3}+NaOH}}}2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):{\displaystyle {\mathsf {Cu^{2+}+H_{2}O\rightleftharpoons CuOH^{+}+H^{+}}}}{\displaystyle {\mathsf {CuCl_{2}+H_{2}O\rightleftharpoons CuOHCl+HCl}}}
5. 3.Гидролиз соли слабой кислоты и слабого основания.{\displaystyle {\mathsf {2Al^{3+}+3S^{2-}+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}S\uparrow }}}{\displaystyle {\mathsf {Al_{2}S_{3}+6H_{2}O\rightarrow 2Al(OH)_{3}\downarrow +3H_{2}S\uparrow }}}
6. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален
Степень гидролиза
Степень гидролиза
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр);
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учётом стехиометрических коэффициентов. Вообще, для любой химической реакции вида.
αА+bB͢ cC+dD
константа равновесия определяется по следующей формуле:
{\displaystyle K={\frac {[A]^{a}[B]^{b}}{[C]^{c}[D]^{d}}}}
21
Окислительно-восстановительные реакции. Определение стехиометрических коэффициентов в уравнениях ОВР. Стандартные потенциалы.
Окислительно-восстановительные реакции в растворах.
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окисление — это процесс отдачи электронов атомом, молекулой или ионом.
Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Дата: 2019-07-31, просмотров: 305.