16.
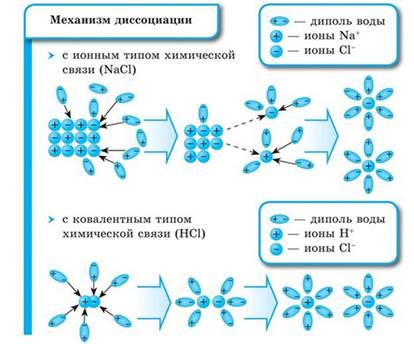
Механизм электролитической диссоциации. Степень диссоциации. Сила электролитов. Реакции ионного обмена
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если а = 0, то диссоциация отсутствует, а если а = 1, или 100 %, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Процесс распада электролита на ионы называется электролитической диссоциацией.
Степень диссоциации — это отношение числа частиц, распавшихся на ионы (Ng), к общему числу растворенных частиц (Np).
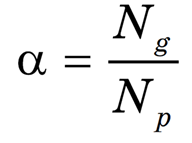
Реакция ионного обмена — один из видов химических реакций, протекающих в полярных растворителях между ионами исходных компонентов. Обратимые реакциионного обмена приводят к наличию в растворах продуктов перекрестного синтеза, например, из смеси растворов хлорида натрия и бромида калия при выпаривании кристаллизуются четыре вещества. Необратимые реакциионного обмена сводятся к образованию из ионов нерастворимых соединений с их выделением в виде воды, газа или осадка
Введение, правило Бертолле
Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Ионными уравнениями могут быть изображены любые реакции, протекающие в полярных растворах между электролитами. Если при таких реакциях не происходит изменения зарядов ионов (не изменяется степень окисления), то они называются ионообменными.
Реакцию обмена в растворе можно выразить тремя видами уравнений: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
Примеры:
AgNO3 + HCl = AgCl + HNO3
Реакция протекает до конца, так как выпадает осадок хлорида серебра.
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода.
Na2CO3 + 2H2SO4 = Na2SO4 + CO2 + H2O
Реакция протекает до конца, так как образуется углекислый газ.
17
Стандартная энтальпия химической реакции
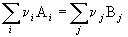
равна разности энтальпий сгорания реагентов и продуктов реакции (с учетом стехиометрических коэффициентов):
18
Степень гидролиза
Степень гидролиза
Под степенью гидролиза понимается отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. Обозначается α (или hгидр);
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учётом стехиометрических коэффициентов. Вообще, для любой химической реакции вида.
αА+bB͢ cC+dD
константа равновесия определяется по следующей формуле:
{\displaystyle K={\frac {[A]^{a}[B]^{b}}{[C]^{c}[D]^{d}}}}
21
16.
Механизм электролитической диссоциации. Степень диссоциации. Сила электролитов. Реакции ионного обмена
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если а = 0, то диссоциация отсутствует, а если а = 1, или 100 %, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Дата: 2019-07-31, просмотров: 277.